생화학
| 분류:생화학의 일부 |
| 생화학 |
|---|
 |
| 생화학 | |
|---|---|
 | |
| 학문명 | 생화학 |
| 다른 이름 | 생물화학 |
생화학(生化學, 영어: biochemistry 또는 biological chemistry)은 살아있는 생물체 내부의 구성 성분 및 생물체와 관련된 생리작용 또는 화학적 과정에 대해 연구하는 학문이다.[1] 생물화학(生物化學, 영어: biological chemistry)이라고도 하지만, 보통 줄여서 생화학이라고 한다. 생화학적 과정들은 생명의 복잡성을 야기한다.
생물학과 화학의 하위 분야인 생화학은 분자유전학, 단백질 과학, 물질대사의 세 가지 분야로 나눌 수 있다. 20세기의 지난 수 십년 동안 생화학은 이들 세 가지 분야를 통해 생명의 과정을 설명하는데 성공하였다. 또한 생명과학의 거의 모든 분야들이 생화학적 방법론과 연구에 의해 밝혀지고 발전하고 있다.[2] 생화학은 생체분자들이 어떻게 살아있는 세포 내에서 그리고 세포들 사이에서 일어나는 과정들을 발생시키는지를 이해하는데 초점을 맞추고 있으며,[3] 이는 차례로 조직, 기관, 개체의 구조와 기능에 대한 연구와 이해와 크게 관련되어 있다.[4]
생화학은 DNA에 암호화되어 있는 유전 정보가 생명의 과정을 일으킬 수 있는 분자 메커니즘에 관한 연구인 분자생물학과 밀접한 관련이 있다.[5]
생화학의 대부분은 단백질, 핵산, 탄수화물, 지질과 같은 생물학적 고분자의 구조, 기능, 상호작용 등에 대해 다루며, 이들 생체분자들은 세포의 구조를 형성하고 생명활동과 관련된 많은 기능들을 수행한다.[6] 세포의 화학작용은 더 작은 분자들과 이온들에 달려있다. 이것들은 물, 금속 이온과 같은 무기 화합물이거나 단백질 합성에 사용되는 아미노산과 같은 유기 화합물일 수 있다.[7] 세포가 화학 반응을 통해 환경으로부터 에너지를 이용하는 메커니즘은 물질대사로 알려져 있다. 생화학에서의 발견은 주로 의학, 영양학, 농업에 적용된다. 의학에서 생화학자들은 질병의 원인과 질병의 치료 방법 및 의약품에 대해 연구한다.[8] 영양학에서 생화학자들은 건강을 유지하는 방법과 영양소 결핍의 영향에 대해 연구한다.[9] 농업에서 생화학자는 양과 비료를 조사하고, 작물 재배, 작물의 저장 및 해충 방제를 개선할 수 있는 방법을 발견하려고 노력한다.
역사[편집]

생화학을 가장 넓은 정의로 보면 생물체의 구성 요소와 구성 체제, 그리고 이들이 어떻게 결합하여 생물체가 되는가에 대한 연구로 볼 수 있는데, 이러한 의미에서 생화학의 역사는 고대 그리스까지 거슬러 올라갈 수 있다.[10] 그러나 특정 과학 분야로서의 생화학은 생화학의 어떤 측면에 초점을 맞추느냐에 따라 19세기 또는 이보다 조금 더 이른 시기에 시작되었다. 어떤 이들은 생화학의 시작이 앙셀름 파얜이 1833년에 최초로 효소인 다이아스테이스(오늘날 아밀레이스라 불리는)를 발견한 것일지도 모른다고 주장[11] 하는 반면, 또 다른 이들은 에두아르트 부흐너가 세포 추출물에서 복잡한 생화학적 과정인 알코올 발효를 최초로 증명한 것을 생화학의 탄생으로 여기기도 한다.[12][13] 일부는 1842년에 유스투스 폰 리비히의 생리학 및 병리학에서 물질대사에 대한 화학적 이론을 제시한 유기화학에서의 영향력 있는 연구를 생화학의 시작이라 꼽기도 하며,[10] 또는 보다 이른 시기인 18세기에 앙투안 라부아지에의 발효 및 세포 호흡에 대한 연구를 생화학의 시작이라 보기도 한다.[14][15] 생화학의 복잡성을 밝혀내는데 도움을 준 이 분야의 많은 개척자들도 현대 생화학의 창시자로 알려져 있다. 예를 들어, 에밀 피셔는 단백질 화학에 대한 연구를,[16] 프레더릭 가울랜드 홉킨스는 효소와 생화학의 역동적인 성질에 대해 연구했다.[17]
"생화학(biochemistry)"이라는 용어 자체는 "생물학(biology)"과 "화학(chemistry)"의 결합으로부터 유래하였다. 1877년에 펠릭스 호페 자일러(Felix Hoppe-Seyler)는 《생리화학 저널》(Zeitschrift für Physiologische Chemie) 제1호의 서문에서 생화학이란 용어를 생리화학의 동의어로 사용하였고, 생화학 여구 기관의 설립을 주장했다.[18][19] 그럼에도 불구하고 일부는 독일의 화학자 칼 노이베르크(Carl Neuberg)가 1903년에 생화학이란 용어를 만들었다고 주장하며,[20][21][22] 또 다른 이들은 프란츠 호프마이스터(Franz Hofmeister)가 생화학이란 용어를 만들었다고 주장하기도 한다.[23]
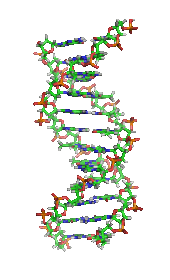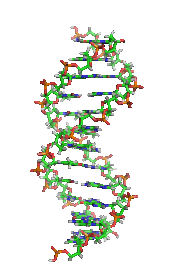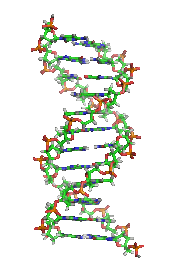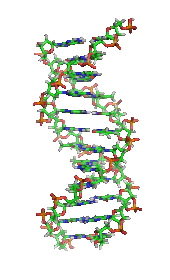
한 때는 생명체와 생명체의 물질들이 무생물과 구별되는 어떤 본질적인 특성이나 물질(흔히 "생기론"으로 일컬어짐)을 가지고 있다고 일반적으로 믿어졌고, 오직 생명체만이 생명의 분자를 생산할 수 있다고 생각하였다.[25] 그런데 1828년에 프리드리히 뵐러는 요소 합성에 대한 논문을 발표하여, 유기 화합물을 인위적으로 만들 수 있음을 증명하였다.[26] 그 이후 생화학은 특히 20세기 중반부터 크로마토그래피, X선 결정학, 이중 분극 간섭계, 핵자기 공명분광법, 방사성 동위원소 표지법, 전자현미경, 분자동역학 시뮬레이션과 같은 새로운 기술이 발달하면서 발전하였다. 이러한 기술들은 해당과정 및 시트르산 회로와 같은 세포의 많은 분자들과 대사 경로의 발견과 상세한 분석을 가능하게 했으며, 분자 수준에서 생화학에 대한 이해를 발전시켰다. 필립 랜들(Philip Randle)은 1963년에 발견한 랜들 회로(포도당-지방산 회로) 및 당뇨병에 대한 연구로 잘 알려져 있다. 랜들은 지방산이 근육에 의한 포도당의 산화를 감소시킨다는 것을 확인했다. 고지방 산화가 인슐린 저항성의 원인이었다.[27]
생화학에서 또 다른 중요한 역사적 사건은 유전자와 세포에서 정보 전달에 관여하는 유전자의 역할의 발견이었다. 생화학에서 이러한 부분을 흔히 분자생물학이라고 부른다.[28] 1950년대에 제임스 D. 왓슨, 프랜시스 크릭, 로절린드 프랭클린, 모리스 윌킨스는 DNA 구조를 밝혀내고, 유전 정보의 전달 관계를 제안하는데 중요한 역할을 했다.[29] 조지 비들과 에드워드 테이텀은 균류에서 하나의 유전자는 하나의 효소를 생성한다는 것을 보여준 공로로 1958년에 노벨 생리학·의학상을 수상하였다.[30] 콜린 피치포크(Colin Pitchfork)는 1988년에 DNA 증거로 살인 혐의에 대한 유죄 판결을 받은 최초의 사람으로, 이것은 법과학의 발전을 이끌었다.[31] 앤드루 파이어와 크레이그 멜로는 유전자 발현의 침묵에서 RNA 간섭(RNAi)의 역할을 발견한 공로로 2006년에 노벨 생리학·의학상을 수상하였다.[32]
시작 물질: 생명의 화학 원소[편집]
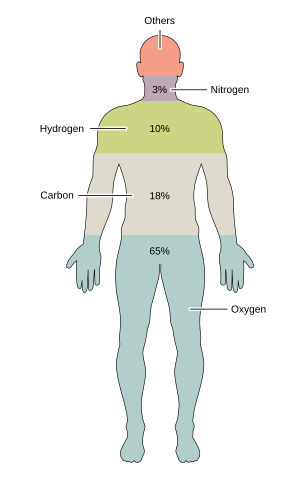
자연에서 발견되는 92가지의 화학 원소들 중 약 24가지는 다양한 종류의 생명체에 필수적이다. 지구 상의 희토류 원소는(셀레늄과 아이오딘을 제외하고는) 생명체에서 사용되지 않고, 몇 가지 흔한 원소들(알루미늄과 티타늄)도 생명체에서 사용되지 않는다. 대부분의 생물체들은 필요로 하는 원소들의 종류가 공통적이지만, 식물과 동물 사이에는 몇 가지 차이점이 있다. 예를 들어, 바다 조류는 브로민을 사용하지만, 육상 식물과 동물은 브로민을 필요로 하지 않는 것처럼 보인다. 모든 동물은 나트륨을 필요로 하지만, 일부 식물은 나트륨을 필요로 하지 않는다. 식물은 붕소와 규소가 필요하지만, 동물들은 그렇지 않을 수도(또는 극소량이 필요할 수도) 있다.
산소, 탄소, 수소, 질소, 칼슘, 인의 6가지 원소들은 사람의 세포를 포함한 살아있는 세포 질량의 약 99%를 차지한다. 인체의 대부분을 구성하는 6가지 주요 원소 외에도, 사람은 18가지 이상의 미량 원소들을 필요로 한다.[33]
생체분자[편집]
생체분자의 4가지 주요 부류는 탄수화물, 지질, 단백질, 핵산이다.[34] 많은 생물학적 분자(생체분자)들은 중합체이다. 단위체는 중합체로 알려진 큰 고분자를 생성하기 위해 서로 연결되어 있는 상대적으로 작은 분자들이다. 단량체가 서로 연결되어 생체고분자를 합성할 때 탈수 반응을 거치게 된다. 서로 다른 고분자들은 더 큰 복합체를 구성할 수 있으며, 이러한 복합체들은 종종 생물활성에 필요하다.
탄수화물[편집]
탄수화물의 주요 기능 중 두 가지는 에너지의 저장과 구조의 형성이다. 당(糖)은 탄수화물이지만, 모든 탄수화물이 당인 것은 아니다. 지구 상에는 다양한 종류의 탄수화물들이 존재한다. 탄수화물은 에너지 저장에 사용될 뿐만 아니라 세포와 세포 사이의 상호작용 및 세포 신호전달에 중요한 역할을 한다.
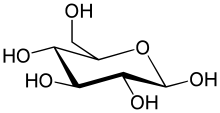
가장 단순한 형태의 탄수화물은 단당류이며, 대부분 탄소, 수소, 산소가 1:2:1의 비율로(일반적인 화학식은 CnH2nOn,여기서 n은 3이상) 포함되어 있다. 포도당(C6H12O6)은 가장 중요한 탄수화물이다. 과당(C6H12O6)은 과일의 단맛과 관련있는 단당류이며,[35][a] 디옥시리보스(C5H10O4)는 DNA의 구성 성분이다. 단당류는 선형 또는 고리형으로 존재할 수 있다. 선형의 단당류는 카보닐기와 하이드록시기의 반응으로 산소 원자가 고리에 포함된 탄소 고리의 형태를 형성할 수 있다. 고리형 분자는 알도스이면 헤미아세탈, 케토스이면 헤미케탈이다.[36]

이들 고리형에서, 고리는 보통 5개 또는 6개의 원자를 갖는다. 5원자 고리형은 5원자 고리 화합물인 푸란을 닮아서 푸라노스라고 하며, 6원자 고리형은 6원자 고리 화합물인 피란을 닮아서 피라노스라고 한다. 예를 들어, 알도헥소스인 글루코스(포도당)은 1번 탄소의 카보닐기와 4번 탄소의 하이드록시기 사이에 결합이 만들어져 헤미아세탈이 형성되면, 글루코푸라노스라고 불리는 5원자 고리 구조를 생성할 수 있다. 같은 반응이 글루코스의 1번 탄소의 카보닐기와 5번 탄소의 하이드록시기 사이에 일어나면, 글루코피라노스라고 불리는 6원자 고리 구조를 생성할 수 있다.
두 개의 단당류는 물 분자가 방출되는 탈수 반응을 통해 글리코사이드 결합을 형성하여 이당류를 생성할 수 있다. 이당류는 가수분해 반응으로 글리코사이드 결합이 분해되어 2개의 단당류를 생성할 수 있다. 가장 잘 알려져 있는 이당류는 포도당 1분자와 과당 1분자로 구성된 수크로스(설탕)이다. 또 다른 주요 이당류는 포도당 1분자와 갈락토스 1분자로 구성된 우유에서 발견되는 젖당이다. 젖당(락토스)는 락테이스에 의해 가수분해될 수 있으며, 락테이스의 결핍은 젖당불내증을 초래한다.
몇 개(약 3~6개)의 단당류들이 결합하면, 올리고당("올리고(oligo-)"는 "소수(few)"를 의미)을 형성한다. 올리고당은 표지 및 세포 신호 뿐만 아니라 다른 용도로 사용될 수 있다.[37] 수 많은 단당류들이 중합되면 다당류를 형성한다. 단당류들은 긴 선형 사슬의 형태로 결합되거나, 분지(가지 구조)를 형성할 수도 있다. 일반적인 다당류로 셀룰로스, 녹말, 글리코젠이 있는데, 이들 세 가지 다당류들은 포도당 단위체들의 결합으로 구성되어 있다. 셀룰로스는 식물의 세포벽의 중요한 구조적 구성 성분이며, 녹말은 식물의 에너지 저장 형태로, 글리코젠은 동물의 에너지 저장 형태로 사용된다.
탄수화물은 환원 말단 또는 비환원 말단을 가질 수 있다. 탄수화물의 환원 말단은 선형의 알데하이드(알도스) 또는 케톤(케토스) 형태와 평형을 이룰 수 있는 탄소 원자이다. 이러한 환원 말단의 탄소 원자에서 단위체의 결합이 일어나는 경우, 피라노스 또는 푸라노스 형태의 자유 하이드록시기는 다른 당의 하이드록시기 측쇄와 교환되어, 완전한 아세탈을 생성한다. 이것은 알데하이드 또는 케톤의 형태로 사슬이 열리는 것을 방지하고, 수정된 잔기를 비환원성으로 만든다. 젖당에서 포도당 잔기는 환원 말단을 가지고 있고, 갈락토스 잔기는 포도당의 4번 탄소의 하이드록시기(-OH)와 완전한 아세탈을 형성한다. 수크로스는 포도당의 1번 탄소의 알데하이드와 과당의 2번 탄소의 케톤 사이에 완전한 아세탈의 형성으로 인해 환원 말단을 가지지 않는다.
지질[편집]
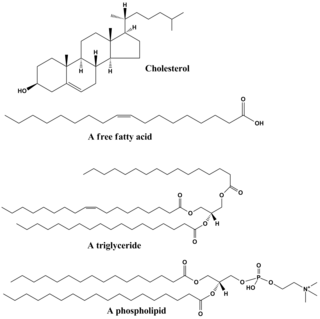
지질은 다양한 종류의 분자들을 포함하고 있으며, 왁스, 지방산, 인지질, 스핑고지질, 당지질 및 테르페노이드(예: 레티노이드와 스테로이드)를 포함한 생물로부터 기원한 비교적 물에 불용성이고, 비극성 화합물들을 포괄하는 화합물들이다. 일부 지질들은 선형의 지방족 화합물이며, 다른 지질들은 고리 구조를 가지고 있다. 일부 지질들은 방향족 화합물(고리형의 평명 구조를 가진)인 반면, 다른 지질들은 그렇지 않다. 어떤 지질들은 유연한 반면, 다른 지질들은 경직된 것도 있다.[40]
지질은 보통 글리세롤 1분자에 다른 분자들이 결합하여 만들어진다. 트라이글리세라이드는 1분자의 글리세롤과 3분자의 지방산의 결합으로 구성되어 있다. 이러한 경우에 지방산은 포화(탄소 사슬에 이중 결합이 없음)되거나 불포화(탄소 사슬에 하나 이상의 이중 결합이 있음)될 수 있다.[41]
대부분의 지질들은 전체적으로 비극성이지만, 일부분이 극성을 가질 수도 있다. 일반적으로 지질 구조의 대부분은 물과 같은 극성 용매와 상호 작용을 잘 하지 않는다는 것을 의미하는 비극성 또는 소수성이다. 지질 구조의 또 다른 부분은 극성 또는 친수성이며, 물과 같은 극성 용매와 상호작용을 잘하는 경형이 있다. 소수성 부분과 친수성 부분을 모두 가지고 있는 분자를 양친매성 분자라고 한다. 콜레스테롤의 경우 극성 부위는 하이드록시기(-OH)이다. 인지질의 경우 극성 부위는 인산을 포함하는 머리 부분이다.[42]
지질은 사람의 일상 식단의 필수적인 부분이다. 사람들이 주로 섭취하는 대부분의 기름들과 버터, 치즈, 기와 같은 유제품들은 지방으로 구성되어 있다. 식물성 기름은 다양한 다불포화 지방산이 풍부하다. 지방 함유 식품은 체내에서 소화 과정을 거치며, 지방의 최종 분해 산물인 지방산과 글리세롤로 분해된다. 또한 지질, 특히 인지질은 다양한 의약품에서 사용되는데, 공동가용화제(예: 비경구 투입) 또는 약물 운반체의 성분(예: 리포솜 또는 트랜스퍼솜)으로 사용된다.
단백질[편집]
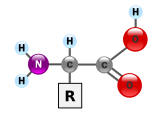
단백질은 아미노산이라고 불리는 단위체로 만들어진 매우 큰 고분자 중합체이다. 아미노산은 알파(α) 탄소라고 불리는 키랄 탄소에 아미노기(–NH2), 카복시기(–COOH), 수소 원자(–H), 곁사슬(R기, –R)이 결합되어 있는 화합물이다. 아미노기와 카복시기는 생리적인 조건 하에서는 –NH3+ 와 –COO− 로 존재한다. 곁사슬(R기)는 각각의 아미노산의 종류마다 다르며, R기의 특성은 단백질의 전체적인 3차원 구조에 큰 영향을 미친다. 어떤 아미노산은 그 자체로 또는 변형된 형태로 기능을 가지고 있다. 예를 들어, 글루탐산은 중요한 신경전달물질로 기능을 한다. 아미노산들은 펩타이드 결합을 통해 서로 결합될 수 있다. 이러한 탈수 반응으로 물 분자가 제거되고, 하나의 아미노산의 아미노기의 질소와 다른 하나의 아미노산의 카복실기의 탄소가 펩타이드 결합에 의해 연결된다. 두 개의 아미노산이 펩타이드 결합으로 연결된 분자를 다이펩타이드라고 하며, 짧은 길이의 아미노산(보통 30개 이하)이 연결된 분자를 펩타이드 또는 폴리펩타이드라고 한다. 단백질은 많은 수의 아미노산으로 구성되어 있다. 예를 들어, 중요한 혈장 단백질인 알부민은 585개의 아미노산 잔기들로 구성되어 있다.[43]


단백질은 구조적, 기능적 역할을 수행할 수 있다. 예를 들어, 단백질인 액틴과 마이오신의 움직임은 궁극적으로 골격근의 수축을 일으킨다. 많은 단백질들이 가지고 있는 특성들 중 하나는 특정 분자나 특정 분자들의 유형에 특이적으로 결합한다는 것이고, 이러한 결합은 매우 선택적일 수 있다. 항체는 특정 유형의 분자와 결합하는 단백질의 한 예이다. 항체는 중쇄와 경쇄로 구성된다. 2개의 중쇄는 아미노산들 사이의 다이설파이드 결합을 통해 2개의 경쇄와 연결된다. 항체는 N-말단 도메인의 차이에 기초한 변형을 통해 특이적이게 된다.[44]
실제로 항체를 사용하는 효소결합면역흡착검사(ELISA)은 현대 의학에서 다양한 생체분자를 검출하는데 사용하는 가장 민감한 검사 중 하나이다. 아마도 가장 중요한 단백질은 효소이다. 살아있는 세포의 거의 모든 반응에는 반응의 활성화 에너지를 낮추기 위한 효소가 필요하다. 효소는 기질이라고 불리는 특정 반응물 분자를 인식한 다음 반응을 촉매한다. 활성화 에너지를 낮춤으로써 효소는 반응 속도를 1011배 이상으로 증가시킨다. 자발적으로 반응이 완료되는데 3,000년이 걸릴 반응은 효소 반응으로 1초도 채 걸리지 않을 수 있다. 효소 자체는 반응에서 소모되지 않으며, 다음 반응에서 재사용된다. 다양한 작용기를 사용하여 효소의 활성을 조절하고, 세포 전체의 생화학적 조절을 가능하게 한다.
단백질의 구조는 전통적으로 4가지 단계의 계층 구조로 설명된다. 단백질의 1차 구조는 아미노산의 선형적인 배열 순서로 결정된다. 예를 들어, "알라닌-글리신-트립토판-세린-글루탐산-아스파라긴-글리신-리신-…"과 같은 배열 순서이다. 2차 구조는 국지적인 형태와 관련이 있다. 아미노산들의 일부 조합은 α-나선이라고 불리는 코일 형태 또는 β-시트라고 불리는 시트 형태를 형성한다. 위의 헤모글로빈을 나타낸 그림에서도 일부 α-나선들을 볼 수 있다. 3차 구조는 단백질의 전체적인 3차원 입체 구조 형태이다. 이러한 단백질의 3차 구조는 아미노산의 배열 순서에 의해 결정된다. 실제로 아미노산 1개가 바뀌어도 전체 구조를 변화시킬 수 있다. 헤모글로빈의 β 소단위체는 146개의 아미노산 잔기로 구성되어 있다. 헤모글로빈의 β 소단위체의 6번째 아미노산인 글루탐산 잔기가 발린 잔기로 치환되면 헤모글로빈의 입체 구조가 바뀌어 낫 모양 적혈구 빈혈증을 일으킬 수 있다. 마지막으로 4차 구조는 4개의 소단위체를 가지고 있는 헤모글로빈과 같이 여러 개의 폴리펩타이드 소단위체를 가지고 있는 단백질의 구조와 관련이 있다. 모든 단백질이 두 개 이상의 소단위체로 구성되어 있는 것은 아니다.[45]

섭취된 단백질은 일반적으로 소장에서 단일 아미노산으로 분해되어 흡수된다. 그리고 나서 아미노산들은 새로운 단백질을 만들기 위해 결합될 수 있다. 해당과정, 시트르산 회로, 오탄당 인산 경로의 중간생성물들은 단백질을 구성하는 20가지 아미노산들을 만드는데 사용될 수 있으며, 대부분의 세균과 식물은 아미노산 합성에 필요한 모든 효소들을 가지고 있다. 그러나 사람 및 다른 포유류들은 단백질 합성에 사용되는 20가지 아미노산들 중 절반 정도만 합성할 수 있다. 이들은 아이소류신, 류신, 리신, 메싸이오닌, 페닐알라닌, 트레오닌, 트립토판, 발린을 합성할 수 없다. 이들은 필수 아미노산이기 때문에 섭취하는 것이 필수적이다. 포유류는 알라닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 프롤린, 세린, 티로신과 같은 비필수 아미노산들은 합성하는 효소들을 합성하는 효소들을 가지고 있다. 포유류는 아르지닌과 히스티딘을 합성할 수 있지만, 어리고 생장 중인 동물은 충분한 양을 생산할 수 없기 때문에, 아르지닌과 히스티딘은 종종 필수 아미노산으로 간주된다.
아미노산에서 아미노기가 제거되면, α-케토산이라고 불리는 탄소 골격이 남는다. 아미노기 전이효소는 아미노산의 아미노기를 다른 α-케토산으로 전달할 수 있다. 이것은 아미노산의 생합성에서 중요한데, 많은 생화학적 경로의 중간생성물들이 α-케토산 골격으로 전환된 다음, 아미노기 전이반응을 통해 아미노기가 추가되기 때문이다. 그리고 나서 아미노산들은 서로 결합하여 단백질을 생성할 수 있다.[46]
비슷한 과정이 단백질 분해에 사용된다. 단백질은 먼저 구성 성분인 아미노산으로 가수분해된다. 혈액 중에 암모늄 이온(NH4+)으로 존재하는 유리 암모니아(NH3)는 생명체에 독성을 나타낸다. 따라서 질소 노폐물을 배설하기 위한 적절한 방법이 존재해야 한다. 동물들의 필요에 따라 각기 다른 배설 방법들이 진화해 왔다. 단세포 생물은 간단하게 암모니아를 환경으로 방출한다. 마찬가지로 경골어류는 암모니아를 물 속으로 방출한다. 일반적으로 포유류는 요소 회로를 통해 암모니아를 요소로 전환시킨 다음, 요소를 배설한다.[47]
서로 다른 두 단백질이 관련이 있는지, 즉 그들이 동종인지 여부를 결정하기 위해 과학자들은 서열 비교 방법을 사용한다. 서열 정렬 및 구조 정렬과 같은 방법은 과학자들이 관련 분자들 사이의 상동성을 식별하는데 도움을 주는 강력한 도구들이다.[48] 단백질 간의 상동성을 발견하고, 관련성을 파악하는 것은 단백질족의 진화적인 패턴을 밝혀내는데 도움을 줄 수 있다. 두 단백질 서열이 얼마나 비슷한지를 발견함으로써, 단백질의 구조와 그에 따른 기능에 대한 지식을 얻을 수 있다.
핵산[편집]

핵산은 세포핵에서 주로 발견되는 생명활동에 필수적인 생체고분자이다. 핵산은 모든 살아있는 세포와 바이러스에서 유전 정보를 전달할 수 있는 복잡한 고분자량의 생화학적 거대 분자이다.[2] 핵산은 뉴클레오타이드를 단위체로 하는 중합체이다. 뉴클레오타이드는 핵염기(퓨린 계열 염기 또는 피리미딘 계열 염기), 5탄당, 인산의 세 가지 성분으로 구성된다.[49]
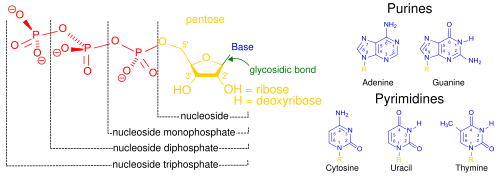
가장 일반적인 핵산은 디옥시리보핵산(DNA)과 리보핵산(RNA)이다.[50] 각 뉴클레오타이드의 당과 인산은 서로 결합하여 핵산의 골격을 형성하고, 핵염기의 서열은 정보를 저장한다. 가장 일반적인 핵염기는 아데닌, 사이토신, 구아닌, 티민, 유라실이다. 핵산의 각 가닥의 핵염기들 사이에서 상보적인 염기쌍이 형성된다. 아데닌은 티민, 유라실과 수소 결합을 형성하고, 구아닌은 사이토신과 수소 결합을 형성한다.
세포의 유전 물질을 형성하는 것 외에도, 뉴클레오타이드는 모든 생명체에서 발견되는 주요 에너지 운반 분자인 아데노신 삼인산(ATP)을 형성할 뿐만 아니라 2차 전달자 역할을 한다.[51] DNA와 RNA에서 발견되는 핵염기는 서로 다른데, 아데닌, 사이토신, 구아닌은 DNA와 RNA에서 모두 발견되는 반면, 티민은 DNA에서만 발견되고, 유라실은 RNA에서만 발견된다.
물질대사[편집]
에너지원으로서의 탄수화물[편집]
포도당은 대부분의 생명체에서 에너지원으로 사용된다. 예를 들어, 다당류는 효소에 의해 단량체로 분해된다. 글리코젠 포스포릴레이스는 다당류인 글리코젠으로부터 포도당 잔기를 분해한다. 젖당이나 수크로스(설탕)과 같은 이당류는 두 개의 단당류로 분해된다.
해당과정[편집]
포도당은 해당과정이라고 불리는 10단계 과정으로 대사되며, 그 결과로 포도당 1분자가 피루브산 2분자로 분해된다. 해당과정은 또한 2분자의 NAD+(니코틴아마이드 아데닌 다이뉴클레오타이드의 산화형)을 2분자의 NADH(니코틴아마이드 아데닌 다이뉴클레오타이드의 환원형)으로 전환시키고, 세포의 에너지 화폐인 ATP 2분자를 순생성한다. 해당과정은 산소를 필요로 하지 않는다. 세포가 산소를 사용할 수 없는 경우, 피루브산을 젖산(예: 사람에서)으로 전환시키거나, 피루브산을 이산화 탄소와 에탄올(예: 효모)로 전환시키는 과정에서 NADH를 NAD+로 산화시켜서 NAD+를 해당과정에 공급한다. 갈락토스 및 과당과 같은 다른 단당류들은 해당과정의 중간생성물로 전환될 수 있다.[52]
시트르산 회로와 산화적 인산화[편집]
대부분의 사람 세포에서와 같이 충분한 산소를 공급받는 세포에서 피루브산은 더 대사될 수 있다. 피루브산은 아세틸-CoA로 비가역적으로 전환되고, 이 과정에서 이산화 탄소가 방출되고, NAD+가 NADH로 환원된다. 1분자의 포도당으로부터 생성된 2분자의 아세틸-CoA는 시트르산 회로로 들어가서 4CO2로 완전 분해되고, 이 과정에서 6NADH, 2FADH2, 2ATP를 생성한다. 생성된 NADH와 FADH2는 전자전달계로 전달되는데, 전자전달계는 궁극적으로 전자를 산소(O2)로 전달하고, 이 과정에서 방출되는 에너지로 막(진핵세포의 경우 미토콘드리아 내막)을 경계로 한 H+(양성자)의 농도 기울기를 형성한다. 따라서 산소(O2)는 물(H2O)로 환원되고, 원래의 전자수용체인 NAD+와 FAD는 재생된다. 이것이 사람이 산소(O2)를 들이마시고, 이산화 탄소(CO2)를 내뿜는 이유이다. NADH와 FADH2의 고에너지 전자는 전자전달계를 전달되고, 이 과정에서 방출되는 에너지는 막을 경계로 한 H+(양성자)의 농도 기울기로 보존된 다음, ATP 생성효소를 통해 ATP로 전환된다. 포도당 1분자가 세포 호흡에 사용되면, 해당과정에서 기질수준 인산화로 2ATP, 시트르산 회로에서 기질수준 인산화로 2ATP, 산화적 인산화에서 28ATP(NADH당 2.5ATP, FADH2당 1.5ATP)가 합성되므로, 총 32ATP가 생성된다.[53] 포도당을 완전히 산화시키기 위해 산소를 사용하는 것은 산소를 사용하지 않는 어떤 대사 과정보다 훨씬 많은 에너지를 생물체에 제공한다는 것은 분명하며, 이것이 지구의 대기에 많은 양의 산소가 축적되고 나서야 복잡한 생명체가 출현하게 된 이유라고 생각된다.
포도당신생합성[편집]
척추동물에서 격렬하게 수축하는 골격근(예를 들어, 역도 또는 단거리 달리기를 하는 동안)은 에너지 요구량을 충족시킬 만큼 충분한 산소를 공급받지 못하기 때문에 혐기성 대사 과정으로 전환되어 피루브산을 젖산으로 전환시킨다. 간은 포도당신생합성이라는 과정을 사용하여 포도당을 재생성한다. 포도당신생합성은 해당과정과 반대되는 과정이 아니며, 실제로 해당과정에서 얻은 에너지양의 3배를 필요로 한다(해당과정에서 얻은 2ATP와 비교하여 포도당신생합성은 6ATP를 필요로 함). 위와 같은 반응으로 생성된 포도당은 에너지가 필요한 조직에서 해당과정으로 들어가거나, 글리코젠(식물에서는 녹말)으로 저장되거나, 다른 단당류로 전환되거나, 이당류 또는 올리고당류로 결합될 수 있다. 운동 중의 근육세포의 해당과정, 근육세포의 피루브산이 젖산으로 전환된 다음 혈액으로 방출되고, 간세포에서 젖산이 피루브산으로 전환된 다음 포도당신생합성을 통해 포도당을 합성하고 포도당을 혈액으로 방출하는 순환을 코리 회로라고 한다.[54]
다른 분자 규모의 생물학과의 관계[편집]

생화학 연구자들은 생화학 고유의 특정 기술들을 사용하지만, 유전학, 분자생물학, 생물리학 분야에서 개발된 기술, 아이디어를 점점 더 결합시켜 사용하고 있다. 이들 분야 중에서 내용과 기술의 측면에서 강경한 적은 없었다. 오늘날 분자생물학과 생화학이라는 용어는 서로 교환이 가능하다. 다음의 그림은 각 분야들의 관계를 보여주고 있다.
- 생화학은 살아있는 생물체 내의 화학 물질과 생물체에서 일어나는 중요한 과정들에 대해 연구하는 학문이다. 생화학자들은 생체분자의 역할, 기능, 구조에 초점을 크게 둔다. 생물학적 과정 뒤에 있는 화학과 생물학적 활성 분자의 합성에 대한 연구는 생화학의 한 예이다.
- 유전학은 유전적 차이가 생명체에 미치는 영향에 대해 연구하는 학문이다. 흔히 이러한 연구는 정상적인 성분(예: 하나의 유전자)의 부재에 의해 추론해 볼 수 있다. 소위 "야생형" 또는 정상 표현형인 생명체와는 다른 변화된 유전자를 가진 개체는 돌연변이체로 유전학의 연구 대상이다. 유전적 상호작용(상위성)은 종종 이러한 "녹아웃(knock-out)" 또는 "녹인(knock-in)" 연구에 대한 간단한 해석을 혼란스럽게 만들 수 있다.
- 분자생물학은 유전 물질의 복제, 전사, 번역 과정의 분자적 토대에 대해 연구하는 학문이다. 분자생물학에 대한 단순한 설명임에도 불구하고 유전 물질이 RNA로 전사된 다음 단백질로 번역된다는 분자생물학의 중심원리는 여전히 분자생물학을 이해하기 위한 좋은 출발점을 제공한다. 그러나 분자생물학의 중심원리에 대한 그림은 RNA의 새로운 역할을 반영하여 수정되고 있다.[55]
- 화학생물학은 생물학적 시스템의 동요를 최소화하면서 기능에 대한 상세한 정보를 제공하는 저분자 기반의 새로운 도구를 개발하고자 한다. 또한, 화학생물학은 생체분자와 합성 장치(예: 유전자 치료 또는 약물 분자를 전달할 수 있는 비어있는 바이러스의 캡시드) 사이의 비자연적 혼성체를 생성하는 생물 시스템을 사용한다.[56]
같이 보기[편집]
주해[편집]
a. ^ 과당은 과일에서 발견되는 유일한 당은 아니다. 포도당과 수크로스는 다양한 과일에서 다양한 양으로 발견되며, 때때로 과당보다 많이 존재한다. 예를 들어, 대추의 식용 부분의 32%는 포도당인데 비해, 과당은 24%, 수크로스는 8%이다. 그러나 복숭아는 과당(0.93%)이나 포도당(1.47%)보다 수크로스(6.66%)가 더 많다.[57]
각주[편집]
- ↑ “Biochemistry”. 《acs.org》.
- ↑ 가 나 Voet (2005), p. 3.
- ↑ Karp (2009), p. 2.
- ↑ Miller (2012). p. 62.
- ↑ Astbury (1961), p. 1124.
- ↑ Eldra (2007), p. 45.
- ↑ Marks (2012), Chapter 14.
- ↑ Finkel (2009), pp. 1–4.
- ↑ UNICEF (2010), pp. 61, 75.
- ↑ 가 나 Helvoort (2000), p. 81.
- ↑ Hunter (2000), p. 75.
- ↑ Hamblin (2005), p. 26.
- ↑ Hunter (2000), pp. 96–98.
- ↑ Berg (1980), pp. 1–2.
- ↑ Holmes (1987), p. xv.
- ↑ Feldman (2001), p. 206.
- ↑ Rayner-Canham (2005), p. 136.
- ↑ Ziesak (1999), p. 169.
- ↑ Kleinkauf (1988), p. 116.
- ↑ Ben-Menahem (2009), p. 2982.
- ↑ Amsler (1986), p. 55.
- ↑ Horton (2013), p. 36.
- ↑ Kleinkauf (1988), p. 43.
- ↑ Edwards (1992), pp. 1161–1173.
- ↑ Fiske (1890), pp. 419–20.
- ↑ Kauffman (2001), pp. 121–133.
- ↑ Ashcroft(2006)
- ↑ Tropp (2012), p. 2.
- ↑ Tropp (2012), pp. 19–20.
- ↑ Krebs (2012), p. 32.
- ↑ Butler (2009), p. 5.
- ↑ Chandan (2007), pp. 193–194.
- ↑ Nielsen (1999), pp. 283–303.
- ↑ Slabaugh (2007), pp. 3–6.
- ↑ Whiting (1970), pp. 1–31.
- ↑ Voet (2005), pp. 358–359.
- ↑ Varki (1999), p. 17.
- ↑ Stryer (2007), p. 328.
- ↑ Voet (2005), Ch. 12 Lipids and Membranes.
- ↑ Fromm and Hargrove (2012), pp. 22–27.
- ↑ Voet (2005), pp. 382–385.
- ↑ Voet (2005), pp. 385–389.
- ↑ Metzler (2001), p. 58.
- ↑ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). “How antibodies fold”. 《Trends in Biochemical Sciences》 35 (4): 189–198. doi:10.1016/j.tibs.2009.11.005. PMC 4716677. PMID 20022755.
- ↑ Fromm and Hargrove (2012), pp. 35–51.
- ↑ Fromm and Hargrove (2012), pp. 279–292.
- ↑ Sherwood (2012), p. 558.
- ↑ Fariselli (2007), pp. 78–87.
- ↑ Saenger (1984), p. 84.
- ↑ Tropp (2012), pp. 5–9.
- ↑ Knowles (1980), pp. 877–919.
- ↑ Fromm and Hargrove (2012), pp. 163–180.
- ↑ Voet (2005), Ch. 17 Glycolysis.
- ↑ Fromm and Hargrove (2012), pp. 183–194.
- ↑ Ulveling (2011), pp. 633–644.
- ↑ Rojas-Ruiz (2011), pp. 2672–2687.
- ↑ Whiting, G.C. (1970), p. 5.
인용 문헌[편집]
- Amsler, Mark (1986). 《The Languages of Creativity: Models, Problem-solving, Discourse》. University of Delaware Press. ISBN 978-0-87413-280-9.
- Astbury, W.T. (1961). “Molecular Biology or Ultrastructural Biology ?”. 《Nature》 190 (4781): 1124. Bibcode:1961Natur.190.1124A. doi:10.1038/1901124a0.
- Ben-Menahem, Ari (2009). 《Historical Encyclopedia of Natural and Mathematical Sciences》. 《Historical Encyclopedia of Natural and Mathematical Sciences by Ari Ben-Menahem. Berlin: Springer》 (Springer). 2982쪽. Bibcode:2009henm.book.....B. ISBN 978-3-540-68831-0.
- Burton, Feldman (2001). 《The Nobel Prize: A History of Genius, Controversy, and Prestige》. Arcade Publishing. ISBN 978-1-55970-592-9.
- Butler, John M. (2009). 《Fundamentals of Forensic DNA Typing》. Academic Press. ISBN 978-0-08-096176-7.
- Sen, Chandan K.; Roy, Sashwati (2007). “MiRNA: Licensed to Kill the Messenger”. 《DNA and Cell Biology》 26 (4): 193–194. doi:10.1089/dna.2006.0567. PMID 17465885.
- Clarence, Peter Berg (1980). 《The University of Iowa and Biochemistry from Their Beginnings》. ISBN 978-0-87414-014-9.
- Edwards, Karen J.; Brown, David G.; Spink, Neil; Skelly, Jane V.; Neidle, Stephen (1992). “Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2 an examination of propeller twist and minor-groove water structure at 2·2Åresolution”. 《Journal of Molecular Biology》 226 (4): 1161–1173. doi:10.1016/0022-2836(92)91059-x.
- Eldra P. Solomon; Linda R. Berg; Diana W. Martin (2007). 《Biology, 8th Edition, International Student Edition》. Thomson Brooks/Cole. ISBN 978-0-495-31714-2. 2016년 3월 4일에 원본 문서에서 보존된 문서.
- Fariselli, P.; Rossi, I.; Capriotti, E.; Casadio, R. (2006). “The WWWH of remote homolog detection: The state of the art”. 《Briefings in Bioinformatics》 8 (2): 78–87. doi:10.1093/bib/bbl032. PMID 17003074.

- Fiske, John (1890). 《Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1》. Boston and New York: Houghton, Mifflin. 2015년 2월 16일에 확인함.
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). 《Lippincott's Illustrated Reviews: Pharmacology》 4판. Lippincott Williams & Wilkins. ISBN 978-0-7817-7155-9.
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). 《Essential Genes》. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Fromm, Herbert J.; Hargrove, Mark (2012). 《Essentials of Biochemistry》. Springer. ISBN 978-3-642-19623-2.
- Hamblin, Jacob Darwin (2005). 《Science in the Early Twentieth Century: An Encyclopedia》. ABC-CLIO. ISBN 978-1-85109-665-7.
- Helvoort, Ton van (2000). Arne Hessenbruch, 편집. 《Reader's Guide to the History of Science》. Fitzroy Dearborn Publishing. ISBN 978-1-884964-29-9.
- Holmes, Frederic Lawrence (1987). 《Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity》. University of Wisconsin Press. ISBN 978-0-299-09984-8.
- Horton, Derek, 편집. (2013). 《Advances in Carbohydrate Chemistry and Biochemistry, Volume 70》. Academic Press. ISBN 978-0-12-408112-3.
- Hunter, Graeme K. (2000). 《Vital Forces: The Discovery of the Molecular Basis of Life》. Academic Press. ISBN 978-0-12-361811-5.
- Karp, Gerald (2009). 《Cell and Molecular Biology: Concepts and Experiments》. John Wiley & Sons. ISBN 978-0-470-48337-4.
- Kauffman, George B.; Chooljian, Steven H. (2001). “Friedrich Wöhler (1800–1882), on the Bicentennial of His Birth”. 《The Chemical Educator》 6 (2): 121–133. doi:10.1007/s00897010444a.
- Kleinkauf, Horst; Döhren, Hans von; Jaenicke Lothar (1988). 《The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences》. Walter de Gruyter & Co. 116쪽. ISBN 978-3-11-085245-5.
- Knowles, J.R. (1980). “Enzyme-Catalyzed Phosphoryl Transfer Reactions”. 《Annual Review of Biochemistry》 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- Metzler, David Everett; Metzler, Carol M. (2001). 《Biochemistry: The Chemical Reactions of Living Cells》 1. Academic Press. ISBN 978-0-12-492540-3.
- Miller G; Spoolman Scott (2012). 《Environmental Science – Biodiversity Is a Crucial Part of the Earth's Natural Capital》. Cengage Learning. ISBN 978-1-133-70787-5. 2016년 1월 4일에 확인함.
- Nielsen, Forrest H. (1999). Maurice E. Shils; 외., 편집. 《Ultratrace minerals; Modern nutrition in health and disease》. Baltimore: Williams & Wilkins. 283–303쪽. hdl:10113/46493.
- Peet, Alisa (2012). Marks, Allan; Lieberman Michael A., 편집. 《Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry)》 4판. ISBN 978-1-60831-572-7.
- Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (2005). 《Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century》. Chemical Heritage Foundation. ISBN 978-0-941901-27-7.
- Rojas-Ruiz, Fernando A.; Vargas-Méndez, Leonor Y.; Kouznetsov, Vladimir V. (2011). “Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences”. 《Molecules》 16 (3): 2672–2687. doi:10.3390/molecules16032672. PMC 6259834. PMID 21441869.
- Saenger, Wolfram (1984). 《Principles of Nucleic Acid Structure》. New York: Springer-Verlag. ISBN 978-0-387-90762-8.
- Slabaugh, Michael R.; Seager, Spencer L. (2013). 《Organic and Biochemistry for Today》 6판. Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0.
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). 《Animal Physiology: From Genes to Organisms》. Cengage Learning. ISBN 978-0-8400-6865-1.
- Stryer L, Berg JM, Tymoczko JL (2007). 《Biochemistry》 6판. San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (2012). 《Molecular Biology》 4판. Jones & Bartlett Learning. ISBN 978-1-4496-0091-4.
- UNICEF (2010). 《Facts for life》 (PDF) 4판. New York: United Nations Children's Fund. ISBN 978-92-806-4466-1. 2018년 12월 12일에 원본 문서 (PDF)에서 보존된 문서. 2019년 5월 14일에 확인함.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). “When one is better than two: RNA with dual functions”. 《Biochimie》 93 (4): 633–644. doi:10.1016/j.biochi.2010.11.004. PMID 21111023.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). 《Essentials of glycobiology》. Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6.
- Voet, D; Voet, JG (2005). 《Biochemistry》 3판. Hoboken, NJ: John Wiley & Sons Inc. ISBN 978-0-471-19350-0. September 11, 2007에 원본 문서에서 보존된 문서.
- Whiting, G.C (1970). 〈Sugars〉. A.C. Hulme. 《The Biochemistry of Fruits and their Products》. Volume 1. London & New York: Academic Press. ISBN 978-0-12-361201-4.
- Ziesak, Anne-Katrin; Cram Hans-Robert (1999). 《Walter de Gruyter Publishers, 1749–1999》. Walter de Gruyter & Co. ISBN 978-3-11-016741-2.
- Ashcroft, Steve. “Professor Sir Philip Randle; Researcher into metabolism: [1st Edition]”. Independent. (12/02/2006)에 확인함.
더 읽을거리[편집]
- Fruton, Joseph S. Proteins, Enzymes, Genes: The Interplay of Chemistry and Biology. Yale University Press: New Haven, 1999. ISBN 0-300-07608-8
- Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis and Alexander Johnson, Molecular Biology of the Cell
- 4th Edition, Routledge, March, 2002, hardcover, 1616 pp. ISBN 0-8153-3218-1
- 3rd Edition, Garland, 1994, ISBN 0-8153-1620-8
- 2nd Edition, Garland, 1989, ISBN 0-8240-3695-6
- Kohler, Robert. From Medical Chemistry to Biochemistry: The Making of a Biomedical Discipline. Cambridge University Press, 1982.
- Maggio, Lauren A.; Willinsky, John M.; Steinberg, Ryan M.; Mietchen, Daniel; Wass, Joseph L.; Dong, Ting (2017). “Wikipedia as a gateway to biomedical research: The relative distribution and use of citations in the English Wikipedia”. 《PLOS ONE》 12 (12): e0190046. Bibcode:2017PLoSO..1290046M. doi:10.1371/journal.pone.0190046. PMC 5739466. PMID 29267345.
외부 링크[편집]
- “Biochemical Society”.
- The Virtual Library of Biochemistry, Molecular Biology and Cell Biology Archived 2019년 5월 14일 - 웨이백 머신
- Biochemistry, 5th ed. Full text of Berg, Tymoczko, and Stryer, courtesy of NCBI.
- SystemsX.ch – The Swiss Initiative in Systems Biology
- Full text of Biochemistry by Kevin and Indira, an introductory biochemistry textbook.
Poirot, Marc; Soules, Regis; Mallinger, Arnaud; Dalenc, Florence; Silvente-Poirot, Sandrine. Biochimie. Oct2018, Vol. 153, pp. 139–149 Afify, Heba M. American Journal of Biomedical Sciences. 2016, Vol. 8 Issue 3, pp. 200–207