탄소
 탄소의 동소체, 흑연(좌)과 다이아몬드(우) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 라틴어명 | Carbonium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 한자명 | 炭素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | [12.0096, 12.0116] 12.011 (보편) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 14족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 2주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | p-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 반응성 비금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 준위별 전자 수 | 2, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 검은색(흑연) 무색(다이아몬드) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | (다이아몬드) 3823.15 K (흑연) 3948.15 K (비결정) 3948.15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | (승화) (흑연) 4300 K (다이아몬드) 5100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | (흑연) 2.267 g·cm−3 (다이아몬드) 3.513 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 삼중점 | 4600 K, 10,800 kPa[1][2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | (흑연) 117 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | (흑연) 8.517 J/(mol·K) (25 °C) (다이아몬드) 6.115 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 4, 2 (약한 산성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 2.55 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 70 pm (실험값) 67 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 77 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 (흑연) | 육방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 (다이아몬드) | 다이아몬드 입방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | (흑연) (119-165) W/(m·K) (다이아몬드) (900-2320) W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | 반자성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | (흑연) 0.5 (다이아몬드) 10.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-44-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
탄소(炭素, 영어: Carbon 카번[*])는 비금속인 화학 원소로, 기호는 C(←라틴어: Carbonium 카르보니움[*])이고 원자번호는 6이다. 원자가 전자는 4개이다. 존재하는 동위 원소는 총 3개로, 12C와 13C는 안정적인 동위 원소지만 14C는 반감기가 약 5730년인 방사성 동위 원소이다.[3] 탄소는 오래 전에 존재가 밝혀진 원소들 중 하나이다.[4]
탄소는 지각을 구성하는 원소들 중에 15번째로 풍부하며, 우주에서 수소, 헬륨, 산소 다음인 4번째로 풍부한 원소이다. 이렇게 탄소는 풍부하며, 탄소 화합물로서 다양한 유기 화합물을 구성할 수도 있고, 상온 상태에서 중합체를 형성할 수도 있기 때문에 우리 삶은 탄소와 밀접한 관련이 있다. 예로서 탄소는 우리 몸에서 산소 다음인 두 번째로 풍부한 원소(18.5%)이다.[5]
탄소는 다양한 동소체를 가지고 있으며, 흑연, 다이아몬드, 비정질 탄소 등이 있다.[6] 탄소 동소체들은 물리적 성질에서 많은 차이를 보인다. 흑연은 불투명한 검은색이지만 다이아몬드는 매우 투명하다. 흑연은 종이에다 글씨를 적을 수 있을 정도로 연하지만 다이아몬드는 천연물 중에서는 가장 단단한 물질이다. 흑연은 좋은 전기 전도체이지만 다이아몬드는 전기 전도도가 낮다. 일반적으로 다이아몬드, 탄소 나노 튜브, 흑연은 지금까지 알려진 모든 물질 중에서 열전도율이 가장 높다. 모든 탄소 동소체들은 상온에서 고체이며, 흑연은 열역학으로 가장 안정한 구조이다. 또한 반응성이 큰 산소와 반응할 때도 높은 온도가 필요할 정도로 화학적으로 쉽게 반응하지 않는다.
무기화합물에서 탄소의 산화수는 일반적으로 +4이다. 다만 예외적으로 일산화 탄소와 전이금속 카보닐 복합체에서는 +2이다. 무기 탄소화합물은 대부분 석회암, 백운암, 이산화 탄소이지만, 석탄, 이탄, 석유, 메테인 하이드레이트 같은 유기적 침전물에도 상당히 많이 존재한다. 탄소는 다른 원소와 비교해서 수많은 화합물을 결합한다. 표준 조건 하에서 이론적으로 가능한 화합물은 지금까지 밝혀진 것만 약 1천만 개 정도이다.[7] 그래서 탄소는 종종 '원소의 제왕'이라고 불렸다.[8]
생성[편집]
원시 탄소[편집]
탄소의 일부는 대폭발 핵합성 과정에서 생성되었다. 대폭발 핵합성 과정은 흔히 리튬보다 무거우면서 안정한 원소를 생성할 여지가 없다고 알려져 있다. 2007년 이탈리아의 천체 물리학자 파비오 이오코의 계산에 따르면, 대폭발 핵합성 과정에는 100개 이상 가능한 핵반응 경로들이 포함되었다. 탄소, 질소, 산소가 이 시기에 만들어질 수는 있었던 것이다. 단, 450경 개의 수소 원자핵마다 1개의 탄소-12 원자핵이 나타나 우주의 후속 진화에 영향을 미치기에 너무 적었을 뿐이다. 이오코는 초기 별들이 '금속이 없는 환경'에서 진화했다고 결론을 내렸다. 그러나 대폭발 핵합성 과정에 우주에는 최소 1080개의 수소 원자가 생성되어 있었다. 이 숫자는 워낙 크기 때문에 수소 원자 450경 개마다 1개씩 탄소가 생성되더라도 1064개 이상의 원시 탄소 원자가 이 과정에서 만들어졌다. 그 총량은 우주 질량의 아주 작은 부분에 불과하고, 오늘날 우주에서 발견되는 총 탄소 원자의 1조분의 1에 미치지 못하지만, 대폭발 직후에 생성된 원시 탄소 원자는 지금도 우주 전체에 우주 먼지와 가스로 흩어져 있다.[9]
항성 탄소[편집]
현재 우주에 존재하는 탄소 원자 대부분은 별 깊숙한 곳에서 만들어졌다. 대부분 수소로 이루어진 별은 안쪽 깊숙한 곳의 엄청난 온도와 압력으로 인해 '수소 연소'라 불리는 핵융합 반응을 거쳐 헬륨을 생성한다. 별의 핵 주변 수소 대부분이 융합하여 헬륨이 되면, '헬륨 연소' 반응이 시작되고, 그 와중에 베릴륨에 이어서 탄소가 만들어진다. 이 과정을 밝혀낸 사람은 영국 천문학자 프레드 호일이다.[10]
오래된 별의 중심에서 헬륨-4(알파입자)가 농축되고, 충돌하는 두 알파입자는 쉽게 융합해 4개의 양성자와 4개의 중성자를 포함하는 베릴륨-8을 형성한다. 베릴륨-8에 알파입자 하나를 추가하면 탄소-12가 된다. 그러나 베릴륨-8은 극도로 불안정해 1000조 분의 1초도 안 되는 찰나에 더 작은 조각으로 분해된다. 따라서 본래 탄소-12는 자연상태에서 존재하기 어렵다. 하지만 여러 과학자들의 측정에 따르면 우주에서 탄소는 4번째로 풍부한 원소이다. 이러한 모순은 자연의 우연이 해결하는데, 탄소-12의 핵은 7.68메가볼트의 에너지량에 공명하는 특성이 있기에 베릴륨-8이 붕괴하는 것보다 훨씬 빨리 알파입자를 낚아챌 수 있다. 호일은 적당한 조건 아래에서 삼중 알파 과정이 일어나 탄소-12 생성 속도가 약 10억 배 증가할 수 있다고 추정했다. 이런 조건을 호일 상태라 하는데, 나중에 호일 상태의 존재가 실제로 확인되면서 호일은 천제 물리학의 총아로 떠올랐다.[11]
요약하면, 항성 내부의 상상할 수 없는 열과 압력의 영향을 받아 수소는 헬륨으로, 세 개의 헬륨 핵은 탄소로 융합된다. 느린 과정이지만, 우주의 탄소 농도는 점차 증가해 궁극적으로 수소 원자 1000개당 거의 5개의 비율로, 탄소 원자는 우주에서 네 번째로 풍부한 원소가 되었다.</ref>
우주 탄화[편집]
우주 역사의 첫 수백만 년 동안, 항성 탄소 대부분은 별 내부에 잠겨 있었다. 탄소 핵 일부는 핵연료가 되었고, 헬륨과 융합하여 산소, 규소, 철 같은 더 무거운 원소들로 변화했다. 수백만 년 동안 격렬한 항성 대류 현상이 일어나자 탄소는 점차 항성 표면으로 모습을 드러냈다. 곧이어 자기장과의 격렬한 상호작용으로 인해 외부로 밀려난 강력한 항성풍을 타고 탄소 원자는 별을 탈출했다. 우주 탄화 과정의 시작이다. 그러나 우주 탄화는 대부분 초신성 같은 거대한 별이 죽을 때 일어난다. 별의 죽음과 함께 내부에 있던 엄청난 양의 물질이 우주로 방출되기 때문이다.[12]
태양 정도의 중간 크기 별에서 별은 마지막에 백색왜성으로 붕괴하면서 핵반응이 끝나고 탄소로 가득한 별이 된다. 백색왜성은 하늘에 박힌 다이아몬드로 탄소 알갱이 대부분이 영원히 그 별에 갇혀 있다. 태양보다 큰 별이 죽을 때는 충분히 높은 내부 압력과 온도가 탄소-12를 알파입자와 융합하여 더 무거운 원소(산소-16, 네온-20, 마그네슘-24 등)으로 변화시킨다. 이러한 변화는 별에 에너지를 더해 주고, 새로운 원소를 만들며, 별을 팽창시키는 핵반응을 일으키고, 핵반응의 최종 산물인 철-56을 생성할 때까지 몇 초 동안 격렬하게 이어진다. 별의 중심이 철로 바뀌면 중력의 힘이 우세해지면서 별의 모든 질량이 거의 빛의 속도로 안으로 당겨지면서 온도와 압력이 엄청나게 치솟아, 결국 중력 붕괴 현상이 일어난다. 초신성 폭발이다. 주기율표 원자의 절반 이상이 이 과정에서 만들어지고, 별의 분해와 함께 온 우주로 퍼져나간다. 현재 우주에 있는 탄소 대부분은 이렇게 만들어졌다.[13]
역사[편집]
탄소는 유사 이전부터 숯의 형태로 사용되어 왔으며, “carbon”이라는 이름은 숯을 뜻하는 라틴어 carbo에서 왔다. 이 이름은 라부아지에가 명명하였다. 한자어 탄소(炭素)는 독일어 Kohlenstoff에서 유래하였다.
주요 화합물[편집]
CO2(이산화탄소), CO(일산화탄소), CH4(메테인), C6H12O6(포도당), C2H6(에테인), 탄화수소 등과 같은 상당수의 유기물이 탄소 화합물에 해당한다. 그러나 오늘날에는 탄소가 있다고 해서 무조건 유기물이 될 수 있는 것은 아니다. 이것은 일산화탄소는 무기물에 해당되기 때문이다. 따라서 오늘날에는 홑원소물질인 탄소, 산화탄소, 금속의 탄산염, 시안화물·탄화물 등을 제외한 탄소화합물을 총칭한 분자를 유기물로 본다.
특성[편집]

탄소 동소체에는 부드러운 흑연과 가장 단단한 자연물인 다이아몬드가 있다. 탄소 원자는 같은 탄소 원자는 물론 다른 원자와 쉽게 화학 결합을 하며, 적합한 다가 원자와 안정된 다양한 공유 결합을 이룰 수 있다. 지금까지 발견된 화합물 대부분이 약 1천만 개로 추정되는 탄소 화합물이다.[7] 탄소는 가장 높은 승화점을 가지고 있는 원소이다. 삼중점은 10.8 ± 0.2 MPa에 4,600 ± 300 K (~4,330 °C or 7,820 °F)으로 대기압에서 녹는점이 없고,[1][2] 3,900 K의 승화점을 가진다.[14][15] 흑연은 열역학적으로 안정하지만 충격에 취약한 비편재화된 π 결합 때문에 표준 조건에서 다이아몬드보다 반응성이 훨씬 크다. 예를 들면 표준 조건에서 높은 온도의 진한 질산은 흑연의 육각형 구조를 보존하는 대신 더 큰 구조를 분해하면서 흑연을 C6(CO2H)6의 멜리트산으로 산화시킨다.[16]
탄소는 온도 5,800 K (5,530 °C; 9,980 °F)의 탄소 아크로 승화한다. 따라서, 어떤 동소체든지 탄소는 텅스텐과 레늄 같은 가장 높은 녹는점을 가진 금속의 녹는점에서도 고체 상태를 유지한다. 열역학적으로 산화되기 쉬우나, 탄소는 철이나 구리 같이 표준 조건에서 약한 환원제로 작용하는 원소보다 산화에 더 효과적으로 저항한다.
탄소는 여섯 번째 원소로, 바닥 상태 전자 배열은 1s22s22p2이며 원자가 전자는 4개이다. 1~4차 이온화 에너지는 1086.5, 2352.6, 4620.5, 6222.7 kJ/mol로 3~7족의 같은 14족 원소보다 크다. 탄소의 전기음성도는 2.5로, 같은 14족 원소(1.8~1.9)보다 훨씬 크지만 대부분의 인근 비금속과 2~3주기의 전이 금속과 가까운 수치다. 탄소의 공유 반지름은 배위수와 결합한 원자에 따라 다양하지만 평균적으로 77.2 pm (C–C), 66.7 pm (C=C), 60.3 pm (C≡C)이다. 일반적으로 공유 반지름은 배위수가 낮을수록, 결합 차수가 높을 수록 감소한다.[17]
탄소 화합물은 지구상 모든 생물들의 삶에 근본적인 영향을 끼치며, 탄소-질소 순환은 태양과 여러 별들에 의해 만들어진 에너지를 제공해주는 역할을 한다. 다양한 화합물을 형성하지만 대체로 표준 조건에서는 상대적으로 반응성이 낮다. 표준 온도 압력에서 매우 강한 산화제를 제외하고는 반응성이 낮다. 황산, 염산, 염소, 그리고 다른 알칼리 금속과 반응하지 않는다. 고온에서 탄소는 산소와 반응하여 일산화 탄소를 형성하며, 금속 산화물을 환원시킨다. 이 발열 반응은 제철 산업에서 철을 제련하고 강철의 탄소 함량을 조절하기 위해 다음과 같이 쓰인다.
- Fe
3O
4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
다음은 탄소의 기체와의 반응으로, 황과 반응시 이황화탄소를, 수증기와 반응시 일산화탄소를 생성한다.
- C(s) + H2O(g) → CO(g) + H2(g).
탄소는 고온에서 일부 금속과 결합하여 강철에서의 철 탄화물인 시멘타이트나, 연마제로나 바이트로 끝을 강화하는데 쓰이는 탄화텅스텐 같은 금속 탄화물을 형성한다.
탄소 동소체는 서로 매우 다른 특성을 가지고 있다.
| 흑연은 매우 부드러운 물질 중 하나이다. | 인조 초고경도 다이아몬드는 매우 단단한 물질이다.[18] |
| 흑연은 극평활 특성을 지녀 매우 좋은 평활제이다.[19] | 다이아몬드는 최고의 연마제이다. |
| 흑연은 전기 전도체이다.[20] | 다이아몬드는 우수한 전기 절연체이며[21], 그 어떤 물질 보다 최고의 파괴전계영역을 자랑한다. |
| 흑연은 방화, 열 차폐 등으로 단열재로 쓰이기도 하지만, 어떤 구조로는 좋은 열 전도체로 쓰일 수도 있다. | 다이아몬드는 자연물 중에서는 알려진 가장 좋은 열전도체이다. |
| 흑연은 불투명하다. | 다이아몬드는 매우 투명하다. |
| 흑연은 육방정계의 결정을 형성한다.[22] | 다이아몬드는 등축정계의 결정을 형성한다. |
| 비정질 탄소는 완벽한 등방성 광물이다. | 탄소 나노튜브는 가장 잘 알려진 이방성 광물 중 하나이다. |
그리고 물리학에서 탄소는 원자간의 상대 질량을 나타내는 기본 단위로서의 역할을 한다(12C, 즉 탄소 12를 12로 기준함. 이에 적용하면 수소 원자의 질량은 1이 됨).
그리고 자연에 미량으로 존재하는 14C, 즉 탄소 14는 방사성 원소로서 5730년의 반감기를 통하여 14N으로 변환되는 현상(반감기가 지나면 양이 절반씩 줄어든다)을 이용하여 약 500~5만 년 정도의 화석이나 고고학적 표본의 연대를 측정하는 방사성 탄소연대 측정법에 사용한다. 생물이 살아있을 때는 방사성 탄소도 계속 공급되다가 생물이 죽으면 더이상 탄소가 공급되지 않아 방사성 탄소의 양이 더이상 늘어나지 않고 14N로 변화한다.
동소체[편집]
단일 탄소 원자는 매우 수명이 짧다. 따라서 탄소는 보통 여러 분자 배열을 가진 다양한 원자 구조, 즉 안정적인 동소체로 존재한다. 대표적인 탄소 동소체로는 비정질 탄소, 흑연, 다이아몬드 등이 있다. 신물질인 풀러렌은 오늘날 주로 합성하여 연구에 사용되며, 풀러렌에는 버크민스터풀러렌[23][24], 탄소 나노튜브[25], 탄소 나노돌기[26], 탄소 나노섬유[27][28] 등이 있다. 이외에도 론스달라이트[29], 유리상 탄소[30] , 탄소 나노폼[31], 선형 아세틸렌성 탄소[32] 등이 있다.
2009년 기준으로 그래핀은 현재까지 실험적으로 검증된 가장 강한 물질이다.[33] 흑연에서 그래핀을 분리하는 공정은 아직까지 경제성이 떨어져 추가적인 기술 발전이 필요하다.[34] 저렴한 공정이 개발된다면, 그래핀은 우주 엘리베이터 건설에 사용될 수 있을 것이다. 그리고 수소 연료 자동차에서 안전한 수소 저장고를 만드는 데 사용될 수도 있다.[35]

탄소 원자들은 결정 구조를 이루지 못하고 불규칙한 비정질 상태로도 존재한다. 이때 탄소는 분말 형태이며, 숯, 카본 블랙(그을음), 활성탄의 주 재료이다. 대기압에서 탄소의 가장 안정한 상은 흑연인데, 각 원자들이 방향족 탄화 수소에서 삼각평면 구조로 결합해 육각 고리 패턴을 형성하고 있다.[36] 따라서 흑연은 판상 구조를 하고 있으며, 각각의 판은 약한 반데르발스 힘으로 결합되어 있다. 각각의 판들은 미끄러지기 쉬우며 충격에 약하기 때문에 흑연은 부드럽고 쉽게 쪼개지는 특성을 가지고 있다. 탄소의 최외각 전자가 4개이므로 흑연에서 세 개의 공유 결합을 이루고 남은 전자는 π-오비탈의 형태로 비편재화되어 있기 때문에 흑연은 전기 전도도가 높은 물질이다. 그런데 전자는 각각의 판 사이에서만 이동할 수 있기 때문에 대부분의 금속보다 낮은 벌크(Bulk) 전기 전도도를 가진다. 비편재화는 실온에서 흑연이 다이아몬드보다 안정한 이유 중 하나이다.
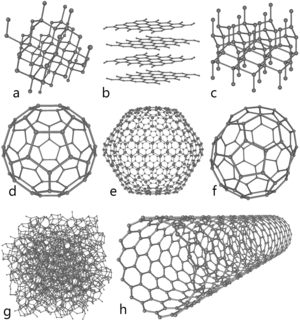
초고압에서 탄소는 다이아몬드 상을 가진다. 다이아몬드는 흑연보다 밀도가 두 배가량 높다. 다이아몬드에서 각 탄소 원자들은 사면체 결합을 하고 있으며, 규소, 게르마늄과 같은 입방체 구조를 하고 있다. 다이아몬드는 매우 강한 공유결합을 하고 있어, 자연물 중에서는 경도가 가장 높은 물질이다. "다이아몬드는 영원하다"는 통념과는 반대로, 다이아몬드는 STP 하에서 열역학적으로 불안정하며(ΔfG°(다이아몬드, 298 K) = 2.9 kJ/mol[37]) 흑연으로 상전이한다.[6] 하지만 활성화 에너지 장벽이 매우 높아서 STP에서는 매우 느리게 일어나는 현상이다. 상도표에서 탄소의 저압, 저온 상태는 실험적으로 정확히 확인되지 않았지만, 밀도 함수 이론을 통한 연구를 통해 0 K, 0 Pa에서 다이아몬드가 흑연보다 1.1 kJ·mol−1 더 안정하다는 사실을 밝혀냈다.[38] 특정 조건에서 탄소는 다이아몬드처럼 모든 원자가 공유결합된 육방 결정 격자인 론스달라이트 상을 가진다.[29]
풀러렌은 합성 결정체로, 흑연과 비슷한 구조를 하고 있지만 육각형 고리로만 구성된 흑연과는 달리 오각형 또는 칠각형 고리를 가지고 있다. 탄소 원자들이 흑연 판에서 떨어져 나가거나 새로 추가되면 판은 구, 타원구, 원통 형태로 휘게 된다. 풀러렌은 버크민스터풀러렌(버키볼), 탄소 나노튜브(버키튜브), 탄소 나노돌기로 나눌 수 있다. 풀러렌의 특성은 아직 완전히 밝혀지지 않았으며, 나노 물질 분야에서 활발히 연구되고 있다. 풀러렌과 버크민스터풀러렌(버키볼)이라는 명칭은 디오데식 돔의 발명가인 리처드 버크민스터 풀러의 이름을 딴 것이다. 버크민스터풀러렌은 삼각피라미드 분자 구조를 하고 있는 고분자 물질이며, 회전 타원체 형태이다. (가장 잘 알려져 있고 단순한 것은 축구공 모양의 C60 버크민스터풀러렌이다[23]) 탄소 나노튜브는 버크민스터풀러렌과 구조적으로 비슷하지만, 속이 빈 원통 형태로 굽은 판에서 각 원자들이 삼각피라미드 구조로 결합해 있다.[24][25] 탄소 나노돌기는 2007년에 처음 밝혀졌으며, 버크민스터풀러렌이 탄소 나노튜브에 공유결합되어 있다.[26]
탄소 나노폼은 1997년에 발견된 강자성 동소체이다. 6원자 및 7원자 고리에서 탄소 원자들이 삼각 결합하고 있는 삼차원 망에서 원자들이 저밀도 클러스터 조립으로 뭉쳐져 있다. 탄소 나노폼은 밀도가 2 kg/m3밖에 되지 않는다.[39] 유리상 탄소는 밀폐기공률이 매우 높지만,[30] 흑연과는 달리 판이 나란히 쌓이지 않고 불규칙하게 배열되어 있다. 선형 아세틸렌성 탄소의 화학 구조는 ―(C:::C)n―이다.[32] sp 혼성 오비탈로 선형 결합하고 있으며, 단일 결합과 삼중 결합이 교대로 이어지는 카르빈 중합체이다. 영률이 다이아몬드의 40배[40]이기 때문에 나노 기술 분야에서 상당한 관심이 쏟아지고 있다.
2015년, 노스 캐롤라이나 주립 대학의 한 연구팀은 비정질 탄소 분말에 짧은 시간동안 고에너지 레이저를 쏘아, Q-탄소라 명명한 새로운 탄소 동소체를 발견했다. Q-탄소는 강자성이자 형광 물질이고, 다이아몬드보다 경도가 높은 것으로 밝혀졌다.[41]
유기물[편집]
유기물(유기 화합물, organic Compounds)는 구조의 기본 골격으로 탄소 원자를 갖는 화합물을 통칭한다. 이에 반하여 무기물(무기 화합물, Inorganic Compunds)은 탄소를 포함하지 않는 화합물의 통칭이나, 영어 명칭에서 보듯이, 유기물은 생명체의 활동에 의해 생기는 것이라는 의미로 생성된 명칭이어서, 탄소를 포함하지만 생물 유래가 아닌 화합물은 무기물로 분류한다.
탄산[편집]
앙금 생성 반응을 통해 산출되는 탄산 칼슘, 탄산 바륨 등은 흰색 앙금이며, 이 앙금들은 산과 쉽게 반응하여 이산화 탄소와 물을 발생한다. 따라서 탄산 이온(CO32-)을 검출할 때, 이러한 앙금이 유용하다.
용도[편집]
유기물[편집]
생명 현상을 유지하는 데 필요한 기본적인 화합물로서, 사람뿐만이 아닌 모든 생명 활동의 기본으로 수많은 유기물이 존재하고, 생물체가 유기물을 사용된다.
무기물[편집]
탄소를 포함하지만 무기물로 분류된 화합물 중 대표적인 것이 이산화탄소인데, 최근 지구 온난화와 관련하여 탄소 배출권 등의 형태로 사용량을 규제하려는 움직임이 커지고 있다. 유기물질은 광물에서 얻을 수 있는 무기물질의 상대적 개념으로 살아있거나 있었던 생물에서 얻어지는 물질을 유기화합물이라 했었는데 오늘 날에는 화합물의 구성원자중 탄소를 포함하며 그 물질을 분해하는 과정에서 에너지를 얻을 수 있으면 유기물, 없으면 무기물이라 한다.
동소체[편집]
과거부터 연필 등의 형태로 사용되어온 흑연과 보석이면서 모든 광물 중 가장 경도가 높은 다이아몬드, 극저온 상태에서 초전도 현상을 보이고 수지의 내구성 및 내열성을 높일 수 있는 풀러렌, 반도체의 성질을 가지는 탄소 나노튜브 등이 사용된다. 다른 동소체로, 그래핀이라는 2차원 구조의 물질이 있다.
같이 보기[편집]
각주[편집]
- ↑ 가 나 Haaland, D (1976). “Graphite-liquid-vapor triple point pressure and the density of liquid carbon”. 《Carbon》 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ↑ 가 나 Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. 《Carbon》 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ↑ “Carbon – Naturally occurring isotopes”. WebElements Periodic Table. 2008년 10월 9일에 확인함.
- ↑ “History of Carbon”. 2012년 11월 1일에 원본 문서에서 보존된 문서. 2013년 1월 10일에 확인함.
- ↑ The Internet Encyclopedia of Science (2008년 10월 9일). “Biological Abundance of Elements”.
- ↑ 가 나 “World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)”. 2008년 10월 9일. 2008년 10월 5일에 원본 문서에서 보존된 문서. 2017년 8월 2일에 확인함.
- ↑ 가 나 Chemistry Operations (2003년 12월 15일). “Carbon”. Los Alamos National Laboratory. 2008년 9월 13일에 원본 문서에서 보존된 문서. 2008년 10월 9일에 확인함.
- ↑ Deming, Anna (2010). “King of the elements?”. 《Nanotechnology》 21. doi:10.1088/0957-4484/21/30/300201. 2016년 11월 15일에 확인함.
- ↑ 로버트 M. 헤이즌, 김홍표 옮김 (2022). 《탄소 교향곡》. 뿌리와이파리. 28쪽.
- ↑ 로버트 M. 헤이즌(2022), 35쪽.
- ↑ 로버트 M. 헤이즌(2022), 36~37쪽.
- ↑ 로버트 M. 헤이즌(2022), 38쪽.
- ↑ 로버트 M. 헤이즌(2022), 40쪽.
- ↑ Greenville Whittaker, A. (1978). “The controversial carbon solid−liquid−vapour triple point”. 《Nature》 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ↑ Zazula, J. M. (1997). “On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam” (PDF). CERN. 2009년 6월 6일에 확인함.
- ↑ Greenwood and Earnshaw, pp. 289–292
- ↑ Greenwood and Earnshaw, pp. 276–8
- ↑ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). “Materials: Ultrahard polycrystalline diamond from graphite”. 《Nature》 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ↑ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). “Superlubricity of Graphite” (PDF). 《Physical Review Letters》 92 (12). Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101.
- ↑ Deprez, N.; McLachan, D. S. (1988). “The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction”. 《Journal of Physics D: Applied Physics》 (Institute of Physics) 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ↑ Collins, A. T. (1993). “The Optical and Electronic Properties of Semiconducting Diamond”. 《Philosophical Transactions of the Royal Society A》 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ↑ Delhaes, P. (2001). 《Graphite and Precursors》. CRC Press. ISBN 90-5699-228-7.
- ↑ 가 나 Unwin, Peter. “Fullerenes(An Overview)”. 2007년 12월 1일에 원본 문서에서 보존된 문서. 2007년 12월 8일에 확인함.
- ↑ 가 나 Ebbesen, T. W., 편집. (1997). 《Carbon nanotubes—preparation and properties》. Boca Raton, Florida: CRC Press. ISBN 0-8493-9602-6.
- ↑ 가 나 Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., 편집. (2001). “Carbon nanotubes: synthesis, structures, properties and applications”. 《Topics in Applied Physics》 (Berlin: Springer) 80. ISBN 3-540-41086-4.
- ↑ 가 나 Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; 외. (2007). “A novel hybrid carbon material”. 《Nature Nanotechnology》 2 (3): 156–161. Bibcode:2007NatNa...2..156N. doi:10.1038/nnano.2007.37. PMID 18654245.
- ↑ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). “Investigations of NanoBud formation”. 《Chemical Physics Letters》 446: 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ↑ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). “Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst”. 《Applied Catalysis A: General》 274: 1–8. doi:10.1016/j.apcata.2004.04.008.
- ↑ 가 나 Clifford, Frondel; Marvin, Ursula B. (1967). “Lonsdaleite, a new hexagonal polymorph of diamond”. 《Nature》 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ↑ 가 나 Harris, PJF (2004). “Fullerene-related structure of commercial glassy carbons” (PDF). 《Philosophical Magazine》 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715. doi:10.1080/14786430410001720363. 2012년 3월 19일에 원본 문서 (PDF)에서 보존된 문서. 2011년 7월 6일에 확인함.
- ↑ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (1999). “Structural analysis of a carbon foam formed by high pulse-rate laser ablation”. 《Applied Physics A: Materials Science & Processing》 69 (7): S755–S758. doi:10.1007/s003390051522.
- ↑ 가 나 Heimann, Robert Bertram; Evsyukov, Sergey E. & Kavan, Ladislav (28 February 1999). 《Carbyne and carbynoid structures》. Springer. 1–쪽. ISBN 978-0-7923-5323-2. 23 November 2012에 원본 문서에서 보존된 문서. 2011년 6월 6일에 확인함.
- ↑ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). “Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene”. 《Science》 321 (5887): 385–8. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798. 요약문.
- ↑ Sanderson, Bill (2008년 8월 25일). “Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator”. nypost.com. 2008년 9월 6일에 원본 문서에서 보존된 문서. 2008년 10월 9일에 확인함.
- ↑ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (2011년 2월 22일). “Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage”. 《Chemistry of Materials》 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ↑ Jenkins, Edgar (1973). 《The polymorphism of elements and compounds》. Taylor & Francis. 30쪽. ISBN 0-423-87500-0. 2012년 11월 23일에 원본 문서에서 보존된 문서. 2011년 5월 1일에 확인함.
- ↑ Rossini, F. D.; Jessup, R. S. (1938). “Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond” (PDF). 《Journal of Research of the National Bureau of Standards》 21 (4): 491. doi:10.6028/jres.021.028.
- ↑ Grochala, Wojciech (2014년 4월 1일). “Diamond: Electronic Ground State of Carbon at Temperatures Approaching 0 K”. 《Angewandte Chemie International Edition》 (영어) 53 (14): 3680–3683. doi:10.1002/anie.201400131. ISSN 1521-3773.
- ↑ Schewe, Phil & Stein, Ben (March 26, 2004). “Carbon Nanofoam is the World's First Pure Carbon Magnet”. 《Physics News Update》 678 (1). March 7, 2012에 원본 문서에서 보존된 문서.
- ↑ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). “Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods”. 《Angew. Chem. Int. Ed.》 44 (45): 7432–5. doi:10.1002/anie.200502448. PMID 16240306.
- ↑ “Researchers Find New Phase of Carbon, Make Diamond at Room Temperature”. 《news.ncsu.edu》. 2016년 4월 6일에 원본 문서에서 보존된 문서. 2016년 4월 6일에 확인함.
외부 링크[편집]
- “탄소”. 《네이버캐스트》.
- (영어) 탄소 - WebElements.com