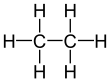
에테인
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Ethane[1] | |||
| 체계명
Dicarbane (never recommended[1]) | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| 1730716 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| EC 번호 |
| ||
| 212 | |||
| MeSH | Ethane | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1035 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C2H6 | |||
| 몰 질량 | 30.070 g·mol−1 | ||
| 겉보기 | 무색 기체 | ||
| 냄새 | Odorless | ||
| 밀도 |
544.0 kg/m3 (liquid at -88,5 °C) | ||
| 녹는점 | −182.8 °C; −296.9 °F; 90.4 K | ||
| 끓는점 | −88.5 °C; −127.4 °F; 184.6 K | ||
| 56.8 mg L−1[3] | |||
| 증기 압력 | 3.8453 MPa (at 21.1 °C) | ||
헨리 상수 (kH)
|
19 nmol Pa−1 kg−1 | ||
| 산성도 (pKa) | 50 | ||
| 염기도 (pKb) | -36 | ||
| 짝산 | Ethanium | ||
자화율 (χ)
|
-37.37·10−6 cm3/mol | ||
| 열화학 | |||
열용량 (C)
|
52.49 J K−1 mol−1 | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−84 kJ mol−1 | ||
표준 연소 엔탈피 (ΔcH⦵298)
|
−1561.0–−1560.4 kJ mol−1 | ||
| 위험 | |||
| 물질 안전 보건 자료 | inchem.org | ||
| GHS 그림문자 | 
| ||
| 신호어 | 위험 | ||
| H220, H280 | |||
| P210, P410+403 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | −135 °C (−211 °F; 138 K) | ||
| 472 °C (882 °F; 745 K) | |||
| 폭발 한계 | 2.9–13% | ||
| 관련 화합물 | |||
관련 알케인
|
|||
관련 화합물
|
|||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
에테인(영어: ethane 에세인[*] /éθein/) 또는 에탄(독일어: Ethan)은 탄소와 수소 원자로 이루어진 C
2H
6의 화학식을 가지는 지방족 화합물이며 두 개의 탄소를 지닌 알케인의 일종이다. 표준 온도 압력에서 에테인은 무색 및 무취의 기체이다. 에테인은 천연 가스로부터 대량 생산되거나, 정유 과정의 부산물로서도 얻어진다. 에틸렌의 대량 생산을 위한 원료로 주로 사용된다.
역사[편집]
에테인은 1834년에 마이클 패러데이가 아세트산 칼륨의 전기 분해를 통해 최초로 합성하였으나 그는 그가 합성한 탄화수소 화합물을 메테인으로 착각했다. 그 후 1847년과 1849년 사이에 헤르만 콜베와 에드워드 프랭클랜드가 프로페인나이트릴과 아이오딘화 에틸을 칼륨과 전기 분해 반응을 시켜 에테인을 생성했으나 이들은 이 물질을 메틸 작용기의 유리기로 착각했다. 1864년에 최종적으로 칼 쇼를렘머가 위 전기 분해 반응으로부터 생성된 물질은 에테인이라는 것을 보였다.
반응[편집]
에테인은 실험실에서 콜베 전기 분해를 이용하면 쉽게 생성할 수 있다. 아세트산염 액체를 전기 분해하면 양극에서는 아세트산염이 산화되어 이산화 탄소와 메틸 유리기가 생성되는데, 메틸 유리기는 상당히 반응적이기 때문에 서로 결합해서 에테인이 된다.
에테인의 연소 반응은 다음과 같다.
- 2C2H6 + 7O2 ⟶ 4CO2 + 6H2O
각주[편집]
- ↑ 가 나 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 4쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Similarly, the retained names ‘ethane’, ‘propane’, and ‘butane’ were never replaced by systematic names ‘dicarbane’, ‘tricarbane’, and ‘tetracarbane’ as recommended for analogues of silane, ‘disilane’; phosphane, ‘triphosphane’; and sulfane, ‘tetrasulfane’.
- ↑ “Ethane – Compound Summary”. 《PubChem Compound》. USA: National Center for Biotechnology Information. 2004년 9월 16일. 2011년 12월 7일에 확인함.
- ↑ Lide, D. R., 편집. (2005). 《CRC Handbook of Chemistry and Physics》 86판. Boca Raton (FL): CRC Press. 8.88쪽. ISBN 0-8493-0486-5.