티로신 (아미노산)
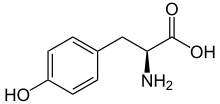 L-티로신의 골격 구조식
| |||
 생리학적 pH에서의 L-티로신
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
S-tyrosine
| |||
| 별칭
L-2-amino-3-(4-hydroxyphenyl)propanoic acid
| |||
| 식별자 | |||
| |||
3D 모델 (JSmol)
|
| ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.419 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C9H11NO3 | |||
| 몰 질량 | 181.191 g·mol−1 | ||
| .0453 g/100 mL | |||
자화율 (χ)
|
-105.3·10−6 cm3/mol | ||
| 위험 | |||
| NFPA 704 (파이어 다이아몬드) | |||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
티로신(영어: tyrosine, 기호: Tyr or Y)[2]는 단백질의 생합성에 사용되는 α-아미노산이다. 4-하이드록시페닐알라닌(영어: 4-hydroxyphenylalanine)이라고도 한다. 티로신은 α-아미노기(생물학적 조건에서 양성자화된 −NH3+ 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 곁사슬인 하이드록시벤질기를 포함하고 있다. 티로신은 극성의 곁사슬을 가지고 있는 비필수 아미노산이다. "티로신"이라는 용어는 1846년에 독일의 화학자 유스투스 폰 리비히가 치즈의 단백질인 카제인에서 처음으로 발견하였고 "치즈"를 의미하는 그리스어 "tyrós"에서 유래하였다.[3][4] 티로신이 작용기나 곁사슬로 지칭될 때는 티로실(영어: tyrosyl)이라고 불린다. 티로신은 일반적으로 소수성 아미노산으로 분류되지만, 페닐알라닌보다 더 친수성이다.[5] 티로신은 UAC, UAU 코돈에 의해 암호화되어 있다.
기능[편집]
단백질생성성 아미노산인 것 외에도 티로신은 페놀의 특성으로 인해 특별한 역할을 한다. 이것은 신호전달 과정의 일부인 단백질에서 일어나며 단백질 키네이스를 통해 전달되는 인산기의 수용체 역할을 한다. 하이드록실기의 인산화는 표적 단백질의 활성을 변화시키거나 SH2 도메인 결합을 통한 신호전달 캐스케이드의 일부를 형성할 수 있다.
티로신 잔기는 또한 광합성에서 중요한 역할을 한다. 엽록체의 광계 II에서 티로신은 산화된 엽록소의 환원에서 전자 공여체로 작용한다. 이 과정에서 티로신은 페놀성 하이드록실기의 수소 원자를 잃게 된다. 이 라디칼은 광계 II에서 4개의 핵심 망가니즈 클러스터에 의해 연속적으로 환원된다.
식이 요구 사항 및 공급원[편집]
페닐알라닌과 티로신의 영양소 섭취기준(권장 식이 허용량, RDA)은 체중 1 kg당 42 mg이다.[6] 체중이 70 kg인 사람의 경우 권장량은 2.94 g(페닐알라닌+티로신)이다.
페닐알라닌으로부터 체내에서도 합성될 수 있는 티로신은 닭고기, 칠면조, 생선, 우유, 요구르트, 코티지 치즈, 치즈, 땅콩, 아몬드, 호박씨, 참깨, 콩 제품, 리마콩과 같은 많은 고단백 식품 뿐만 아니라 아보카도와 바나나에서도 발견된다.[7] 예를 들어, 달걀 흰자위에는 달걀 1개당 약 250 mg이 들어 있는 반면,[8] 기름기가 없는 쇠고기, 양고기, 돼지고기, 연어, 닭고기, 칠면조에는 85 g당 약 1 g이 들어 있다.[8]
생합성[편집]
 |
식물 및 대부분의 미생물에서 티로신은 시킴산 경로의 대사 중간생성물인 프레펜산으로부터 생성된다. 프레펜산은 하이드록실기를 유지하면서 산화적 탈카복실화되어 p-하이드록시페닐피루브산을 생성하고, p-하이드록시페닐피루브산은 글루탐산을 질소 공급원으로 사용하여 아미노기 전이 반응을 통해 티로신 및 α-케토글루타르산을 생성한다.
포유류는 음식물로부터 섭취한 필수 아미노산인 페닐알라닌으로부터 티로신을 합성한다. 페닐알라닌에서 티로신으로의 전환은 일산소화효소인 페닐알라닌 하이드록실화효소에 의해 촉매된다. 이 효소는 페닐알라닌의 방향족 고리에 하이드록실기를 첨가하여 티로신으로 전환하는 반응을 촉매한다.
물질대사[편집]
 |
인산화 및 황산화[편집]
일부 티로신 잔기는 단백질 키네이스에 의해 하이드록실기에서 인산화될 수 있다. 인산화된 형태의 티로신은 포스포티로신(영어: phosphotyrosine)이라고 한다. 티로신 인산화는 신호전달 및 효소 활성의 조절에서 핵심적인 단계 중 하나로 간주된다. 포스포티로신은 특정 항체를 통해 검출될 수 있다. 티로신 잔기는 또한 티로신 황산화로 알려진 과정인 황산기의 첨가에 의해 변형될 수 있다.[9] 티로신 황산화는 티로실단백질 황전이효소에 의해 촉매된다. 위에서 언급한 포스포티로신 항체와 마찬가지로 최근에는 설포티로신을 특이적으로 검출하는 항체가 개발되었다.[10]
신경전달물질과 호르몬의 전구체[편집]
뇌의 도파민작동성 세포에서 티로신은 티로신 하이드록실화효소에 의해 L-도파로 전환된다. 티로신 하이드록실화효소는 신경전달물질인 도파민의 합성에 관여하는 속도 제한 효소이다. 그런 다음 도파민은 노르에피네프린(노르아드레날린) 및 에피네프린(아드레날린)과 같은 다른 카테콜아민으로 전환될 수 있다.
갑상샘의 교질에서의 갑상샘 호르몬인 트라이아이오도티로닌(T3)과 티록신(T4)도 티로신으로부터 유래한다.
 |
알칼로이드의 전구체[편집]
양귀비(Papaver somniferum)의 라텍스는 티로신을 알칼로이드인 모르핀으로 전환시키는 것으로 나타났으며 생체 내 합성 경로를 추적하기 위해 방사성 원소인 14C로 표지된 티로신을 사용하여 티로신에서 모르핀으로의 생합성 경로가 밝혀졌다.[11]
천연 페놀의 전구체[편집]
티로신 암모니아-분해효소는 천연 페놀 생합성 경로의 효소이다. 티로신 암모니아-분해효소는 L-티로신을 p-쿠마르산으로 전환시킨다.
색소의 전구체[편집]
티로신은 멜라닌 색소의 전구체이기도 하다.
유비퀴논 합성에서의 역할[편집]
유비퀴논의 일부를 형성하는 벤조퀴논 구조를 합성하려면 티로신(또는 그 전구체인 페닐알라닌)이 필요하다.
분해[편집]
 |
L-티로신(동의어: 파라-하이드록시페닐알라닌)의 분해는 티로신 아미노기전이효소에 의해 파라-하이드록시페닐피루브산으로의 α-케토글루타르산 의존성 아미노기 전이 반응으로 시작된다. p로 축약되는 파라는 곁사슬의 하이드록실기와 페닐기가 서로 마주 보고 있음(아래의 그림 참조)을 의미한다.
다음 산화 단계에서 p-하이드록시페닐피루브산 이산소화효소에 의해 CO2와 호모젠티스산(2,5-다이하이드록시페닐-1-아세트산)으로 분해된다.[12] 호모젠티스산의 방향족 고리를 분해하기 위해서는 추가적인 이산소화효소인 호모젠티스산 1,2-이산소화효소가 필요하다. 따라서 추가적인 O2 분자의 통합을 통해 4-말레일아세토아세트산이 생성된다.
푸마릴아세토아세트산은 산화를 통해 하이드록실기로부터 생성된 카복실기의 회전을 통해 말레일아세토아세트산 이성질화효소에 의해 생성된다. 말레일아세토아세트산 이성질화효소는 조효소로 글루타티온을 함유하고 있다. 푸마릴아세토아세트산은 최종적으로 물 분자의 첨가를 통해 푸마릴아세토아세트산 가수분해효소에 의해 분해된다.
이로써 푸마르산(시트르산 회로의 대사 중간생성물이기도 함)과 아세토아세트산(3-케토뷰티르산)이 유리된다. 아세토아세트산은 석시닐-CoA로 활성화된 케톤체이며, 그 후 아세틸-CoA로 전환되어 시트르산 회로에 의해 산화되거나 지방산 합성에 사용될 수 있다.
플로레트산은 또한 쥐에서 티로신의 소변 대사 산물이다.[13]
오르토-티로신 및 메타-티로신[편집]
 |
L-티로신의 세 가지 구조 이성질체가 알려져 있다. 파라 이성질체(파라-티로신, p-티로신, 4-하이드록시페닐알라닌)인 일반적인 아미노산인 L-티로신 외에도 자연에서 생성되는 두 가지 추가적인 위치 이성질체, 즉 메타-티로신(3-하이드록시페닐알라닌, L-m-티로신, m-티로신) 및 오르토-티로신(L-o-티로신, o-티로신, 2-하이드록시페닐알라닌)이 있다. 드물게 존재하는 m-티로신 및 o-티로신 이성질체는 산화 스트레스 조건에서 페닐알라닌의 비효소적 자유 라디칼 하이드록실화를 통해 생성된다.[14][15]
m-티로신 및 유사체(자연에서 드물지만 합성으로 이용 가능)는 파킨슨병, 알츠하이머병 및 관절염에 적용할 수 있는 것으로 나타났다.[16]
의료용[편집]
티로신은 신경전달물질의 전구체이며 혈장 신경전달물질의 수준(특히 도파민과 노르에피네프린)을 증가시키지만[17] 정상인의 기분에는 거의 영향을 미치지 않는다.[18][19][20] 많은 연구에서 티로신은 스트레스, 추위, 피로(쥐의 경우),[21] 장기간의 작업 및 수면 부족시[22][23] 스트레스 호르몬 수치 감소,[24] 동물 실험에서 볼 수 있는 스트레스 유발 체중 감소의 감소,[21] 사람을 대상으로 한 실험에서 볼 수 있는 인지 기능 및 신체적 기능 향상에 유용하다는 것이 발견되었다.[19][25][26]
티로신은 정상적인 상황에서 인지 기능 또는 신체적 기능에 큰 영향을 미치지 않는 것으로 보이지만[27][28] 멀티태스킹 중에 작업 기억을 더 잘 유지하는 데 도움을 준다.[29]
상호작용[편집]
모노아민 산화효소 저해제(MAOI)가 티로신과 상호작용 하는지 여부는 알려져 있지 않다.[30]
산업적 합성[편집]
L-티로신 및 그 유도체(L-도파, 멜라닌, 페닐프로파노이드 등)는 의약품, 식이 보충제, 및 식품 첨가물에 사용된다. 이전에는 두 가지 방법이 L-티로신을 제조하는 데 사용되었다. 첫 번째 방법은 화학적 접근법을 사용하여 단백질 가수분해물로부터 원하는 아미노산을 추출하는 것이다. 두 번째 방법은 티로신 페놀-분해효소를 사용하여 페놀, 피루브산, 암모니아로부터 효소적으로 합성하는 것이다.[31] 유전공학의 발전과 산업 발효의 도입으로 인해 대장균의 조작된 균주를 사용하여 L-티로신을 합성하게 되었다.[32][31]
같이 보기[편집]
각주[편집]
- ↑ 가 나 Frey MN, Koetzle TF, Lehmann MS, Hamilton WC (1973). “Precision neutron diffraction structure determination of protein and nucleic acid components. X. A comparison between the crystal and molecular structures of L‐tyrosine and L‐tyrosine hydrochloride”. 《J. Chem. Phys.》 58 (6): 2547–2556. Bibcode:1973JChPh..58.2547F. doi:10.1063/1.1679537.
- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ 〈Tyrosine〉. 《The Columbia Electronic Encyclopedia, 6th ed》. Infoplease.com — Columbia University Press. 2007. 2008년 4월 20일에 확인함.
- ↑ Harper D (2001). “Tyrosine”. 《Online Etymology Dictionary》. 2008년 4월 20일에 확인함.
- ↑ “Amino Acids - Tyrosine”. 《www.biology.arizona.edu》. 2018년 1월 31일에 확인함.
- ↑ Pencharz PB, Hsu JW, Ball RO (June 2007). “Aromatic amino acid requirements in healthy human subjects”. 《The Journal of Nutrition》 137 (6 Suppl 1): 1576S–1578S; discussion 1597S–1598S. doi:10.1093/jn/137.6.1576S. PMID 17513429.
- ↑ “Tyrosine”. 《University of Maryland Medical Center》. 2020년 4월 6일에 원본 문서에서 보존된 문서. 2011년 3월 17일에 확인함.
- ↑ 가 나 Top 10 Foods Highest in Tyrosine
- ↑ Hoffhines AJ, Damoc E, Bridges KG, Leary JA, Moore KL (December 2006). “Detection and purification of tyrosine-sulfated proteins using a novel anti-sulfotyrosine monoclonal antibody”. 《The Journal of Biological Chemistry》 281 (49): 37877–87. doi:10.1074/jbc.M609398200. PMC 1764208. PMID 17046811.
- ↑ Kanan Y, Hamilton RA, Sherry DM, Al-Ubaidi MR (December 2012). “Focus on molecules: sulfotyrosine”. 《Experimental Eye Research》 105: 85–6. doi:10.1016/j.exer.2012.02.014. PMC 3629733. PMID 22406006.
- ↑ Battersby, A. R.; Binks, R.; Harper, B. J. T. (1962년 1월 1일). “692. Alkaloid biosynthesis. Part II. The biosynthesis of morphine”. 《Journal of the Chemical Society (Resumed)》 (영어): 3534–3544. doi:10.1039/JR9620003534. ISSN 0368-1769.
- ↑ Zea-Rey AV, Cruz-Camino H, Vazquez-Cantu DL, Gutiérrez-García VM, Santos-Guzmán J, Cantú-Reyna C (2017년 11월 27일). “The Incidence of Transient Neonatal Tyrosinemia Within a Mexican Population”. 《Journal of Inborn Errors of Metabolism and Screening》 5: 232640981774423. doi:10.1177/2326409817744230.
- ↑ Booth AN, Masri MS, Robbins DJ, Emerson OH, Jones FT, DeEds F (1960). “Urinary phenolic acid metabolities of tyrosine”. 《Journal of Biological Chemistry》 235 (9): 2649–2652. doi:10.1016/S0021-9258(19)76930-0.
- ↑ Molnár GA, Wagner Z, Markó L, Kó Szegi T, Mohás M, Kocsis B, 외. (November 2005). “Urinary ortho-tyrosine excretion in diabetes mellitus and renal failure: evidence for hydroxyl radical production”. 《Kidney International》 68 (5): 2281–7. doi:10.1111/j.1523-1755.2005.00687.x. PMID 16221230.
- ↑ Molnár GA, Nemes V, Biró Z, Ludány A, Wagner Z, Wittmann I (December 2005). “Accumulation of the hydroxyl free radical markers meta-, ortho-tyrosine and DOPA in cataractous lenses is accompanied by a lower protein and phenylalanine content of the water-soluble phase”. 《Free Radical Research》 39 (12): 1359–66. doi:10.1080/10715760500307107. PMID 16298866. S2CID 31154432.
- ↑ Humphrey CE, Furegati M, Laumen K, La Vecchia L, Leutert T, Müller-Hartwieg JC, Vögtle M (2007). “Optimized Synthesis of L-m-Tyrosine Suitable for Chemical Scale-Up”. 《Organic Process Research & Development》 11 (6): 1069–1075. doi:10.1021/op700093y.
- ↑ Rasmussen DD, Ishizuka B, Quigley ME, Yen SS (October 1983). “Effects of tyrosine and tryptophan ingestion on plasma catecholamine and 3,4-dihydroxyphenylacetic acid concentrations”. 《The Journal of Clinical Endocrinology and Metabolism》 57 (4): 760–3. doi:10.1210/jcem-57-4-760. PMID 6885965.
- ↑ Leathwood PD, Pollet P (1982). “Diet-induced mood changes in normal populations”. 《Journal of Psychiatric Research》 17 (2): 147–54. doi:10.1016/0022-3956(82)90016-4. PMID 6764931.
- ↑ 가 나 Deijen JB, Orlebeke JF (1994). “Effect of tyrosine on cognitive function and blood pressure under stress”. 《Brain Research Bulletin》 33 (3): 319–23. doi:10.1016/0361-9230(94)90200-3. PMID 8293316. S2CID 33823121.
- ↑ Lieberman HR, Corkin S, Spring BJ, Wurtman RJ, Growdon JH (August 1985). “The effects of dietary neurotransmitter precursors on human behavior”. 《The American Journal of Clinical Nutrition》 42 (2): 366–70. doi:10.1093/ajcn/42.2.366. PMID 4025206.
- ↑ 가 나 Hao S, Avraham Y, Bonne O, Berry EM (February 2001). “Separation-induced body weight loss, impairment in alternation behavior, and autonomic tone: effects of tyrosine”. 《Pharmacology, Biochemistry, and Behavior》 68 (2): 273–81. doi:10.1016/S0091-3057(00)00448-2. PMID 11267632. S2CID 46405659.
- ↑ Magill RA, Waters WF, Bray GA, Volaufova J, Smith SR, Lieberman HR, 외. (August 2003). “Effects of tyrosine, phentermine, caffeine D-amphetamine, and placebo on cognitive and motor performance deficits during sleep deprivation”. 《Nutritional Neuroscience》 6 (4): 237–46. doi:10.1080/1028415031000120552. PMID 12887140. S2CID 21300076.
- ↑ Neri DF, Wiegmann D, Stanny RR, Shappell SA, McCardie A, McKay DL (April 1995). “The effects of tyrosine on cognitive performance during extended wakefulness”. 《Aviation, Space, and Environmental Medicine》 66 (4): 313–9. PMID 7794222.
- ↑ Reinstein DK, Lehnert H, Wurtman RJ (December 1985). “Dietary tyrosine suppresses the rise in plasma corticosterone following acute stress in rats”. 《Life Sciences》 37 (23): 2157–63. doi:10.1016/0024-3205(85)90566-1. PMID 4068899.
- ↑ Deijen JB, Wientjes CJ, Vullinghs HF, Cloin PA, Langefeld JJ (January 1999). “Tyrosine improves cognitive performance and reduces blood pressure in cadets after one week of a combat training course”. 《Brain Research Bulletin》 48 (2): 203–9. doi:10.1016/S0361-9230(98)00163-4. PMID 10230711. S2CID 27927524.
- ↑ Mahoney CR, Castellani J, Kramer FM, Young A, Lieberman HR (November 2007). “Tyrosine supplementation mitigates working memory decrements during cold exposure”. 《Physiology & Behavior》 92 (4): 575–82. doi:10.1016/j.physbeh.2007.05.003. PMID 17585971. S2CID 207372821.
- ↑ Chinevere TD, Sawyer RD, Creer AR, Conlee RK, Parcell AC (November 2002). “Effects of L-tyrosine and carbohydrate ingestion on endurance exercise performance”. 《Journal of Applied Physiology》 93 (5): 1590–7. doi:10.1152/japplphysiol.00625.2001. PMID 12381742.
- ↑ Strüder HK, Hollmann W, Platen P, Donike M, Gotzmann A, Weber K (April 1998). “Influence of paroxetine, branched-chain amino acids and tyrosine on neuroendocrine system responses and fatigue in humans”. 《Hormone and Metabolic Research》 30 (4): 188–94. doi:10.1055/s-2007-978864. PMID 9623632.
- ↑ Thomas JR, Lockwood PA, Singh A, Deuster PA (November 1999). “Tyrosine improves working memory in a multitasking environment”. 《Pharmacology, Biochemistry, and Behavior》 64 (3): 495–500. doi:10.1016/S0091-3057(99)00094-5. PMID 10548261. S2CID 24717770.
- ↑ “Tyrosine: Benefits, Side Effects and Dosage”. 《Healthline》 (영어). 2018년 2월 1일.
- ↑ 가 나 Lütke-Eversloh T, Santos CN, Stephanopoulos G (December 2007). “Perspectives of biotechnological production of L-tyrosine and its applications”. 《Applied Microbiology and Biotechnology》 77 (4): 751–62. doi:10.1007/s00253-007-1243-y. PMID 17968539. S2CID 23088822.
- ↑ Chavez-Bejar M, Baez-Viveros J, Martinez A, Bolivar F, Gosset G (2012). “Biotechnological production of L-tyrosine and derived compounds”. 《Process Biochemistry》 47 (7): 1017–1026. doi:10.1016/j.procbio.2012.04.005.
외부 링크[편집]
- Tyrosine MS Spectrum
- Tyrosine metabolism 보관됨 2019-07-26 - 웨이백 머신
- Phenylalanine and tyrosine biosynthesis
- Phenylalanine, Tyrosine, and tryptophan biosynthesis Archived 2021년 5월 6일 - 웨이백 머신
- 티로신 (아미노산) - ChemIDplus 데이터베이스