요소 회로
요소 회로(尿素回路, 영어: urea cycle)는 암모니아(NH3)로부터 요소((NH2)2CO)를 생성하는 일련의 화학 반응들로 구성된 순환형 대사 경로이다. 오르니틴 회로(영어: ornithine cycle)라고도 한다. 요소 회로를 사용하는 동물, 주로 양서류와 포유류를 요소 배출(ureotelic) 동물이라고 한다.
요소 회로는 배설을 위해 독성이 강한 암모니아를 요소로 전환시킨다.[1] 요소 회로는 시트르산 회로가 발견되기 5년 전인 1932년에 한스 크렙스와 쿠르트 헨젤라이트에 의해 발견된 최초의 대사 회로였다. 요소 회로는 나중에 라트너(Ratner)와 코헨(Cohen)에 의해 더 자세히 설명되었다. 요소 회로는 주로 간에서 일어나며, 정도는 덜 하지만 콩팥에서도 일어난다.
기능[편집]
아미노산의 이화대사의 결과로 노폐물인 암모니아가 생성된다. 모든 동물은 암모니아를 배설할 방법을 필요로 한다. 대부분의 수생생물 또는 암모니아 배출(ammonotelic) 생물은 암모니아를 다른 물질로 전환하지 않고 암모니아를 배출한다.[1] 암모니아와 같은 질소 노폐물을 쉽고 안전하게 제거할 수 없는 생물은 주로 간에서 일어나는 요소 회로를 통해 독성이 강한 암모니아를 독성이 덜한 요소와 같은 물질로 전환한다. 간에서 생성된 요소는 혈류를 통해 콩팥으로 운반되어 궁극적으로 소변으로 배설된다. 요소 회로는 이러한 생물에 필수적이다. 왜냐하면 질소나 암모니아가 체내로부터 제거되지 못하면 매우 해로울 수 있기 때문이다.[2] 새와 대부분의 곤충에서 암모니아는 요산 또는 요산염으로 전환되어 고체 형태로 배설된다. 또한 요소 회로는 산성인 이산화 탄소 노폐물을 염기성인 암모니아와 결합시켜 중성 pH를 유지하는 데 도움을 준다.
반응[편집]
요소 회로의 전체적인 과정은 NH+
4으로부터 1개 그리고 아스파르트산으로부터 1개, 총 2개의 아미노기와 HCO−
3로부터 1개의 탄소 원자를 상대적으로 독성이 덜한 노폐물인 요소로 전환하는 것이다.[3] 이 과정에서 4개의 고에너지 인산 결합(3ATP가 2ADP와 1AMP로 가수분해됨)의 분해가 비용으로 발생한다. 암모니아에서 요소로의 전환은 5가지 단계로 구성된다. 첫 번째 단계는 암모니아가 회로로 들어가기 위해 필요하고 나머지 네 가지 단계는 모두 회로 자체를 구성하는 부분의 일부이다. 회로로 들어가기 위해 암모니아는 카바모일 인산으로 전환된다. 요소 회로는 미토콘드리아에서 1가지와 세포질에서 3가지의 총 4가지 효소 반응으로 구성된다.[1][4] 요소는 5가지 효소 반응을 통해 암모니아로부터 생성된다.[3][4][5]
| 단계 | 반응물 | 생성물 | 효소 및 보조 인자 | 위치 |
|---|---|---|---|---|
| 1 | NH3 + HCO− 3 + 2ATP |
카바모일 인산 + 2ADP + Pi | 카바모일 인산 합성효소 I (CPS-1) | 미토콘드리아 |
| 2 | 카바모일 인산 + 오르니틴 | 시트룰린 + Pi | 오르니틴 카바모일기전이효소 (OTC), 아연, 비오틴 | 미토콘드리아 |
| 3 | 시트룰린 + 아스파르트산 + ATP | 아르기니노석신산 + AMP + PPi | 아르기니노석신산 생성효소 (ASS) | 세포질 |
| 4 | 아르기니노석신산 | 아르기닌 + 푸마르산 | 아르기니노석신산 분해효소 (ASL) | 세포질 |
| 5 | 아르기닌 + H2O | 오르니틴 + 요소 | 아르기네이스, 망가니즈 (ARG1) | 세포질 |
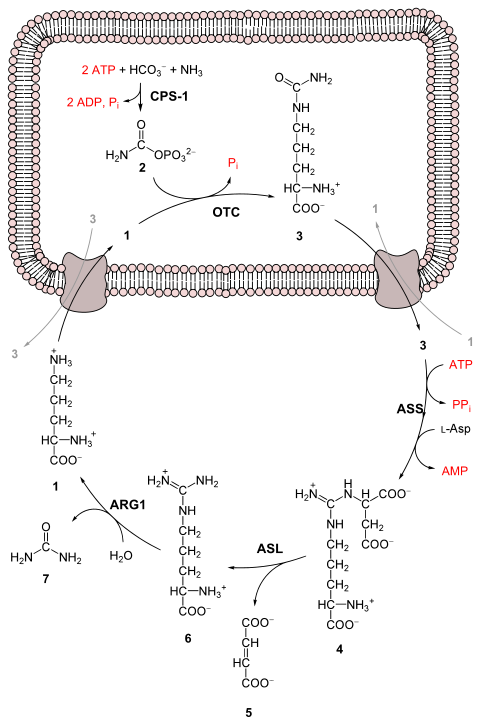 1 L-오르니틴 2 카바모일 인산 3 L-시트룰린 4 아르기니노석신산 5 푸마르산 6 L-아르기닌 7 요소 L-Asp L-아스파르트산 CPS-1 카바모일 인산 합성효소 I OTC 오르니틴 카바모일기전이효소 ASS 아르기니노석신산 생성효소 ASL 아르기니노석신산 분해효소 ARG1 아르기네이스 |
첫 번째 반응: 요소 회로로의 진입[편집]
요소 회로가 시작되기 전에 암모니아는 카바모일 인산으로 전환된다. 반응은 2개의 ATP 분자를 필요로 하는 카바모일 인산 합성효소 I에 의해 촉매된다.[1] 그런 다음 카바모일 인산이 요소 회로로 들어간다.
요소 회로의 단계[편집]
- 카바모일 인산은 시트룰린으로 전환된다. 오르니틴 카바모일기전이효소에 의한 촉매 작용으로 카바모일기는 오르니틴으로 공여되고 인산기는 방출된다.[1]
- 아스파르트산의 아미노기와 시트룰린의 카보닐기 사이에 축합 반응이 일어나 아르기니노석신산이 생성된다. 이 반응은 ATP 의존적이며 아르기니노석신산 생성효소에 의해 촉매된다.[1]
- 아르기니노석신산은 아르기니노석신산 분해효소에 의해 분해되어 아르기닌과 푸마르산을 생성한다.[1]
- 아르기닌은 아르기네이스에 의해 분해되어 요소와 오르니틴을 생성한다. 오르니틴은 다시 미토콘드리아로 운반되어 요소 회로를 다시 시작하는 데 사용된다.[1][4]
전체 반응식[편집]
첫 번째 반응에서 NH+
4 + HCO−
3는 NH3 + CO2 + H2O와 동일하다.
따라서 요소 회로의 전체 반응식은 다음과 같다.
푸마르산은 아스파르트산에서 NH3를 제거하고(반응 3과 4를 통해) PPi + H2O → 2 Pi를 제거하여 얻어지기 때문에 전체 반응식은 다음과 같이 단순화할 수 있다.
요소 회로와 관련된 반응도 2 NADH를 생성하므로 전체 반응은 소비하는 것보다 약간 더 많은 에너지를 방출한다. NADH는 다음과 같은 두 가지 방식으로 생성된다.
- 1분자의 NADH는 글루탐산을 암모늄 이온 및 α-케토글루타르산으로 전환하는 글루탐산 탈수소효소에 의해 생성된다. 글루탐산은 아미노기의 무독성 운반체이다. 이것은 카바모일 인산의 초기 합성에 사용되는 암모늄 이온을 제공한다.
- 세포질에서 방출된 푸마르산은 세포질의 푸마레이스에 의해 말산으로 수화된다. 이 말산은 세포질의 말산 탈수소효소에 의해 옥살로아세트산으로 산화되고, 세포질에서 환원된 NADH를 생성한다. 옥살로아세트산은 아미노기전이효소가 선호하는 케토산들 중 하나이기 때문에 질소가 요소 회로로 흐르도록 유지하면서 아스파르트산으로 재순환되도록 한다.
We can summarize this by combining the reactions:
- CO2 + 글루탐산 + 아스파르트산 + 3 ATP + 2 NAD++ 3 H2O → 요소 + α-케토글루타르산 + 옥살로아세트산 + 2 ADP + 2 Pi + AMP + PPi + 2 NADH
생성된 2분자의 NADH는 5 ATP(세포질의 NADH는 사람의 간세포에서 말산-아스파르트산 셔틀과 함께 2.5 ATP를 제공함)의 생성을 위한 에너지를 제공할 수 있으며, 이는 요소 회로에 대한 2개의 고에너지 인산 결합의 순생성이다. 그러나 세포질에서 포도당신생합성이 진행 중이면 후자의 환원 당량이 ATP를 생성하는 대신 글리세르알데하이드 3-인산 탈수소효소 단계의 역전을 유도하는 데 사용된다.
옥살로아세트산의 운명은 아미노기 전이반응을 통해 아스파르트산을 생성하거나 포도당신생합성의 기질인 포스포엔올피루브산으로 전환되는 것이다.
요소 회로의 생성물[편집]
위에서 언급했듯이 많은 척추동물들은 암모늄 이온이 신체를 손상시키지 않도록 요소 회로를 사용하여 암모늄 이온을 요소로 전환시킨다. 이것이 도움이 되기는 하지만 요소 회로의 다른 효과도 있다. 예를 들어 2분자의 ATP를 소모, 요소의 생성, H+의 생성, HCO−
3와 NH+
4를 결합하여 재생 가능한 형태로 만들고, 마지막으로 NH+
4를 소모하는 것이 있다.[6]
조절[편집]
N-아세틸글루탐산[편집]
카바모일 인산의 합성과 요소 회로는 카바모일 인산 합성효소 I을 알로스테릭하게 활성화시키는 N-아세틸글루탐산(NAcGlu)의 존재에 의존한다. N-아세틸글루탐산은 카바모일 인산 합성효소 I의 절대적인 활성화제이다.[7] N-아세틸글루탐산 생성효소(NAGS)에 의한 N-아세틸글루탐산의 합성은 N-아세틸글루탐산 생성효소의 알로스테릭 자극제인 아르기닌(Arg)과 아미노기 전이반응의 산물 및 N-아세틸글루탐산 생성효소의 기질 중 하나인 글루탐산(Glu)에 의해 자극되며, 이 둘은 유리 아미노산이 증가할 때 증가한다. 따라서 글루탐산은 N-아세틸글루탐산 생성효소의 기질일 뿐만 아니라 요소 회로에 대한 활성화제 역할도 한다.
기질 농도[편집]
요소 회로의 나머지 효소들은 기질의 농도에 의해 조절된다. 따라서 아르기네이스 이외의 요소 회로 효소의 유전적 결핍은 요소 생산의 현저한 감소를 초래하지 않는다. 만약에 요소 회로의 효소가 완전히 없으면 출생 직후에 사망한다. 오히려 결핍된 효소의 기질이 축적되어 결핍된 효소의 반응 속도를 정상으로 증가시킨다.
그러나 이례적인 기질의 축적에 비용이 드는 것은 아니다. 기질의 농도는 NH+
4로 회로를 거슬러 올라갈 때까지 상승하여 고암모니아혈증(NH+
4의 농도 상승)을 초래한다.
NH+
4 독성의 근본 원인은 완전히 밝혀지지는 않았지만 고농도의 NH+
4는 신경계, 특히 뇌에 엄청난 부담을 준다. 요소 회로 효소의 결핍 증상으로는 지적 장애와 무기력증 등이 있다. 이러한 NH+
4 제거 시스템은 α-케토글루타르산 및 글루탐산 풀을 감소시키는 글루탐산 탈수소효소 1(GLUD1) 및 글루타민 합성효소(GS)를 포함한다. α-케토글루타르산의 고갈은 시트르산 회로의 속도를 감소시키며, 글루탐산은 신경전달물질이자 또 다른 신경전달물질인 γ-아미노뷰티르산(GABA)의 전구체이다.[1](p.734)
시트르산 회로와 연결[편집]
요소 회로와 시트르산 회로는 각각 독립적인 회로이지만 서로 연결되어 있다. 요소 회로의 질소 원자 중 하나는 옥살로아세트산에서 아스파르트산으로의 아미노기 전이반응으로부터 얻는다.[8] 요소 회로의 3번째 단계에서 생성되는 푸마르산은 시트르산 회로의 대사 중간생성물이기도 하며, 시트르산 회로로 들어갈 수도 있다.[8]
요소 회로의 이상[편집]
요소 회로의 이상은 미국에서 35,000명 중에 1명 꼴로 발생하는 보기 드문 질환이다.[9] 요소 회로에 관여하는 효소에 유전적 결함이 일어날 수 있으며, 이는 일반적으로 출생 후 며칠 이내에 나타난다.[2] 요소 회로에 이상이 있는 아이는 일반적으로 다양한 구토와 무기력증을 보인다.[2] 궁극적으로 유아는 혼수상태에 빠지고 뇌손상이 일어날 수 있다.[2] 요소 회로에 이상이 있는 신생아는 시기가 적절하지 않은 선별검사와 오진된 사례로 인해 합병증이나 사망의 위험이 훨씬 더 높다. 가장 흔한 오진은 신생아 패혈증이다. 요소 회로 이상의 징후는 생후 2~3일 이내에 나타날 수 있지만 현재의 검사 결과로 확인하는 방법은 시간이 너무 오래 걸릴 수 있다.[10] 이것은 잠재적으로 혼수상태나 사망과 같은 합병증을 유발할 수 있다.[10]
요소 회로 이상은 성인에서도 진단될 수 있으며, 증상에는 섬망 에피소드, 무기력증 및 뇌졸중과 유사한 증상이 포함될 수 있다.[11] 이러한 증상에 더해 간에서 요소 회로가 오작동하기 시작하면 간경변으로 발전할 수 있다.[12] 이것은 또한 근감소증(근육량 소실)을 유발할 수 있다.[12] 돌연변이는 요소 회로에 관여하는 다양한 효소 및 수송체의 결핍을 초래하고 요소 회로의 이상을 유발한다.[1] 요소 회로에 사용되는 5가지 효소 중 어느 하나에 결함이 있는 사람이 최소 일일 요구량 이상으로 아미노산을 섭취하면 생성된 암모니아는 요소로 전환될 수 없다. 이러한 사람은 고암모니아혈증 또는 요소 회로 대사 중간생성물의 축적을 겪을 수 있다.
개별 이상[편집]
- N-아세틸글루탐산 생성효소 결핍증
- 카바모일 인산 합성효소 I 결핍증
- 오르니틴 카바모일기전이효소 결핍증
- 시트룰린혈증 (아르기니노석신산 생성효소의 결핍)
- 아르기니노석신산뇨증 (아르기니노석신산 분해효소의 결핍)
- 아르기닌혈증 (아르기네이스의 결핍)
- 고오르니틴혈증, 고암모니아혈증, 호모시트룰린뇨증 증후군 (미토콘드리아의 오르니틴 수송체의 결핍)[5][13]
오르니틴 카바모일기전이효소 결핍증을 제외한 모든 요소 회로의 결함은 상염색체 열성 유전 방식으로 유전된다. 오르니틴 카바모일기전이효소 결핍증은 X염색체 열성 유전 방식으로 유전되며, 일부 여성은 증상을 보일 수 있다. 대부분의 요소 회로 장애는 고암모니아혈증과 관련이 있지만, 아르지닌혈증 및 일부 형태의 아르기니노석신산뇨증은 암모니아의 상승을 나타내지 않는다.
추가 이미지[편집]
-
요소 회로
-
채색된 요소 회로
같이 보기[편집]
각주[편집]
- ↑ 가 나 다 라 마 바 사 아 자 Cox, Michael (2013년 1월 1일). 《Lehninger Principles of Biochemistry》. Freeman. ISBN 9781429234146. OCLC 901647690.
- ↑ 가 나 다 라 Tymoczko, John L.; Berg, Jeremy M.; Stryer, Lubert (2013). 《BIOCHEMISTRY A Short Course》. W.H. Freeman and Company, New York. 529쪽. ISBN 978-1-4292-8360-1.
- ↑ 가 나 Mew, Nicholas Ah; Pappa, Maria Belen; Gropman, Andrea L. (2015년 1월 1일), Rosenberg, Roger N.; Pascual, Juan M., 편집., “Chapter 57 - Urea Cycle Disorders”, 《Rosenberg's Molecular and Genetic Basis of Neurological and Psychiatric Disease (Fifth Edition)》 (영어) (Boston: Academic Press), 633–647쪽, doi:10.1016/b978-0-12-410529-4.00057-7, ISBN 978-0-12-410529-4, 2020년 11월 10일에 확인함
- ↑ 가 나 다 Walker, Valerie (2014년 1월 1일), Makowski, Gregory S., 편집., “Chapter Three - Ammonia Metabolism and Hyperammonemic Disorders”, 《Advances in Clinical Chemistry》 (영어) (Elsevier) 67: 73–150, doi:10.1016/bs.acc.2014.09.002, PMID 25735860, 2020년 11월 10일에 확인함
- ↑ 가 나 Pearl, Phillip L. (2017년 1월 1일), Swaiman, Kenneth F.; Ashwal, Stephen; Ferriero, Donna M.; Schor, Nina F., 편집., “76 - Inherited Metabolic Epilepsies”, 《Swaiman's Pediatric Neurology (Sixth Edition)》 (영어) (Elsevier), 594–599쪽, doi:10.1016/b978-0-323-37101-8.00076-x, ISBN 978-0-323-37101-8, 2020년 11월 10일에 확인함
- ↑ Atkinson, Daniel (1991년 9월 20일). “Functional Roles of Urea in Vertebrates”. 《Physiological Zoology》 2판 (Los Angeles: The University of Chicago Press) 65 (2): 243–267. doi:10.1086/physzool.65.2.30158252. JSTOR 30158252. S2CID 87121092.
- ↑ Kaplan Medical USMLE Step 1 Biochemistry and Medical Genetics Lecture Notes 2010, page 261
- ↑ 가 나 Shambaugh, G. E. (1977년 12월 1일). “Urea biosynthesis I. The urea cycle and relationships to the citric acid cycle”. 《The American Journal of Clinical Nutrition》 30 (12): 2083–2087. doi:10.1093/ajcn/30.12.2083. ISSN 0002-9165. PMID 337792.
- ↑ Summar, Marshall L.; Koelker, Stefan; Freedenberg, Debra; Le Mons, Cynthia; Haberle, Johannes; Lee, Hye-Seung; Kirmse, Brian (2013). “The incidence of urea cycle disorders”. 《Molecular Genetics and Metabolism》 110 (1–2): 179–180. doi:10.1016/j.ymgme.2013.07.008. ISSN 1096-7192. PMC 4364413. PMID 23972786.
- ↑ 가 나 Merritt, J. L.; Brody, L. L.; Pino, G.; Rinaldo, P. (2018). “Newborn screening for proximal urea cycle disorders: Current evidence supporting recommendations for newborn screening”. 《Molecular Genetics and Metabolism》 124 (2): 109–113. doi:10.1016/j.ymgme.2018.04.006. PMID 29703588. S2CID 13858458.
- ↑ Judd, Sandra (2010). 《Genetic Disorders Sourcebook》. Omnigraphics. 225쪽. ISBN 978-0-7808-1076-1.
- ↑ 가 나 Qiu, Jia (2013년 7월 9일). “Hyperammonemia in cirrhosis induces transcriptional regulation of myostatin by an NF-κB–mediated mechanism”. 《Proceedings of the National Academy of Sciences of the United States of America》 (National Academy of Sciences) 110 (45): 18162–18167. Bibcode:2013PNAS..11018162Q. doi:10.1073/pnas.1317049110. JSTOR 23754730. PMC 3831479. PMID 24145431.
- ↑ Smith, L. D.; Garg, U. (2017년 1월 1일), Garg, Uttam; Smith, Laurie D., 편집., “Chapter 5: Urea cycle and other disorders of hyperammonemia”, 《Biomarkers in Inborn Errors of Metabolism》 (영어) (San Diego: Elsevier), 103–123쪽, doi:10.1016/b978-0-12-802896-4.00004-3, ISBN 978-0-12-802896-4, 2020년 11월 10일에 확인함
외부 링크[편집]
- The chemical logic behind the urea cycle
- Basic Neurochemistry - amino acid disorders
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||