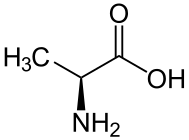
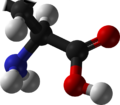
D-아미노산
D-아미노산(영어: D-amino acid)은 아미노기에 대한 입체중심 α 탄소가 D-입체배치를 가지고 있는 아미노산이다. 대부분의 자연적으로 생성되는 아미노산의 경우에 입체중심 α 탄소는 L-입체배치를 가지고 있다. D-아미노산은 자연에서 단백질에서의 잔기로 종종 발견된다. 이들은 리보솜에서 유래된 D-아미노산 잔기로부터 형성된다.[1]
펩타이드, 펩타이드 호르몬, 구조 단백질 및 면역 단백질의 구성 성분인 아미노산은 핵산, 탄수화물, 지질과 함께 모든 생명현상에 관여하는 중요한 생체분자이다. 환경에 존재하는 D-아미노산은 라세미화, 세균의 세포벽으로부터의 방출, 미생물의 생산과 같은 유기 과정으로부터 유래되는 것으로 생각된다.[2]
발견
[편집]D-아미노산의 발견은 1950년대에 있었다. 오클레어(Auclair)와 패튼(Patton)은 1950년에 곤충과 연체동물의 혈액에서 D-아미노산의 존재를 처음으로 보고했다.[3] 또한 D-아미노산은 다양한 포유류의 조직에서 확인되었다. 포유류에서 합성되는 D-아미노산의 두 가지 주요 종류로는 D-아스파르트산(D-Asp)과 D-세린(D-Ser)이 있다. D-아스파르트산은 척추동물과 무척추동물에 존재하며 신경계와 내분비계의 발생에 관여한다.[3] 많은 양의 D-세린은 뇌에서도 발견할 수 있으며, 여기서 중추신경계의 발생에 중요한 조절 역할을 하며, 학습, 기억 및 포유류의 행동과 밀접하게 관련되어 있다. 또한 많은 양의 D-세린이 사람의 소변에서 검출되었다. D-세린은 배설계에서 병원성 유전자 발현의 조절 역할을 한다.[3] 또한 D-아미노산은 일부 해양 무척추동물의 특정 조직에서도 발견되었으며, 삼투압 조절에 관여할 수 있다.[3] 그러나 D-아미노산이 바닷물로부터 흡수되는 것인지 아니면 생물체 내에서 합성되는 것인지는 아직 불분명하다. D-아미노산은 또한 식물에서 확인되었다.[3] 많은 D-아미노산은 식물의 생장을 억제하지만, 일부 식물들은 D-아미노산을 흡수 및 대사 또는 합성할 수 있다.[3]
구조 및 일반적인 특성
[편집]-
D-알라닌의 구조
-
L-알라닌의 구조
L-아미노산과 D-아미노산은 일반적으로 거울상 이성질체이다. 두 개의 입체중심을 가지고 있는 아미노산인 트레오닌과 아이소류신은 예외이다. 이 두 가지 특별한 경우를 제외하고 L-아미노산 및 D-아미노산은 많은 조건에서 동일한 특성(색, 용해도, 녹는점)을 갖는다. 그러나 생물학적 맥락에서 이러한 거울상 이성질체들은 매우 다르게 행동할 수 있다. 따라서 D-아미노산은 부분적으로 잘 소화되지 않기 때문에 영양가가 낮다.[4]
이들은 한쪽 끝에 카복실기를 가지고 있고 다른 쪽 끝에 곁사슬을 가지고 있다. 이들은 또한 거울상 이성질체의 반대쪽에 아미노기와 수소 원자를 가지고 있다. 이들은 또한 카이랄 탄소 중심을 가지고 있다. 이것이 분자가 다른 입체 이성질체로 존재할 수 있는 이유이며 라디칼기의 배향은 이러한 거울상 이성질체들에서만 다르다. 반면에 D-글리세르알데하이드는 카보닐기와 하이드록실기를 가지고 있으며 중심에 카이랄 탄소가 있다. 배향은 L-글리세르알데하이드와 다르다.
생성 및 사용
[편집]D-아미노산은 살아 있는 생물에서의 최소 구성 요소이지만 토양, 강, 호수, 바다, 눈과 얼음, 에어로졸 및 강수와 같은 광범위한 자연 환경에서 생성된다. 이들은 해양의 탄소 순환 및 에너지 순환에서 중요한 역할을 하고 해양 탄소 저장고의 탄소원으로 기여하는 여러 해양 미생물들에 의해 생성된다.[2]
D-아미노산 잔기는 청자고둥과 수컷 오리너구리의 독에서 생성된다.[5][6] D-아미노산은 또한 세균의 세포벽의 펩티도글리칸의 풍부한 구성 요소이며[7] D-세린은 뇌에서 신경전달물질로 작용할 수 있다.[8] D-아미노산은 단백질에 따라 보다 쉽고 강력한 단백질 구조 결정을 허용할 수 있는 중심대칭 결정을 생성하기 위해 라세미 결정법에서 사용된다.[9]
그라미시딘은 D-아미노산과 L-아미노산의 혼합물로 구성된 폴리펩타이드이다.[10] D-아미노산을 함유하고 있는 다른 화합물로는 티로시딘과 발리노마이신이 있다. 이들 화합물은 특히 그람음성세균에서 세균의 세포벽을 파괴한다. 2011년 기준[update]으로 스위스-프롯(Swiss-Prot) 데이터베이스에서 분석된 총 1억 8700만개의 아미노산들 중 D-아미노산은 837개만 발견되었다.[11]
형광 표지된 D-아미노산, 즉 형광성 D-아미노산(FDAA)은 그람양성세균 및 그람음성세균 모두에서 펩티도글리칸의 인시투(in situ) 표지에 사용되었다.[12][13]
세균과 D-아미노산
[편집]세균은 아마도 아미노산을 활용할 수 있는 가장 큰 능력을 지니고 있다. 세균은 10가지 이상의 D-아미노산을 합성하는 것으로 알려져 있으며, 가장 빈번하게 합성되는 D-아미노산은 세포벽의 펩티도글리칸에서의 가교 형성을 위한 D-알라닌과 D-글루탐산이다. 또한 세균에서 방출된 세포외 D-아미노산은 세균 세포벽의 리모델링을 제어하며, 세균 사이에서 자주 변화하는 환경을 수용하는 기능을 하는 것으로 생각된다. 세균 세포벽에서의 구조적 기능 외에도 D-아미노산은 생장 적합성과 생물막 발달, 포자 발아 및 신호 전달과 같은 추가적인 과정과도 관련이 있다.[2][3]
생합성
[편집]두 가지 효소가 L-아미노산을 D-아미노산으로 전환시킨다. 피리독살 인산(PLP) 의존성 효소인 D-아미노산 라세미화효소는 입체중심이 소실되는 α-아미노산의 형성을 통해 아미노산을 라세미화한다. L-아미노산 산화효소는 L-아미노산을 환원성 아미노화에 민감한 α-케토산으로 전환시킨다. 일부 아미노산은 라세미화되기 쉬운데, 한 예로 리신은 피페콜산의 형성을 통해 라세미화된다.
펩타이드에서 L-아미노산 작니느 천천히 라세미화되어 일부 D-아미노산 잔기가 형성된다. 라세미화는 아미도기의 α 탄소인 메틸기의 탈양성자화를 통해 일어난다. 반응 속도는 pH에 따라 증가한다.
고등 생물에서 발견되는 많은 D-아미노산은 미생물 공급원으로부터 유래한 것이다. 세균 세포벽을 구성하는 펩티도글리칸의 D-알라닌은 단백질가수분해효소의 공격으로부터 저항하도록 도움을 준다. 여러 항생제들, 예를 들어 바시트라신은 D-아미노산 잔기를 포함하고 있다.[4]
이전 연구들
[편집]남중국해의 2,000 m 깊이의 퇴적물에서 2012년에 분리된 심해 균주인 패오박터속(Phaeobacter)의 종인 JL2886의 전체 게놈의 염기 서열이 분석되었다. 또 다른 연구에서는 일본 사가미만에서 심해(수심 범위 800~1,500 m)에서 채집된 56개의 퇴적물에서 28종의 D-아미노산을 이용하는 생물들이 분리되었다.[2] D-아미노산으로 인해 더 건강하게 생장하는 미생물을 분리하려는 독립적인 시도도 수행되었다. 대부분의 수행된 연구 및 실험은 일반적으로 D-알라닌, D-아스파르트산 및 D-글루탐산을 주로 사용하는 데, 이는 살아 있는 생물에서 발견되는 가장 일반적인 D-아미노산이기 때문이다. 게다가 D-아미노산은 바다와 관련된 많은 기본적인 과정을 위한 질소 공급원으로서 도움을 준다.[2]
같이 보기
[편집]각주
[편집]- ↑ Genchi G (September 2017). “An overview on D-amino acids”. 《Amino Acids》 49 (9): 1521–1533. doi:10.1007/s00726-017-2459-5. PMID 28681245. S2CID 3998765.
- ↑ 가 나 다 라 마 Naganuma, Takeshi; Iinuma, Yoshiakira; Nishiwaki, Hitomi; Murase, Ryota; Masaki, Kazuo; Nakai, Ryosuke (2018). “Enhanced Bacterial Growth and Gene Expression of D-Amino Acid Dehydrogenase With D-Glutamate as the Sole Carbon Source”. 《Frontiers in Microbiology》 9: 2097. doi:10.3389/fmicb.2018.02097. ISSN 1664-302X. PMC 6131576. PMID 30233558.
- ↑ 가 나 다 라 마 바 사 Zhang, ZiLian; Zheng, Qiang; Jiao, NianZhi (2016년 1월 1일). “Microbial D-amino acids and marine carbon storage”. 《Science China Earth Sciences》 (영어) 59 (1): 17–24. Bibcode:2016ScChD..59...17Z. doi:10.1007/s11430-015-5155-x. ISSN 1869-1897. S2CID 87038507.
- ↑ 가 나 Friedman M (September 1999). “Chemistry, nutrition, and microbiology of D-amino acids”. 《Journal of Agricultural and Food Chemistry》 47 (9): 3457–79. doi:10.1021/jf990080u. PMID 10552672.
- ↑ Torres, A. M.; Menz, I.; Alewood, P. F.; Bansal, P.; Lahnstein, J.; Gallagher, C. H.; Kuchel, P. W. (2002). “D-Amino acid residue in the C-type natriuretic peptide from the venom of the mammal, Ornithorhynchus anatinus, the Australian platypus”. 《FEBS Letters》 524 (1–3): 172–6. doi:10.1016/S0014-5793(02)03050-8. PMID 12135762.
- ↑ Pisarewicz K, Mora D, Pflueger FC, Fields GB, Marí F (May 2005). “Polypeptide chains containing D-gamma-hydroxyvaline”. 《Journal of the American Chemical Society》 127 (17): 6207–15. doi:10.1021/ja050088m. PMID 15853325.
- ↑ van Heijenoort J (March 2001). “Formation of the glycan chains in the synthesis of bacterial peptidoglycan”. 《Glycobiology》 11 (3): 25R–36R. doi:10.1093/glycob/11.3.25R. PMID 11320055. S2CID 46066256.
- ↑ Wolosker H, Dumin E, Balan L, Foltyn VN (July 2008). “D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration”. 《The FEBS Journal》 275 (14): 3514–26. doi:10.1111/j.1742-4658.2008.06515.x. PMID 18564180. S2CID 25735605.
- ↑ Matthews BW (June 2009). “Racemic crystallography--easy crystals and easy structures: what's not to like?”. 《Protein Science》 18 (6): 1135–8. doi:10.1002/pro.125. PMC 2774423. PMID 19472321.
- ↑ Ketchem RR, Hu W, Cross TA (September 1993). “High-resolution conformation of gramicidin A in a lipid bilayer by solid-state NMR”. 《Science》 261 (5127): 1457–60. Bibcode:1993Sci...261.1457K. doi:10.1126/science.7690158. PMID 7690158.
- ↑ Khoury GA, Baliban RC, Floudas CA (September 2011). “Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database”. 《Scientific Reports》 1 (90): 90. Bibcode:2011NatSR...1E..90K. doi:10.1038/srep00090. PMC 3201773. PMID 22034591.
- ↑ Kuru E, Hughes HV, Brown PJ, Hall E, Tekkam S, Cava F, 외. (December 2012). “In Situ probing of newly synthesized peptidoglycan in live bacteria with fluorescent D-amino acids”. 《Angewandte Chemie》 51 (50): 12519–23. doi:10.1002/anie.201206749. PMC 3589519. PMID 23055266.
- ↑ Hsu YP, Rittichier J, Kuru E, Yablonowski J, Pasciak E, Tekkam S, 외. (September 2017). “Full color palette of fluorescent d-amino acids for in situ labeling of bacterial cell walls”. 《Chemical Science》 8 (9): 6313–6321. doi:10.1039/C7SC01800B. PMC 5628581. PMID 28989665.