방향족 아미노산


방향족 아미노산(영어: aromatic amino acid, AAA)[1]은 방향족 고리를 가지고 있는 아미노산이다. 20가지의 표준 아미노산들 중 페닐알라닌, 트립토판, 티로신이 방향족 아미노산으로 분류된다. 하지만 티로신은 방향족 아미노산으로 분류될 수도 있고, 극성 아미노산으로도 분류될 수 있다. 또한 히스티딘은 방향족 고리를 포함하고 있지만, 그 기본적인 특성으로 인해 주로 극성 아미노산으로 분류된다. 그러나 히스티딘 자체는 방향족 화합물이다.
화학 구조 및 특성[편집]
방향족 아미노산은 250 nm 이상의 파장에서 자외선을 흡수하여 형광을 생성한다. 이러한 특성은 정량 분석, 특히 용액에서 이들 아미노산의 농도를 결정하는 데 사용된다.[2] 이는 자외선 가시광선 분광법 및 비어-람베르트 법칙을 이용하여 구할 수 있다.[3] 대부분의 단백질은 1차 구조에 방향족 아미노산이 존재하기 때문에 약 280 nm에서 최대 흡광도를 갖는다. 그러나 여러 종류의 방향족 아미노산이 존재하기 때문에 이러한 방법은 정확도가 낮다. 이러한 문제를 해결하기 위해서는 단백질 시료가 순수하게 정제되어야 하며 몰 흡수율을 알고 있어야 한다. 방향족 아미노산을 가지고 있지 않은 단백질은 약 280 nm에서 최대 흡광도를 가지지 않는다. 단백질에 핵산이 존재하는 경우 약 260 nm에서 최대 흡광도를 가지는 퓨린 및 피리미딘 고리의 존재로 인해 방법의 정확도를 더욱 떨어뜨릴 수 있다. 페닐알라닌은 다른 표준 방향족 아미노산에 비해 상대적으로 낮은 흡광도를 가지고 있다. 단백질에서 페닐알라닌의 존재는 트립토판과 티로신이 존재하지 않는 경우에만 검출될 수 있다.[4] 페닐알라닌의 최대 흡수는 257 nm에서 일어난다.[4] 결과적으로 형광이 비교적 약하다. 트립토판은 다른 표준 방향족 아미노산에 비해 상대적으로 가장 높은 흡광도를 가지고 있다. 트립토판의 최대 흡수는 280 nm에서 일어난다.[4] 트립토판의 곁사슬은 적정하지 않는다. 티로신의 최대 흡수는 274 nm에서 일어난다.[4] 화학 반응에서 티로신은 친핵체로 작용할 수 있다.[5] 방향족 아미노산은 또한 글리칸-단백질 상호작용에서 중요한 역할을 한다.

생화학에서 생성 및 기능[편집]
생합성 경로[편집]
시킴산 경로[편집]
식물에서 시킴산 경로는 먼저 페닐알라닌, 티로신, 트립토판의 전구물질인 코리슴산의 형성으로 이어진다. 이러한 방향족 아미노산은 많은 2차 대사산물의 유도체로 살리실산 및 옥신과 같이 호르몬으로 작용하며 모두 식물의 생리학적 기능에 필수적이다. 시킴산 경로에는 코리슴산의 생성과 궁극적으로 생물체의 생물학적 기능을 중단시킬 수 있는 저해제에 의해 조절될 수 있는 효소가 포함되어 있다. 제초제와 항생제는 방향족 아미노산의 생합성에 관여하는 이러한 효소들을 저해하여, 식물에게 독성을 나타낸다.[6] 제초제의 일종인 글리포세이트는 과도한 녹색의 축적을 조절하는 데 사용된다. 이 외에도 글리포세이트는 필수 방향족 아미노산의 생합성에 관여하는 5-엔올피루빌시킴산-3-인산 생성효소를 특이적으로 저해함으로써 숙주 생물의 장내 미생물총의 유지에 쉽게 영향을 미칠 수 있다. 이 효소의 저해는 위장 질환 및 대사 질환과 같은 이상을 초래한다.[7]
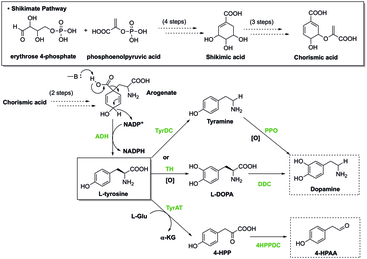
전구물질로서의 방향족 아미노산[편집]
방향족 아미노산은 종종 다른 화합물을 합성하기 위한 전구물질로 작용한다. 예를 들어 에피네프린 생성 과정에서 페닐알라닌은 시작 분자이다. 반응은 다음과 같다.
또한 티로신은 수 많은 생물에서 옥토파민과 멜라닌의 합성을 위한 전구물질이다.[8] 티록신의 생성 과정에서 페닐알라닌은 초기 전구체로 역할을 한다.
- 페닐알라닌 → 티로신 → 티록신
세로토닌의 생성 과정에서 트립토판은 다음과 같이 시작 분자로 작용한다.
- 트립토판 → 5-하이드록시트립토판 → 세로토닌
또한 히스티딘은 히스타민의 전구물질이다. 트립토판은 트립타민, 세로토닌, 옥신, 키뉴레닌, 멜라토닌 합성의 시작 분자이다.[8]
영양적 요구[편집]
동물은 음식물을 통해 방향족 아미노산을 얻지만, 모든 식물과 미생물은 대사적으로 비용이 많이 드는 시킴산 경로를 통해 방향족 아미노산을 합성해야 한다. 페닐알라닌, 트립토판, 히스티딘은 동물의 필수 아미노산이다. 이들 아미노산은 인체 내에서 합성되지 않기 때문에 음식물을 통해 섭취해야 한다. 티로신은 반필수적인데, 동물에 의해 합성될 수 있지만 페닐알라닌으로부터만 합성될 수 있다. 페닐알라닌을 분해하지 못하는 유전 질환인 페닐케톤뇨증은 페닐알라닌 하이드록실화효소가 결핍되었기 때문에 발병한다. 트립토판이 부족하면 골격 발달이 지연될 수 있다.[9] 정상적인 단백질 섭취를 넘어서서 방향족 아미노산을 과도하게 섭취하면 고혈압으로 이어질 수 있으며,[10] 이는 건강한 사람에서는 오랫동안 눈에 띄지 않을 수 있다. 이는 모노아민 산화효소를 다양한 수준으로 저해하는 다양한 허브 및 초콜릿과 같은 식품의 섭취와 일부 약물과 같은 다양한 요인에 의해 일어날 수 있다. 티라민과 같은 방향족 미량 아민은 말초 모노아민 소포에서 노르에피네프린을 대체할 수 있으며, 모노아민 산화효소 저해제를 복용하는 사람에게 이는 생명을 위협할 정도까지 일어날 수 있다. 파란 기저귀 증후군은 트립토판이 장 내에서 불완전하게 분해되어, 파란색 소변이 나오는 것으로 상염색체 열성 유전 질환이다.
같이 보기[편집]
각주[편집]
- ↑ Logan, Carolynn M.; Rice, M. Katherine (1987). 《Logan's Medical and Scientific Abbreviations》. Philadelphia: J. B. Lippincott Company. 3쪽. ISBN 978-0-397-54589-6.
- ↑ Möller, Matías; Denicola, Ana (2002년 5월 1일). “Protein tryptophan accessibility studied by fluorescence quenching”. 《Biochemistry and Molecular Biology Education》 (영어) 30 (3): 175–178. doi:10.1002/bmb.2002.494030030035. ISSN 1539-3429. S2CID 42862291.
- ↑ Schmid, Franz-Xaver (April 2001). “Biological Macromolecules: UV‐visible Spectrophotometry” (PDF). 《Encyclopedia of Life Sciences (ELS)》 (Chichester: John Wiley & Sons Ltd). doi:10.1038/npg.els.0003142. ISBN 0470016175. 2021년 3월 17일에 원본 문서 (PDF)에서 보존된 문서. 2021년 4월 2일에 확인함.
- ↑ 가 나 다 라 “Peptide and Amino Acid Quantification Using UV Fluorescence in Synergy HT Multi-Mode Microplate Reader | April 18, 2003”. 《www.biotek.com》. 2020년 3월 23일에 확인함.
- ↑ Parthasarathy A, Cross PJ, Dobson RC, Adams LE, Savka MA, Hudson AO (2018). “A Three-Ring Circus: Metabolism of the Three Proteogenic Aromatic Amino Acids and Their Role in the Health of Plants and Animals”. 《Frontiers in Molecular Biosciences》 (영어) 5: 29. doi:10.3389/fmolb.2018.00029. PMC 5897657. PMID 29682508.
- ↑ Tzin V, Galili G (2010년 5월 17일). “The Biosynthetic Pathways for Shikimate and Aromatic Amino Acids in Arabidopsis thaliana”. 《The Arabidopsis Book》 8: e0132. doi:10.1199/tab.0132. PMC 3244902. PMID 22303258.
- ↑ Nielsen LN, Roager HM, Casas ME, Frandsen HL, Gosewinkel U, Bester K, 외. (February 2018). “Glyphosate has limited short-term effects on commensal bacterial community composition in the gut environment due to sufficient aromatic amino acid levels”. 《Environmental Pollution》 233: 364–376. doi:10.1016/j.envpol.2017.10.016. PMID 29096310.
- ↑ 가 나 Han Q, Phillips RS, Li J (2019년 4월 10일). “Editorial: Aromatic Amino Acid Metabolism”. 《Frontiers in Molecular Biosciences》 6: 22. doi:10.3389/fmolb.2019.00022. PMC 6468166. PMID 31024928.
- ↑ Moehn S, Pencharz PB, Ball RO (December 2012). “Lessons learned regarding symptoms of tryptophan deficiency and excess from animal requirement studies”. 《The Journal of Nutrition》 142 (12): 2231S–2235S. doi:10.3945/jn.112.159061. PMID 23077198.
- ↑ Teymoori F, Asghari G, Mirmiran P, Azizi F (January 2018). “High dietary intake of aromatic amino acids increases risk of hypertension”. 《Journal of the American Society of Hypertension》 12 (1): 25–33. doi:10.1016/j.jash.2017.11.004. PMID 29208471.
더 읽을거리[편집]
- Maeda H, Dudareva N (2012). “The shikimate pathway and aromatic amino Acid biosynthesis in plants”. 《Annual Review of Plant Biology》 63: 73–105. doi:10.1146/annurev-arplant-042811-105439. PMID 22554242.
- “Tyrosine hydroxylase deficiency”. 《Genetics Home Reference》. U.S. National Library of Medicine. 2020.
외부 링크[편집]
 위키미디어 공용에 방향족 아미노산 관련 미디어 분류가 있습니다.
위키미디어 공용에 방향족 아미노산 관련 미디어 분류가 있습니다.- 의학주제표목 (MeSH)의 Aromatic+Amino+Acids