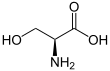
세린
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
serine
| |||
| 별칭
2-amino-3-hydroxypropanoic acid
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider | |||
| DrugBank |
| ||
| ECHA InfoCard | 100.000.250 | ||
| EC 번호 |
| ||
| |||
| KEGG | |||
PubChem CID
|
|||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질[2] | |||
| C3H7NO3 | |||
| 몰 질량 | 105.093 g·mol−1 | ||
| 겉보기 | 흰색 결정 또는 분말 | ||
| 밀도 | 1.603 g/cm3 (22 °C) | ||
| 녹는점 | 246 °C (475 °F; 519 K) 분해 | ||
| 용해됨 | |||
| 산성도 (pKa) | 2.21 (카복실기), 9.15 (아미노기)[1] | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
세린(영어: serine) (기호: Ser 또는 S)[3][4]은 단백질의 생합성에 사용되는 α-아미노산이다. 세린은 α-아미노기(생물학적 조건에서 양성자화된 −NH3+ 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 곁사슬인 하이드록시메틸기를 포함하고 있다. 세린은 극성 비전하 아미노산으로 분류된다. 세린은 비필수 아미노산으로 인체에서 합성될 수 있다. 세린은 UCU, UCC, UCA, UCG, AGU, AGC 코돈에 의해 암호화되어 있다.
생성[편집]
 |
세린은 자연적으로 생성되는 단백질생성성 아미노산들 중 하나이다. L-세린만 단백질에 자연적으로 존재한다. 세린은 다른 비필수 아미노산과 마찬가지로 다른 대사산물로부터 체내에서 합성되기 때문에 사람의 식단에 필수적이지 않다. 세린은 1865년에 에밀 크래머(Emil Cramer)에 의해 특히 풍부한 공급원인 실크 단백질로부터 처음으로 추출되었다.[5] 세린이란 이름은 비단(silk)을 의미하는 라틴어인 "sericum"으로부터 유래하였다. 세린의 구조는 1902년에 밝혀졌다.[6][7] 단백질 중 L-세린의 함량이 높은 식품 공급원으로는 계란, 완두, 양고기, 간, 돼지고기, 연어, 정어리, 해조류, 두부가 있다.[8][9]
생합성[편집]
세린의 생합성은 포스포글리세르산 탈수소효소(EC 1.1.1.95)에 의해 3-포스포글리세르산(해당과정의 대사 중간생성물)이 3-포스포하이드록시피루브산과 NADH로 산화되는 것으로 시작된다. 포스포세린 아미노기전이효소(EC 2.6.1.52)에 의한 이 케톤의 환원적 아미노화(아미노기 전이반응)은 포스포세린 인산가수분해효소(EC 3.1.3.3)에 의해 세린으로 가수분해되는 3-포스포세린(O-포스포세린)을 생성한다.[10][11]
대장균과 같은 세균에서 이들 효소는 serA (EC 1.1.1.95), serC (EC 2.6.1.52), serB (EC 3.1.3.3) 유전자에 의해 암호화된다.[12]
 |
글리신의 생합성: 세린 하이드록시메틸기전이효소는 또한 L-세린에서 글리신으로의 가역적 전환(레트로-알돌 절단) 및 5,6,7,8-테트라하이드로폴산에서 5,10-메틸렌테트라하이드로폴산(mTHF)로의 가역적 전환(가수분해)를 촉매한다.[13] 세린 하이드록시메틸기전이효소는 피리독살 인산(PLP) 의존성 효소이다. 글리신은 또한 글리신 생성효소에 의해 촉매되는 반응에서 CO2, NH+
4, 및 5,10-메틸렌테트라하이드로폴산(mTHF)으로부터 형성될 수 있다.[10]
합성 및 산업적 생산[편집]
산업적으로 L-세린은 하이드록시메틸기전이효소에 의해 글리신과 메탄올로부터 생성된다.[14]
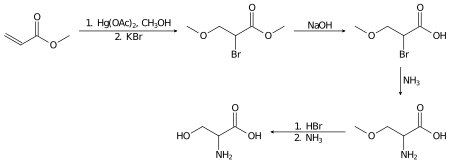
라세미 세린은 여러 단계를 거쳐 아크릴산 메틸로부터 실험실에서 제조할 수 있다.[15]
 |
생물학적 기능[편집]
물질대사[편집]
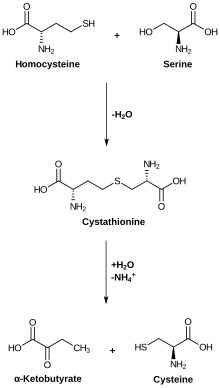
세린은 퓨린과 피리미딘의 생합성에 참여한다는 점에서 물질대사에 중요하다. 세린은 세균의 트립토판 뿐만 아니라 글리신과 시스테인을 포함한 여러 아미노산들의 전구체이다. 세린은 또한 생합성에서 탄소 원자 1개로 구성된 단편의 주요 공여체인 스핑고지질과 폴산을 비롯한 수많은 다른 대사산물들의 전구체이다.
신호전달[편집]
세린 라세미화효소에 의해 뉴런에서 L-세린으로부터 합성된 D-세린(L-세린의 거울상 이성질체) NMDA 수용체를 공동 활성화함으로써 신경조절물질로 역할을 하여 NMDA 수용체가 글루탐산과 결합할 경우 열릴 수 있도록 한다. D-세린은 NMDA 수용체의 글리신 부위(NR1)에서의 강력한 작용제이다. 수용체가 열리려면 글루탐산 및 글리신 또는 D-세린이 결합해야 한다. 또한 구멍 차단제는 결합되지 않아야 한다(예: Mg2+ or Zn2+).[16] 사실, D-세린은 글리신 자체보다 NMDA 수용체의 글리신 부위에 더 강력한 작용제이다.[17][18]
D-세린은 비교적 최근까지 세균에만 존재하는 것으로 생각되었다. D-세린은 사람의 뇌에서 신호 분자로 역할을 하는 D-아스파르트산이 발견된 직후, 사람에서 자연적으로 존재하는 것으로 발견된 두 번째 D-아미노산이다. 사람에서 D-아미노산이 더 빨리 발견되었다면, NMDA 수용체의 글리신 부위는 D-세린 부위로 명명되었을 것이다.[19] 중추신경계 외에도 D-세린은 연골,[20] 콩팥,[21] 해면체[22]와 같은 말초 조직 및 기관에서 신호전달 역할을 한다.
미각[편집]
순수한 D-세린은 매우 희미하게 퀴퀴한 향이 나는 회백색의 결정성 분말이다. D-세린은 중간 농도와 고농도에서 약간 신맛이 더해진 단맛을 낸다.[23]
임상적 중요성[편집]
세린 결핍 장애는 아미노산 L-세린의 생합성에서 드문 결함이다. 현재 다음과 같은 3가지 장애가 보고되었다.
- 3-포스포글리세르산 탈수소효소 결핍증
- 3-포스포세린 인산가수분해효소 결핍증
- 포스포세린 아미노기전이효소 결핍증
이러한 효소 결핍은 선천성 소두증 및 중증 정신운동 지체와 같은 심각한 신경학적 증상을 유발하며, 또한 3-포스포글리세르산 탈수소효소 결핍증이 있는 환자에서 난치성 발작을 유발한다. 이러한 증상은 L-세린(때로는 글리신과 병용) 치료에 다양한 정도로 반응한다.[24][25] 치료에 대한 반응은 다양하며 장기적인 기능적 결과는 알려져 있지 않다. 역학, 유전자형/표현형의 상관관계 및 이러한 질병이 환자의 삶의 질에 미치는 영향에 대한 이해를 개선하고 진단 및 치료 전략을 평가하기 위한 기반을 제공하기 위해 비상업적 단체인 신경전달물질 관련 장애에 관한 국제 실무 그룹(iNTD)에 의해 환자 등록부가 만들어졌다.[26]
세린 생합성의 중단 외에도 이의 수송도 중단될 수 있다. 한 가지 예는 경직성 사지마비, 얇은 뇌량, 그리고 중성 아미노산 수송체 A의 기능에 영향을 미치는 돌연변이로 인한 질병인 진행성 소두증이다.
치료용 연구[편집]
사람과 같은 척추동물이 L-세린을 평생 동안 최적의 양으로 합성할 수 없기 때문에 L-세린을 비필수 아미노산으로 분류하는 것은 조건부로 간주하게 되었다.[27] L-세린의 안전성은 근위축성 측삭경화증(ALS)환자(ClinicalTrials.gov 식별자: NCT01835782)[28][29]를 대상으로 한 FDA가 승인한 사람 대상의 1상 임상 시험에서 입증되었지만 근위축성 측삭경화증 증상의 치료는 아직 입증되지 않았다. 2011년의 메타 분석에 따르면 보조 사르코신은 조현병의 음성 및 전체 증상에 대해 중간 효과 크기를 갖는 것으로 나타났다.[30] L-세린이 당뇨병에서 치료 역할을 할 수 있다는 증거도 있다.[31]
D-세린은 조현병의 잠재적 치료제로 설치류에서 연구되고 있다.[32] D-세린은 또한 알츠하이머병의 가능성이 있는 환자의 뇌척수액에서 상대적으로 높은 농도로 인해 초기 알츠하이머병의 진단을 위한 잠재적인 바이오마커로 설명되었다.[33]
D-세린은 청각 상실 및 이명과 같은 감각신경성 청각 장애에 대한 잠재적 치료법으로 이론화되었다.[34]
같이 보기[편집]
- 아이소세린
- 호모세린 (아이소트레오닌)
- 세린 옥타머 클러스터
각주[편집]
- ↑ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ Weast, Robert C., 편집. (1981). 《CRC Handbook of Chemistry and Physics》 62판. Boca Raton, FL: CRC Press. C-512쪽. ISBN 0-8493-0462-8.
- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ “Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)”, 《Pure Appl. Chem.》 56 (5), 1984: 595–624, doi:10.1351/pac198456050595.
- ↑ Cramer, Emil (1865). “Ueber die Bestandtheile der Seide” [On the constituents of silk]. 《Journal für praktische Chemie》 (독일어) 96: 76–98. Serine is named on p. 93: "Ich werde den in Frage stehenden Körper unter dem Namen Serin beschreiben." (I will describe the body [i.e., substance] in question by the name "serine".)
- ↑ Fischer, Emil; Leuchs, Hermann (1902). “Synthese des Serins, der l-Glucosaminsäure und anderer Oxyaminosäuren” [Synthesis of serine, of l-glucosaminic acid, and other oxyamino acids]. 《Berichte der Deutschen Chemischen Gesellschaft》 (독일어) 35 (3): 3787–3805. doi:10.1002/cber.190203503213.
- ↑ 〈Serine〉. 《The Columbia Encyclopedia 6th ed.》. encyclopedia.com. 2012년 10월 22일에 확인함.
- ↑ Brain Chemistry Labs web site
- ↑ Self Nutrition Data web site
- ↑ 가 나 Stryer, Lubert (1988). 《Biochemistry》 3판. New York: W.H. Freeman. 580쪽. ISBN 978-0-7167-1843-7.
- ↑ KEGG EC 3.1.3.3 etc.
- ↑ Uniprot: serB
- ↑ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2000). 《Principles of Biochemistry》 3판. New York: W. H. Freeman. ISBN 1-57259-153-6.
- ↑ Karlheinz Drauz, Ian Grayson, Axel Kleemann, Hans-Peter Krimmer, Wolfgang Leuchtenberger, Christoph Weckbecker (2006), 《울만 공업화학 백과사전(Ullmann's Encyclopedia of Industrial Chemistry)》, Weinheim: Wiley-VCH, doi:10.1002/14356007.a02_057.pub2
- ↑ Carter, Herbert E.; West, Harold D. (1940). “dl-Serine”. 《Organic Syntheses》 20: 81. doi:10.15227/orgsyn.020.0081.
- ↑ Liu Y, Hill RH, Arhem P, von Euler G (2001). “NMDA and glycine regulate the affinity of the Mg2+-block site in NR1-1a/NR2A NMDA receptor channels expressed in Xenopus oocytes”. 《Life Sciences》 68 (16): 1817–1826. doi:10.1016/S0024-3205(01)00975-4. PMID 11292060.
- ↑ MacKay, Mary-Anne B.; Kravtsenyuk, Maryana; Thomas, Rejish; Mitchell, Nicholas D.; Dursun, Serdar M.; Baker, Glen B. (2019년 2월 6일). “D-Serine: Potential Therapeutic Agent and/or Biomarker in Schizophrenia and Depression?”. 《Frontiers in Psychiatry》 10: 25. doi:10.3389/fpsyt.2019.00025. ISSN 1664-0640. PMC 6372501. PMID 30787885.
D-Serine is more potent than glycine as a coagonist at the NMDA receptor, has a regional distribution in the brain that is similar to that of NMDA receptors and appears to be more closely associated with synaptic NMDA receptors than glycine (which is more closely associated with non-synaptic NMDA receptors).
- ↑ Wolosker, Herman; Balu, Darrick T. (2020년 6월 9일). “D-Serine as the gatekeeper of NMDA receptor activity: implications for the pharmacologic management of anxiety disorders”. 《Translational Psychiatry》 10 (1): 184. doi:10.1038/s41398-020-00870-x. ISSN 2158-3188. PMC 7283225. PMID 32518273.
D-Serine is functionally a more potent activator of synaptic NMDARs than glycine, and mounting evidence suggests that it serves as the major NMDAR co-agonist in limbic brain regions implicated in neuropsychiatric disorders.
- ↑ Mothet JP, Parent AT, Wolosker H, Brady RO, Linden DJ, Ferris CD, Rogawski MA, Snyder SH (Apr 2000). “D-Serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor”. 《Proceedings of the National Academy of Sciences of the United States of America》 97 (9): 4926–4931. Bibcode:2000PNAS...97.4926M. doi:10.1073/pnas.97.9.4926. PMC 18334. PMID 10781100.
- ↑ Takarada T, Hinoi E, Takahata Y, Yoneda Y (May 2008). “Serine racemase suppresses chondrogenic differentiation in cartilage in a Sox9-dependent manner”. 《Journal of Cellular Physiology》 215 (2): 320–328. doi:10.1002/jcp.21310. PMID 17929246. S2CID 45669104.
- ↑ Ma MC, Huang HS, Chen YS, Lee SH (Nov 2008). “Mechanosensitive N-methyl-D-aspartate receptors contribute to sensory activation in the rat renal pelvis”. 《Hypertension》 52 (5): 938–944. doi:10.1161/HYPERTENSIONAHA.108.114116. PMID 18809793.
- ↑ Ghasemi M, Rezania F, Lewin J, Moore KP, Mani AR (Jun 2010). “D-Serine modulates neurogenic relaxation in rat corpus cavernosum”. 《Biochemical Pharmacology》 79 (12): 1791–1796. doi:10.1016/j.bcp.2010.02.007. PMID 20170643.
- ↑ Kawai M, Sekine-Hayakawa Y, Okiyama A, Ninomiya Y (Dec 2012). “Gustatory sensation of L- and D-amino acids in humans”. 《Amino Acids》 43 (6): 2349–2358. doi:10.1007/s00726-012-1315-x. PMID 22588481. S2CID 17671611.
- ↑ de Koning TJ (April 2006). “Treatment with amino acids in serine deficiency disorders”. 《Journal of Inherited Metabolic Disease》 29 (2): 347–351. doi:10.1007/s10545-006-0269-0. PMID 16763900. S2CID 25013468.
- ↑ Tabatabaie L; Klomp LW; Berger R; de Koning TJ (March 2010). “L-Serine synthesis in the central nervous system: a review on serine deficiency disorders”. 《Mol Genet Metab》 99 (3): 256–262. doi:10.1016/j.ymgme.2009.10.012. PMID 19963421.
- ↑ “Patient registry”.
- ↑ Metcalf, J. S.; Dunlop, R. A.; Powell, J. T.; Banack, S. A.; Cox, P. A. (2017). “L-Serine: a Naturally-Occurring Amino Acid with Therapeutic Potential”. 《Neurotoxicity Research》 33 (1): 213–221. doi:10.1007/s12640-017-9814-x. ISSN 1029-8428. PMID 28929385. S2CID 20271849.
- ↑ Dunlop RA, Cox PA, Banack SA, Rodgers KJ (2013). “The non-protein amino acid BMAA is misincorporated into human proteins in place of L-serine causing protein misfolding and aggregation”. 《PLOS ONE》 8 (9): e75376. Bibcode:2013PLoSO...875376D. doi:10.1371/journal.pone.0075376. PMC 3783393. PMID 24086518.
- ↑ Levine, Todd D.; Miller, Robert G.; Bradley, Walter G.; Moore, Dan H.; Saperstein, David S.; Flynn, Lynne E.; Katz, Jonathan S.; Forshew, Dallas A.; Metcalf, James S.; Banack, Sandra A.; Cox, Paul A. (2017년 1월 2일). “Phase I clinical trial of safety of L-serine for ALS patients”. 《Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration》 (영어) 18 (1–2): 107–111. doi:10.1080/21678421.2016.1221971. ISSN 2167-8421. PMID 27589995. S2CID 4584977.
- ↑ Singh SP, Singh V (Oct 2011). “Meta-analysis of the efficacy of adjunctive NMDA receptor modulators in chronic schizophrenia”. 《CNS Drugs》 25 (10): 859–885. doi:10.2165/11586650-000000000-00000. PMID 21936588. S2CID 207299820.
- ↑ Holm, Laurits J.; Buschard, Karsten (2019). “L‐serine: a neglected amino acid with a potential therapeutic role in diabetes”. 《APMIS》 127 (10): 655–659. doi:10.1111/apm.12987. ISSN 0903-4641. PMC 6851881. PMID 31344283.
- ↑ Balu DT, Li Y, Puhl MD, Benneyworth MA, Basu AC, Takagi S, Bolshakov VY, Coyle JT (Jun 2013). “Multiple risk pathways for schizophrenia converge in serine racemase knockout mice, a mouse model of NMDA receptor hypofunction”. 《Proceedings of the National Academy of Sciences of the United States of America》 110 (26): E2400–E2409. Bibcode:2013PNAS..110E2400B. doi:10.1073/pnas.1304308110. PMC 3696825. PMID 23729812.
- ↑ Madeira C, Lourenco MV, Vargas-Lopes C, Suemoto CK, Brandão CO, Reis T, Leite RE, Laks J, Jacob-Filho W, Pasqualucci CA, Grinberg LT, Ferreira ST, Panizzutti R (2015년 5월 5일). “D-Serine levels in Alzheimer's disease: implications for novel biomarker development”. 《Translational Psychiatry》 5 (5): e561. doi:10.1038/tp.2015.52. PMC 4471283. PMID 25942042.
- ↑ Wang, Jing; Serratrice, Nicolas; Lee, Cindy J.; François, Florence; Sweedler, Jonathan V.; Puel, Jean-Luc; Mothet, Jean-Pierre; Ruel, Jérôme (2021년 12월 17일). “Physiopathological Relevance of D-Serine in the Mammalian Cochlea”. 《Frontiers in Cellular Neuroscience》 (Frontiers Media SA) 15: 733004. doi:10.3389/fncel.2021.733004. ISSN 1662-5102. PMC 8718999. PMID 34975405.