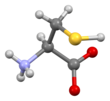
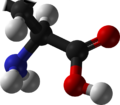
시스테인
 L-시스테인의 골격 구조식
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
cysteine
| |||
| 별칭
2-amino-3-sulfhydrylpropanoic acid
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| 약어 | Cys, C | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.145 | ||
| EC 번호 |
| ||
| E 번호 | E920 (광택제, ...) | ||
| KEGG | |||
PubChem CID
|
|||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질[3] | |||
| C3H7NO2S | |||
| 몰 질량 | 121.15 g·mol−1 | ||
| 겉보기 | 흰색 결정 또는 분말 | ||
| 녹는점 | 240 °C (464 °F; 513 K) decomposes | ||
| 25 °C에서 0.112 g/L[1] | |||
| 용해도 | 1.5g/100g ethanol 19 °C[2] | ||
손지기 회전 ([α]D)
|
+9.4° (H2O, c = 1.3) | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
시스테인(영어: cysteine) (기호: Cys 또는 C[4])[5]은 단백질의 생합성에 사용되는 α-아미노산이다. 화학식은 HOOC−CH(−NH
2)−CH
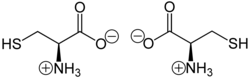
2−SH이며, 반필수[6] 단백질생성성 아미노산이다. 시스테인의 곁사슬의 싸이올은 보통 친핵체로 효소 반응에 참여한다. 시스테인은 카이랄성이며 자연에서는 L-시스테인만 발견됩니다.
싸이올은 산화되어 많은 단백질에서 중요한 구조적 역할을 하는 이황화물 유도체인 시스틴을 생성한다. 이러한 경우 기호로 Cyx가 사용되는 경우가 있다.[7][8] 탈양성자화된 형태는 일반적으로 기호 Cym으로도 기술할 수 있습니다.[8][9]
식품 첨가물로 사용될 때 시스테인의 E 번호는 E920이다.
시스테인은 UGU, UGC 코돈에 의해 암호화되어 있다.
구조
[편집]다른 아미노산(단백질의 잔기가 아님)들과 마찬가지로 시스테인은 양쪽성 이온으로 존재한다. 시스테인은 D-글리세르알데하이드 및 L-글리세르알데하이드에 대한 상동성을 기반으로 하는 이전의 D/L 표기법에서 L 카이랄성을 갖는다. 카이랄성을 지정하는 새로운 R/S 표기법에서 비대칭 탄소 근처에 있는 원자의 원자 번호를 기반으로 시스테인(및 셀레노시스테인)은 비대칭 탄소 원자에 대한 두 번째 이웃 원자로 황(또는 셀레늄)의 존재 때문에 R 카이랄성을 갖는다. 그 위치에 더 가벼운 원자를 갖는 나머지 카이랄 아미노산은 S 카이랄성을 갖는다. 황을 셀레늄으로 치환하면 셀레노시스테인이 생성된다.
 |
식이 공급원
[편집]시스테이닐은 고단백 식품에서의 잔류물이다. 시스테인이 풍부한 것으로 간주되는 일부 식품으로는 가금류, 계란, 쇠고기 및 통곡물이 있다. 고단백 식단에서 시스테인은 부분적으로 혈압을 낮추고 뇌졸중 위험을 감소시키는 역할을 할 수 있다.[10] 시스테인은 비필수 아미노산으로 분류되지만, 드물게 유아, 노인, 특정 대사 질환이 있거나 흡수 장애 증후군을 앓고 있는 사람에게는 필수적일 수 있다. 시스테인은 충분한 양의 메티오닌을 사용할 수 있는 경우 정상적인 생리학적 조전에서 일반적으로 인체에서 합성될 수 있다.
산업적 공급원
[편집]대부분의 시스테인은 가금류의 깃털이나 돼지털과 같은 동물성 물질의 가수분해에 의해 산업적으로 얻어진다. 널리 퍼진 믿음에도 불구하고 사람의 머리카락이 원료로 사용된다는 증거는 거의 없으며, 유럽 연합에서 식품 첨가물 및 화장품에 사용을 명시적으로 금지하고 있다.[11][12] 유대교의 카슈루트 및 이슬람교의 할랄을 준수하는 합성 제조된 L-시스테인도 가격은 더 비싸지만 사용할 수 있다.[13] 합성 경로는 대장균의 돌연변이체를 사용한 발효를 포함한다. 에보닉 인더스트리스는 치환된 티아졸린으로부터의 경로를 도입했다.[14] 이 기술에 따라 슈도모나스 티아졸리노필룸(Pseudomonas thiazolinophilum)을 사용하여 라세미 2-아미노-Δ2-티아졸린-4-카복실산의 가수분해에 의해 L-시스테인이 생성된다.[15]
생합성
[편집]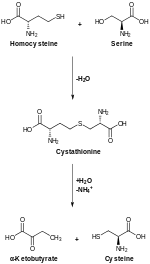
동물에서 생합성은 아미노산인 세린으로부터 시작된다. 황은 대사 중간생성물인 S-아데노실메티오닌을 통해 호모시스테인으로 전환되는 메티오닌으로부터 유래된다. 그런 다음 호모시스테인과 세린은 시스타티오닌 β-생성효소에 의해 결합되어 비대칭 싸이오에스터인 시스타티오닌을 생성한다. 시스타티오닌은 시스타티오닌 γ-분해효소에 의해 시스테인과 α-케토뷰티르산으로 전환된다. 식물과 세균에서 시스테인 생합성은 또한 세린 O-아세틸기전이효소에 의해 O-아세틸세린으로 전환되는 세린에서부터 시작된다. 황화물 공급원을 사용하는 시스테인 생성효소는 이 에스터를 시스테인으로 전환시켜 아세트산을 방출한다.[16]
생물학적 기능
[편집]시스테인의 설프하이드릴기는 친핵성이며 쉽게 산화된다. 싸이올이 이온화되면 반응성이 향상되고 단백질의 시스테인 잔기는 중성에 가까운 pKa값을 가지므로 종종 세포에서 반응성 싸이올레이트 형태로 존재한다.[17] 높은 반응성 때문에 시스테인의 설프하이드릴기는 수많은 생물학적 기능을 가지고 있다.
항산화제인 글루타티온의 전구체
[편집]싸이올이 산화환원반응을 일으키기 때문에 시스테인과 시스테이닐 잔기는 항산화 특성을 가지고 있다. 시스테인의 항산화 특성은 일반적으로 사람과 다른 생물에서 생성되는 트라이펩타이드인 글루타티온으로 표현된다. 경구로 섭취한 글루타티온(GSH)의 체계적인 이용 가능성은 무시할 수 있으므로, 글루타티온은 이를 구성하는 아미노산인 시스테인, 글리신, 글루탐산으로부터 생합성되어야 한다. 아미노산의 질소가 대사 중간생성물인 글루탐산을 통해 재순환되기 대문에 글루탐산은 일반적으로 충분하며, 식이 시스테인과 글리신의 보충은 글루타티온의 합성을 향상시킬 수 있다.[18]
철-황 클러스터의 전구체
[편집]시스테인은 사람의 물질대사에서 중요한 황화물 공급원이다. 철-황 클러스터 및 질소고정효소의 황화물은 시스테인으로부터 추출되며, 이 과정에서 알라닌으로 전환된다.[19]
금속 이온 결합
[편집]철-황 단백질 외에도 효소의 다른 많은 금속 보조 인자는 시스테닐 잔기의 싸이올레이트 치환체에 결합되어 있다. 예를 들면 아연 핑거 및 알코올 탈수소효소의 아연, 플라스토사이아닌의 구리, 사이토크롬 P450의 철, [NiFe]-수소화효소의 니켈이 있다.[20] 설프하이드릴기는 또한 중금속에 대한 친화력이 커서 메탈로싸이오네인과 같은 시스테인을 함유한 단백질은 수은, 납, 카드뮴과 같은 중금속과 단단히 결합할 수 있다.[21]
단백질 구조에서의 역할
[편집]폴리펩타이드를 생성하기 위한 mRNA 분자의 번역에서 시스테인은 UGU 및 UGC 코돈에 의해 암호화되어 있다.
시스테인은 전통적으로 다른 극성 아미노산의 곁사슬에 있는 하이드록실기와 설프하이드릴기 사이의 화학적 병렬성을 기반으로 친수성 아미노산으로 간주되었다. 그러나 시스테인의 곁사슬은 비극성 아미노산인 글리신 및 극성 아미노산인 세린의 곁사슬보다 미셀에서 소수성 상호작용을 더 크게 안정화시키는 것으로 나타났다.[22] 아미노산이 단백질 구조의 다른 화학적 환경에서 나타나는 통계적 분석에서 유리 시스테인 잔기가 단백질의 소수성 영역과 연관되는 것으로 밝혀졌다. 시스테인의 소수성 경향은 메티오닌 및 티로신(티로신은 극성 방향족이지만 소수성이기도 함[23])과 같은 비극성 아미노산의 소수성 경향과 동일하며, 세린 및 트레오닌과 같은 극성 아미노산의 소수성 경향보다 훨씬 더 크다.[24] 가장 소수성인 아미노산부터 가장 친수성인 아미노산으로 아미노산의 순위를 매기는 소수성 척도는 단백질에서 이황화 결합을 형성하는 시스테인의 경향에 영향을 받지 않는 방법을 기반으로 하는 경우에도 시스테인을 스펙트럼의 소수성 말단 쪽으로 일관되게 배치한다. 따라서 시스테인은 소수성 아미노산으로 분류되는 경우가 많지만,[25][26] 때로는 약간 극성[27] 또는 극성[6]으로 분류되기도 한다.
단백질이 존재하는 시스테인 잔기의 대부분은 다른 시스테인 잔기와 공유 결합하여 이황화 결합을 형성하며 이는 일부 단백질, 일반적으로 세포 외로 분비되는 단백질의 접힘 및 안정성에 중요한 역할을 한다.[28] 대부분의 세포 내 구획은 환원성 환경이기 때문에 이황화 결합은 일반적으로 아래에 언급된 몇 가지 예외를 제외하고는 세포질에서 불안정하다.

단백질의 이황화 결합은 시스테인 잔기의 설프하이드릴기의 산화에 의해 형성된다. 다른 황 함유 아미노산인 메티오닌은 이황화 결합을 형성할 수 없다. 보다 더 공격적인 산화제는 시스테인을 해당하는 설핀산 및 설폰산으로 전환시킨다. 시스테인 잔기는 단백질을 가교시키는 중요한 역할을 하며, 이것은 단백질의 강성을 증가시키고 단백질의 분해 저항성(단백질의 분비는 비용이 많이 드는 과정이기 때문에 필요성을 최소화시키는 것이 유리하다)을 부여한다. 세포 내부에서 폴리펩타이드 내의 시스테인 잔기 사이의 이황화 결합은 단백질의 3차 구조를 지지한다. 인슐린은 두 개의 분리된 펩타이드 사슬이 한 쌍의 이황화 결합에 의해 연결되어 있는 시스틴 가교가 있는 단백질의 한 예이다.
단백질 이황화물 이성질화효소는 이황화 결합의 적절한 형성을 촉매한다. 세포는 디하이드로아스코르브산을 소포체로 전달하여 환경을 산화시킨다. 이 환경에서 시스테인은 일반적으로 시스틴으로 산화되어 더 이상 친핵체로 기능하지 않는다.
시스틴으로의 산화 외에도 시스테인은 수많은 번역 후 변형에 참여한다. 예를 들어 친핵성 설프하이드릴기는 프레닐화에서 시스테인이 다른 작용기에 접합되도록 한다. 유비퀴틴 분해효소는 유비퀴틴을 펜던트, 단백질 및 카스페이스로 전달하며, 이들은 아폽토시스 주기에서 단백질 분해에 관여한다. 인테인은 보통 촉매 작용을 하는 시스테인의 도움으로 기능한다. 이러한 역할은 일반적으로 환경이 환원되고 시스테인이 시스틴으로 산화되지 않는 세포 내 환경으로 제한된다.
활용
[편집]주로 L-거울상 이성질체인 시스테인은 식품, 제약 및 퍼스널 케어 산업에서 전구체로 사용된다. 가장 큰 활용 분야 중 하나는 풍미의 생성이다. 예를 들어 마이야르 반응에서 시스테인과 설탕이 반응하면 고기의 풍미를 낸다.[29] L-시스테인은 베이킹 가공 보조제로도 사용된다.[30]
퍼스널 케어 분야에서 시스테인은 주로 아시아에서 퍼머넌트 웨이브에 사용된다. 시스테인은 모발의 케라틴에 있는 이황화 결합을 분해하는 데 사용된다.
시스테인은 생체분자의 구조와 역학을 조사하기 위한 부위 지정 라벨링 실험에서 매우 인기있는 표적이다. 말레이미드는 공유결합성 마이클 첨가를 사용하여 시스테인에 선택적으로 부착한다. EPR 또는 상자성 이완 강화 NMR에 대한 부위 지정 스핀 라벨링은 시스테인을 광범위하게 사용한다.
알코올의 독성 효과 감소
[편집]시스테인은 간 손상 및 숙취를 포함하여 알코올의 일부 부정적인 영향에 대한 예방 또는 해독제로 제안되었다. 시스테인은 아세트알데하이드의 독성 효과를 중화시킨다.[31] 시스테인은 아세트알데하이드를 아세트산으로 전환시키는 물질대사의 다음 단계를 지원한다.
쥐에 대한 연구에서 실험 쥐는 LD90 용량의 아세트알데하이드를 투여받았다. 시스테인을 투여받은 쥐의 생존률은 80%였다. 시스테인과 티아민을 모두 투여했을 때 모든 쥐들이 생존했다. 대조군에서는 10%의 생존율을 보였다.[32]
2020년에는 L-시스테인이 사람에게도 작용할 수 있음을 시사하는 기사가 발표되었다.[33]
N-아세틸시스테인
[편집]N-아세틸-L-시스테인은 아세틸기가 질소 원자에 부착된 시스테인의 유도체이다. 이 화합물은 식이 보충제로 판매되며, 아세트아미노펜의 과다 복용 시에는 해독제로 사용된다.[34]
양
[편집]시스테인은 양이 양모를 생산하는 데 필요하다. 시스테인은 양이 사료로부터 반드시 섭취해야 하는 필수 아미노산이다. 결과적으로 시스테인 결핍 상황에서 양은 더 적은 양모를 생산한다. 그러나 스스로 시스테인을 만들 수 있는 형질전환 양이 개발되었다.[35]
화학 반응
[편집]다기능성인 시스테인은 다양한 반응을 겪는다. 설프하이드릴기를 보호하는 데 많은 관심이 집중되었다.[36] 시스테인을 메틸화하면 S-메틸시스테인이 생성됩니다. 폼알데하이드로 처리하면 티아졸리딘 싸이오프롤린이 생성된다. 시스테인을 금속 이온으로 처리하면 다양한 배위 화합물이 형성된다.[37]
안전
[편집]대부분의 다른 아미노산에 비해 시스테인은 훨씬 더 많은 독성을 가지고 있다.[38]
식이 제한
[편집]식품 첨가물로 사용되는 동물성 L-시스테인 공급원은 카슈루트, 할랄, 채식주의자와 같은 식이 제한을 따르는 사람들에게 논쟁의 여지가 있다.[39] 이러한 문제를 피하기 위해 L-시스테인은 미생물 또한 다른 합성 공정을 통해서 얻을 수도 있다.
역사
[편집]1884년에 독일의 화학자 오이겐 바우만은 시스틴을 환원제로 처리했을 때 시스틴이 "시스테인"이라고 명명한 단량체의 이량체임을 발견했다.[40]
같이 보기
[편집]각주
[편집]- ↑ “L-Cysteine Product Information” (PDF).
- ↑ Belitz, H.-D; Grosch, Werner; Schieberle, Peter (2009년 2월 27일). 《Food Chemistry》. ISBN 9783540699330.
- ↑ Weast, Robert C., 편집. (1981). 《CRC Handbook of Chemistry and Physics》 62판. Boca Raton, FL: CRC Press. C-259쪽. ISBN 0-8493-0462-8..
- ↑ “Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)”, 《Pure Appl. Chem.》 56 (5), 1984: 595–624, doi:10.1351/pac198456050595
- ↑ “cysteine - Definition of cysteine in English by Oxford Dictionaries”. 《Oxford Dictionaries - English》. 2016년 9월 25일에 원본 문서에서 보존된 문서. 2018년 4월 15일에 확인함.
- ↑ 가 나 “The primary structure of proteins is the amino acid sequence”. 《The Microbial World》. University of Wisconsin-Madison Bacteriology Department. 2013년 5월 25일에 원본 문서에서 보존된 문서. 2012년 9월 16일에 확인함.
- ↑ “Amber Workshop - Tutorial A1 - Section 1: Do some editing of the PDB file”. 《ambermd.org》. 2022년 5월 22일에 원본 문서에서 보존된 문서. 2022년 6월 2일에 확인함.
- ↑ 가 나 Lee, Jumin; Hitzenberger, Manuel; Rieger, Manuel; Kern, Nathan R.; Zacharias, Martin; Im, Wonpil (2020년 7월 21일). “CHARMM-GUI supports the Amber force fields”. 《The Journal of Chemical Physics》 153 (3): 035103. doi:10.1063/5.0012280. PMID 32716185. S2CID 220796795.
- ↑ “Amber Workshop - Tutorial A1 - Section 1: Do some editing of the PDB file”. 《ambermd.org》. 2022년 5월 22일에 원본 문서에서 보존된 문서. 2022년 6월 2일에 확인함.
- ↑ Larsson, Susanna C.; Håkansson, Niclas; Wolk, Alicja (April 2015). “Dietary Cysteine and Other Amino Acids and Stroke Incidence in Women”. 《Stroke》 46 (4): 922–926. doi:10.1161/STROKEAHA.114.008022. PMID 25669310. S2CID 14895681.
- ↑ “EU Chemical Requirements”. 2020년 5월 24일에 확인함.
...L-cysteine hydrochloride or hydrochloride monohydrate. Human hair may not be used as a source for this substance
- ↑ “Regulation (EC) No 1223/2009 of the European Parliament and of the Council of 30 November 2009 on cosmetic products”. 2021년 7월 28일에 확인함.
...ANNEX II LIST OF SUBSTANCES PROHIBITED IN COSMETIC PRODUCTS...416 Cells, tissues or products of human origin
- ↑ “Questions About Food Ingredients: What is L-cysteine/cysteine/cystine?”. Vegetarian Resource Group.
- ↑ Martens, Jürgen; Offermanns, Heribert; Scherberich, Paul (1981). “Facile Synthesis of Racemic Cysteine”. 《Angewandte Chemie International Edition in English》 20 (8): 668. doi:10.1002/anie.198106681.
- ↑ Drauz, Karlheinz; Grayson, Ian; Kleemann, Axel; Krimmer, Hans-Peter; Leuchtenberger, Wolfgang; Weckbecker, Christoph (2007). 〈Amino Acids〉. 《Ullmann's Encyclopedia of Industrial Chemistry》. doi:10.1002/14356007.a02_057.pub2. ISBN 978-3-527-30673-2.
- ↑ Hell R (1997). “Molecular physiology of plant sulfur metabolism”. 《Planta》 202 (2): 138–48. doi:10.1007/s004250050112. PMID 9202491. S2CID 2539629.
- ↑ Bulaj G, Kortemme T, Goldenberg DP (June 1998). “Ionization-reactivity relationships for cysteine thiols in polypeptides”. 《Biochemistry》 37 (25): 8965–72. doi:10.1021/bi973101r. PMID 9636038.
- ↑ Sekhar, Rajagopal V; Patel, Sanjeet G (2011). “Deficient synthesis of glutathione underlies oxidative stress in aging and can be corrected by dietary cysteine and glycine supplementation”. 《The American Journal of Clinical Nutrition》 94 (3): 847–853. doi:10.3945/ajcn.110.003483. PMC 3155927. PMID 21795440.

- ↑ Lill R, Mühlenhoff U (2006). “Iron-sulfur protein biogenesis in eukaryotes: components and mechanisms”. 《Annu. Rev. Cell Dev. Biol.》 22: 457–86. doi:10.1146/annurev.cellbio.22.010305.104538. PMID 16824008.
- ↑ Lippard, Stephen J.; Berg, Jeremy M. (1994). 《Principles of Bioinorganic Chemistry》. Mill Valley, CA: University Science Books. ISBN 978-0-935702-73-6.
- ↑ Baker DH, Czarnecki-Maulden GL (June 1987). “Pharmacologic role of cysteine in ameliorating or exacerbating mineral toxicities”. 《J. Nutr.》 117 (6): 1003–10. doi:10.1093/jn/117.6.1003. PMID 3298579.
- ↑ Heitmann P (January 1968). “A model for sulfhydryl groups in proteins. Hydrophobic interactions of the cystein side chain in micelles”. 《Eur. J. Biochem.》 3 (3): 346–50. doi:10.1111/j.1432-1033.1968.tb19535.x. PMID 5650851.
- ↑ “A Review of Amino Acids (tutorial)”. Curtin University. 2015년 9월 7일에 원본 문서에서 보존된 문서. 2015년 9월 9일에 확인함.
- ↑ Nagano N, Ota M, Nishikawa K (September 1999). “Strong hydrophobic nature of cysteine residues in proteins”. 《FEBS Lett.》 458 (1): 69–71. doi:10.1016/S0014-5793(99)01122-9. PMID 10518936. S2CID 34980474.
- ↑ Betts, M.J.; R.B. Russell (2003). “Hydrophobic amino acids”. 《Amino Acid Properties and Consequences of Substitutions, In: Bioinformatics for Geneticists》. Wiley. 2012년 9월 16일에 확인함.
- ↑ Gorga, Frank R. (1998–2001). “Introduction to Protein Structure--Non-Polar Amino Acids”. 2012년 9월 5일에 원본 문서에서 보존된 문서. 2012년 9월 16일에 확인함.
- ↑ “Virtual Chembook--Amino Acid Structure”. Elmhurst College. 2012년 10월 2일에 원본 문서에서 보존된 문서. 2012년 9월 16일에 확인함.
- ↑ Sevier CS, Kaiser CA (November 2002). “Formation and transfer of disulphide bonds in living cells”. 《Nat. Rev. Mol. Cell Biol.》 3 (11): 836–47. doi:10.1038/nrm954. PMID 12415301. S2CID 2885059.
- ↑ Huang, Tzou-Chi; Ho, Chi-Tang (2001년 7월 27일). Hui, Y. H.; Nip, Wai-Kit; Rogers, Robert, 편집. 《Meat Science and Applications, ch. Flavors of Meat Products》. CRC. 71–102쪽. ISBN 978-0-203-90808-2.
- ↑ “Food Ingredients and Colors”. U.S. Food and Drug Administration. November 2004. 2009년 5월 12일에 원본 문서에서 보존된 문서. 2009년 9월 6일에 확인함.
- ↑ Otoyama, Ippo; Hamada, Hironobu; Kimura, Tatsushi; Namba, Haruchi; Sekikawa, Kiyokazu; Kamikawa, Norimichi; Kajiwara, Teruki; Aizawa, Fumiya; Sato, Yoshinobu M. (2019). “L-cysteine improves blood fluidity impaired by acetaldehyde: In vitro evaluation”. 《PLOS ONE》 14 (3): e0214585. Bibcode:2019PLoSO..1414585O. doi:10.1371/journal.pone.0214585. PMC 6440629. PMID 30925182.
- ↑ Sprince H, Parker CM, Smith GG, Gonzales LJ (April 1974). “Protection against acetaldehyde toxicity in the rat by L-cysteine, thiamin and L-2-methylthiazolidine-4-carboxylic acid”. 《Agents Actions》 4 (2): 125–30. doi:10.1007/BF01966822. PMID 4842541. S2CID 5924137.
- ↑ Eriksson, C J Peter; Metsälä, Markus; Möykkynen, Tommi; Mäkisalo, Heikki; Kärkkäinen, Olli; Palmén, Maria; Salminen, Joonas E; Kauhanen, Jussi (2020년 10월 20일). “L-Cysteine Containing Vitamin Supplement Which Prevents or Alleviates Alcohol-related Hangover Symptoms: Nausea, Headache, Stress and Anxiety”. 《Alcohol and Alcoholism》 55 (6): 660–666. doi:10.1093/alcalc/agaa082. hdl:10138/339340. PMID 32808029.
- ↑ Kanter MZ (October 2006). “Comparison of oral and i.v. acetylcysteine in the treatment of acetaminophen poisoning”. 《Am J Health Syst Pharm》 63 (19): 1821–7. doi:10.2146/ajhp060050. PMID 16990628. S2CID 9209528.
- ↑ Powell BC, Walker SK, Bawden CS, Sivaprasad AV, Rogers GE (1994). “Transgenic sheep and wool growth: possibilities and current status”. 《Reprod. Fertil. Dev.》 6 (5): 615–23. doi:10.1071/RD9940615. PMID 7569041.
- ↑ Milkowski, John D.; Veber, Daniel F.; Hirschmann, Ralph (1979). “Thiol Protection with the Acetamidomethyl Group: S-Acetamidomethyl-L-Cysteine Hydrochloride”. 《Organic Syntheses》 59: 190. doi:10.15227/orgsyn.059.0190.
- ↑ Arnold, Alan P.; Jackson, W. Gregory (1990). “Stereospecificity in the Synthesis of the Tris((R)-Cysteinato-N,S)- and Tris((R)-Cysteinesulfinato-N,S)cobaltate(III) Ions”. 《Inorganic Chemistry》 29 (18): 3618–3620. doi:10.1021/ic00343a061.
- ↑ Anderson, Mary E.; Meister, Alton (1987). 〈Intracellular delivery of cysteine〉. 《Sulfur and Sulfur Amino Acids》. Methods in Enzymology 143. 313–325쪽. doi:10.1016/0076-6879(87)43059-0. ISBN 9780121820435. PMID 3309557.
- ↑ “Kosher View of L-Cysteine”. kashrut.com. May 2003.
- ↑ Baumann, E. (1884). “Ueber Cystin und Cysteïn” [On cystine and cysteine]. 《Zeitschrift für physiologische Chemie》 (독일어) 8: 299–305. From pp. 301-302: "Die Analyse der Substanz ergibt Werthe, welche den vom Cystin (C6H12N2S2O4) verlangten sich nähern, […] nenne ich dieses Reduktionsprodukt des Cystins: Cysteïn." (Analysis of the substance [cysteine] reveals values which approximate those [that are] required by cystine (C6H12N2S2O4), however the new base [cysteine] can clearly be recognized as a reduction product of cystine, to which the [empirical] formula C3H7NSO2, [which had] previously [been] ascribed to cystine, is [now] ascribed. In order to indicate the relationships of this substance to cystine, I name this reduction product of cystine: "cysteïne".) Note: Baumann's proposed structures for cysteine and cystine (see p.302) are incorrect: for cysteine, he proposed CH3CNH2(SH)COOH .
더 읽을거리
[편집]- Nagano N, Ota M, Nishikawa K (September 1999). “Strong hydrophobic nature of cysteine residues in proteins”. 《FEBS Lett.》 458 (1): 69–71. doi:10.1016/S0014-5793(99)01122-9. PMID 10518936. S2CID 34980474.
외부 링크
[편집]- Cysteine MS Spectrum
- International Kidney Stone Institute 보관됨 2019-05-13 - 웨이백 머신
- http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/cystein en.html 보관됨 2016-11-10 - 웨이백 머신
- 952-10-3056-9 Interaction of alcohol and smoking in the pathogenesis of upper digestive tract cancers - possible chemoprevention with cysteine
- Cystine Kidney Stones
- Kosher View of L-Cysteine