아데노신 삼인산
| |
| 식별자 | |
|---|---|
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.258 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C10H16N5O13P3 | |
| 몰 질량 | 507.18 g/mol |
| 밀도 | 1.04 g/cm3 (disodium salt) |
| 녹는점 | 187 °C (369 °F; 460 K) disodium salt; decomposes |
| 산성도 (pKa) | 6.5 |
| UV-vis (λmax) | 259 nm[1] |
| 흡광도 | ε259 = 15.4 mM−1 cm−1[1] |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
아데노신 삼인산(영어: adenosine triphosphate, ATP)은 근육 수축, 신경 세포에서 흥분의 전도, 물질 합성 등 살아있는 세포에서 다양한 생명 활동을 수행하기 위해 에너지를 공급하는 유기 화합물이다. 모든 생명체에서 발견되는 ATP는 종종 세포 내 에너지 전달의 "분자 단위의 에너지 화폐"라고 불린다.[2] 대사 과정에서 ATP가 소비되면 아데노신 이인산(ADP) 또는 아데노신 일인산(AMP)으로 전환된다. 다른 대사 과정들은 인체가 매일 생명활동에 쓰이는 ATP를 충당할 수 있도록 ATP를 재생한다.[3] 또한, ATP는 DNA와 RNA의 전구물질이며, 조효소로도 사용된다.
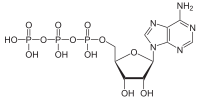
생화학의 관점에서 ATP는 뉴클레오사이드 삼인산으로 분류되며, 아데닌(질소 염기), 리보스(5탄당), 삼인산의 세 가지 성분으로 구성되어 있다.
구조
[편집]ATP는 아데닌의 9번 질소 원자와 리보스의 1' 탄소 원자가 서로 연결되어 있고, 리보스의 5' 탄소 원자에 삼인산이 연결되어 있다. 물질대사와 관련된 많은 반응에서 아데닌과 리보스는 변함없이 유지되지만, 삼인산이 이인산으로 전환되면 ADP, 일인산으로 전환되면 AMP를 형성한다. 3개의 인산기는 리보스에 가까이 있는 인산기로부터 알파(α), 베타(β), 말단에 위치한 인산기는 감마(γ)로 지칭된다.
중성 용액에서 이온화된 ATP는 주로 ATP4−로 존재하며, 적은 비율의 ATP3−가 존재한다.[4]
ATP와 금속 양이온의 결합
[편집]폴리음이온이며 잠재적으로 킬레이트성 폴리인산기를 특징으로 하는 ATP는 높은 친화력으로 금속 양이온과 결합한다. Mg2+에 대한 결합 상수는 9.554이다.[5] 2가 양이온인 Mg2+와의 결합은 다양한 단백질과 ATP의 상호작용에 강하게 영향을 미친다. ATP-Mg2+ 상호작용의 강도 때문에 ATP는 주로 인산기의 산소 중심에 결합된 Mg2+와 복합체로 세포 내에 존재한다.[4][6]
두 번째 마그네슘 이온은 키네이스의 도메인에서 ATP의 결합에 중요하다.[7] Mg2+의 존재는 키네이스의 활성을 조절한다.[8]
화학적 특성
[편집]ATP의 염은 무색의 고체로 분리될 수 있다.[9]
ATP는 촉매가 없는 pH 6.8에서 7.4 사이의 수용액에서 안정하다. 보다 극단적인 pH에서 ATP는 ADP와 인산으로 빠르게 가수분해된다. 살아있는 세포는 ATP의 농도가 ADP의 농도보다 5배인 평형에서 ATP와 ADP의 비율을 평형으로부터 10배의 크기로 유지한다.[10][11] 생화학적 반응에서 P-O-P 결합은 고에너지 인산 결합으로 지칭된다.[12]

ATP가 ADP와 무기 인산(Pi)으로 가수분해되면 3.4 kJ/mol의 자유 에너지의 변화와 함께 30.5 kJ/mol의 엔탈피를 방출한다.[13] 표준 상태 1M에서 ATP로부터 인산(Pi) 또는 피로인산(PPi)이 분해됨으로써 방출되는 에너지는 다음과 같다.[14]
- ATP + H
2O → ADP + Pi ΔG° = −30.5 kJ/mol (−7.3 kcal/mol) - ATP + H
2O → AMP + PPi ΔG° = −45.6 kJ/mol (−10.9 kcal/mol)
위의 축약된 화학 반응식은 좀 더 명확하게 쓰여질 수 있다. (R = 아데노실):
- [RO-P(O)2-O-P(O)2-O-PO3]4− + H
2O → [RO-P(O)2-O-PO3]3− + [PO4]3− + 2 H+ - [RO-P(O)2-O-P(O)2-O-PO3]4− + H
2O → [RO-PO3]2− + [O3P-O-PO3]4− + 2 H+
한편 ATP의 가수분해는 막전위의 발생을 수반하는 이온수송에 관여하기도 한다.
AMP 및 ADP로부터 ATP의 생산
[편집]산소가 있는 조건에서 ATP의 생산
[편집]전형적인 세포 내에서 ATP의 농도는 1~10 mM로 풍부한 편이다.[15] 산소가 존재하는 대사 과정에서 ATP의 탈인산화와 ADP와 AMP의 재인산화는 반복적으로 일어난다.
ATP는 다수의 서로 다른 세포 내 대사 경로를 통해 생성될 수 있다. 진핵생물에서 세 가지 주요 경로는 (1) 해당과정, (2) 시트르산 회로/산화적 인산화, (3) 베타 산화이다. (1) 해당과정과 (2) 시트르산 회로/산화적 인산화의 조합인 과정은 세포 호흡으로 알려져 있으며, 포도당 1분자당 약 32 ATP를 생성한다.[16]
비광합성 산소 호흡 진핵생물에 의한 ATP 생산은 주로 미토콘드리아에서 일어나는데, 미토콘드리아는 전형적인 세포 부피의 약 25%를 차지한다.[17]
해당과정
[편집]해당과정에서 포도당과 글리세롤은 피루브산으로 대사된다. 해당과정은 두 가지 효소인 포스포글리세르산 키네이스와 피루브산 키네이스에 의해 촉매되는 기질수준 인산화를 통해 포도당 1분자당 2분자의 ATP를 생성한다. 포도당 1분자당 2분자의 NADH도 생성되며, NADH는 전자전달계를 통해 산화되어 ATP 생성효소에 의해 추가적인 ATP의 생성으로 이어진다. 해당과정의 최종 산물로 생성되는 피루브산은 피루브산 산화 과정의 기질이다.[18]
해당과정은 총 10단계로 구성되어 있다. 에너지 투자기(preparatory phase)인 단계 1~단계 5를 거치면서 1분자의 포도당은 2분자의 글리세르알데하이드 3-인산(G3P)로 전환된다. 1분자의 ATP는 단계 1에 투자되고, 또 다른 1분자의 ATP는 단계 3에 투자된다. 해당과정의 단계 1과 단계 3을 "프라이밍 단계(priming steps)"라고 한다. 에너지 회수기(payoff phase)에서는 2분자의 글리세르알데하이드 3-인산이 2분자의 피루브산으로 전환된다. 단계 7에서 2분자의 ATP가 생성되며, 단계 10에서도 2분자의 ATP가 생성된다. 단계 7과 단계 10에서 ATP는 ADP로부터 생성된다. 해당과정에서 2분자의 ATP가 순생산된다. 해당과정은 나중에 ATP를 추가로 생산하기 위해 피루브산의 산화와 시트르산 회로로 연결된다.
해당과정의 조절
[편집]해당과정에서 헥소키네이스는 자신이 만든 생성물인 포도당 6-인산에 의해 직접적으로 저해되고, 피루브산 키네이스는 ATP에 의해 저해된다. 해당과정의 주요 조절 지점은 고농도의 ATP에 의해 다른 자리 입체적으로 저해되고, 고농도의 AMP에 의해 활성화되는 포스포프럭토키네이스-1(PFK-1)이다. ATP는 포스포프럭토키네이스-1에 의해 촉매되는 반응의 기질이기 때문에 ATP에 의한 포스포프럭토키네이스-1의 저해는 드문 경우이다. 포스포프럭토키네이스-1의 활성형은 2가지 입체 구조로 존재하는 사량체 단백질이며, 그 중에 하나만 기질인 과당 6-인산과 결합한다. 포스포프럭토키네이스-1은 ATP에 대해 두 개의 결합 부위를 가지고 있는데, 활성 부위는 2가지 입체 구조에서 모두 ATP가 접근 가능하지만, 저해제 결합 부위에 ATP가 결합하면 과당 6-인산을 제대로 결합시키지 않는 입체구조를 안정화시킨다.[18] 고리형 아데노신 일인산(cAMP), 암모늄 이온, 무기 인산(Pi), 과당 1,6-이중인산 및 과당 2,6-이중인산을 포함하는 많은 다른 작은 분자들은 입체구조의 평형에서 ATP에 의한 유도 적합 변화를 보상할 수 있고, 포스포프럭토키네이스-1을 재활성화 할 수 있다.[18]
시트르산 회로와 산화적 인산화
[편집]미토콘드리아에서 피루브산은 피루브산 탈수소효소 복합체에 의해 아세틸기로 산화되며, 아세틸기는 시트르산 회로에 의해 이산화 탄소로 완전 산화된다. 시트르산 회로 1회전당 2분자의 CO2, 3분자의 NADH, 1분자의 FADH2, 1분자의 ATP가 생성된다. 시트르산 회로에서 생성되는 ATP(또는 GTP)는 석시닐-CoA가 석시닐-CoA 합성효소에 의해 석신산으로 전환되는 반응에서 기질수준 인산화를 통해 생성된다. NADH 와 FADH2는 산화적 인산화에 의한 추가적인 ATP를 생성하는 데에 사용되며, 각각 NAD+와 FAD로 재활용된다. 1분자의 NADH 산화에 의해 약 2.5분자의 ATP가, 1분자의 FADH2 산화에 의해 약 1.5분자의 ATP가 생성된다.[16] 세포 호흡을 통해 생성되는 ATP의 대부분은 산화적 인산화를 통해 생성된다. 시트르산 회로 내에서 산소를 필요로 하진 않지만, 산화적 인산화를 통해 NADH와 FADH2를 각각 NAD+와 FAD로 전환하는 데 O2가 사용되기 때문에, 산소가 공급되지 않으면 시트르산 회로도 작동을 멈춘다.[17]
세포질의 NADH로부터 미토콘드리아에 의한 ATP의 생성은 미토콘드리아 내막이 NADH와 NAD+에 대해 불투과성이기 때문에 말산-아스파르트산 왕복통로 또는 글리세롤 3-인산 왕복통로를 이용한다. 생성된 NADH를 운반하는 대신에 말산 탈수소효소가 옥살아세트산을 말산으로 전환시키고, 말산은 세포질에서 미토콘드리아 기질로 운반된다. 운반된 말산은 미토콘드리아 기질에 존재하는 말산 탈수소효소에 의해 다시 옥살아세트산으로 전환되고, 이 과정에서 NADH가 생성된다. 아스파르트산 아미노기전이효소는 옥살아세트산을 아스파르트산으로 전환시키고, 아스파르트산은 운반체를 통해 미토콘드리아 내막을 가로질러 막 사이 공간으로 운반된다.[17]
산화적 인산화에서 NADH와 FADH2로부터 고에너지 전자가 전자전달계를 통해 전달되는 과정에서 방출되는 에너지를 이용해 미토콘드리아 기질로부터 막 사이 공간으로 H+(양성자)가 능동수송된다. 이러한 양성자의 능동수송은 미토콘드리아 내막을 경계로 H+의 농도 기울기(pH의 차이)와 전위 차이의 형태로 위치 에너지를 발생시키며, 이는 양성자 구동력을 생성시킨다. 이러한 H+의 전기화학적 기울기에 의해 H+가 막 사이 공간에서 미토콘드리아 기질로 ATP 생성효소를 통해 확산될 때 ATP가 생성된다.[19] ATP 생성효소가 1회전 할 때 3 ATP가 생성된다.
미토콘드리아에서 합성된 ATP의 대부분은 세포질에서 세포의 대사를 수행하는 데 사용된다. 따라서 미토콘드리아 기질에서 만들어진 ATP는 미토콘드리아 밖으로 내보내져야 한다. 미토콘드리아 기질 쪽은 상대적으로 음전하를 띄는 데 비해 세포질 쪽은 상대적으로 양전하를 띄기 때문에 미토콘드리아 내막을 경계로 한 H+의 전기화학적 기울기는 ATP를 미토콘드리아 기질로부터 세포질로 나가도록 돕는다. 미토콘드리아 밖으로 운반되는 1분자의 ATP당 1H+가 소모된다. 따라서 1분자의 ATP를 만들고, 미토콘드리아 밖으로 운반하려면 4H+가 필요하다. 미토콘드리아 내막에 존재하는 역수송체인 ADP/ATP 전위효소는 막 사이 공간의 ADP와 미토콘드리아 기질에서 새로 합성된 ATP를 서로 교환하는 데 사용되는 내재성 막단백질이다.[20] ADP/ATP 전위효소는 3개의 음전하를 미토콘드리아 안으로 이동시키는 대가로 미토콘드리아 밖으로 약 4개의 음전하를 이동시키기 때문에 막전위에 의해 작동된다. 또한 미토콘드리아 안으로 인산을 수송하는 것도 필요하다. 인산 운반체는 인산과 함께 H+(양성자)를 이동시켜서 H+의 농도 기울기를 부분적으로 상쇄시킨다. 해당과정, 피루브산의 산화, 시트르산 회로, 산화적 인산화가 순차적으로 완료되면 포도당 1분자당 약 30~32 ATP가 생성된다.
시트르산 회로의 조절
[편집]시트르산 회로는 주로 핵심적인 기질의 이용가능성, 특히 NAD+와 NADH의 비율, 칼슘, 무기 인산, ATP, ADP, AMP의 농도에 의해 조절된다. 시트르산은 시트르산 생성효소의 피드백 억제제이며, 시트르산 회로와 해당과정 조절 사이에 직접적인 연관성이 있는 포스포프럭토키네이스-1(PFK-1)을 억제한다.[18]
β 산화
[편집]호기성 조건에서 관련 효소와 보조 인자가 있으면 지방산은 아세틸-CoA로 전환된다. 이러한 대사 경로를 β 산화라고 한다. β 산화의 각 사이클은 2개의 탄소 원자를 분해한 만큼 지방산 사슬을 짧게 만들고, 1분자의 아세틸-CoA, 1분자의 NADH, 1분자의 FADH2를 생성한다. 아세틸-CoA는 시트르산 회로에 의해 대사되어 ATP를 생성하며, NADH와 FADH2는 산화적 인산화에서 ATP를 생성하는 데 사용된다. 긴사슬 지방산의 β 산화에 의해 수십 분자의 ATP가 생성된다.[21]
산화적 인산화의 조절
[편집]산화적 인산화에서 핵심 조절 지점은 사이토크롬 c 산화효소에 의해 촉매되는 반응으로 환원형인 사이토크롬 c 기질의 이용가능성에 의해 조절된다. 이용가능한 환원형 사이토크롬 c의 양은 다른 기질의 양과 직접적으로 관련되어 있다.
이러한 화학 반응식을 직접적으로 내포하고 있는 것은 다음과 같다.
따라서 [NADH] 대 [NAD+]의 높은 비율 또는 [ADP][Pi] 대 [ATP]의 높은 비율은 많은 양의 환원된 사이토크롬 c 및 사이토크롬 c 산화효소의 높은 활성을 의미한다.[18] 미토콘드리아 기질과 세포질 사이에 ATP와 NADH의 운반 속도에 의해 추가적인 조절이 이루어진다.[20]
케톤증
[편집]케톤체는 미토콘드리아에서 산화될 때 아세토아세트산 분자당 22 ATP와 2 GTP 분자를 생성하는 연료로 사용될 수 있다. 케톤체는 간으로부터 다른 조직으로 운반되며, 아세토아세트산과 β-하이드록시뷰티르산은 시트르산 회로를 통해 환원 당량(NADH and FADH2)을 생성하기 위해 아세틸-CoA로 재전환될 수 있다. 간에는 β-케토아실-CoA 전이효소(또는 싸이오포레이스)가 없기 때문에 케톤체는 간에서 연료로 사용될 수 없다. 저농도의 아세토아세트산은 간에서 흡수되어 젖산으로 끝나는 메틸글리옥살 경로(methylglyoxal pathway)를 통해 해독된다. 고농도의 아세토아세트산은 간세포 이외의 다른 세포로 흡수되어 프로필렌 글리콜을 통해 다른 대사 경로로 들어간다. ATP를 필요로 하는 일련의 단계를 거쳐서, 프로필렌 글리콜은 피루브산으로 전환될 수 있다.[22]
혐기성 조건에서 ATP 생성
[편집]발효는 산소가 없는 상태에서 유기 화합물의 물질대사이다. 발효는 세포 호흡에서의 산화적 인산화가 없는 기질수준의 인산화를 포함한다. 포도당이 젖산으로 산화되는 화학 반응식은 다음과 같다.
- C
6H
12O
6 → 2 CH
3CH(OH)COOH + 2 ATP
무산소 호흡은 O2가 없는 상태에서의 호흡이다. 원핵생물들은 다양한 전자수용체들을 이용할 수 있다. 이러한 전자수용체로는 질산염, 황산염 및 이산화 탄소가 포함된다.
뉴클레오사이드 이인산 키네이스에 의한 ATP의 보충
[편집]ATP는 고에너지 인산의 공여체로서 다른 뉴클레오사이드 삼인산을 사용하는 뉴클레오사이드 이인산 키네이스의 효소군 및 ATP:구아니도-포스포트랜스퍼레이스 효소군에 의해 촉매되는 몇 가지 보충 반응을 통해 합성될 수 있다.
광합성에서 ATP 생성
[편집]식물에서 ATP는 엽록체의 틸라코이드 막에서 합성된다. 이러한 과정을 광인산화라고 한다. 광인산화 과정은 화학삼투적인 방식으로 ATP를 합성한다는 점에서 미토콘드리아에서의 산화적 인산화와 유사하지만 전자전달계를 작동시키기 위한 고에너지 전자를 만드는 데 빛에너지를 이용한다는 점에서 차이가 있다.[23] 광인산화에서 ATP 생성효소는 산화적 인산화와 동일한 방식으로 ATP를 생성한다. 엽록체에서 생성된 ATP의 일부는 캘빈 회로에서 소비된다.
ATP 재활용
[편집]인체 내 ATP의 총량은 약 0.2몰이다. 대부분의 ATP는 앞서 언급한 과정에 의해 ADP로부터 재활용된다. 따라서 주어진 시간에 ATP + ADP 총량은 상당히 일정하게 유지된다.
사람의 세포가 사용하는 에너지를 하루에 100~150몰의 ATP의 가수분해를 필요로 하며, 이는 약 50~75 kg 에 해당한다. 사람은 보통 하루동안 자신의 몸무게 만큼의 ATP를 사용한다. ATP의 각 당량은 하루동안 500~750회(100 / 0.2 = 500회) 재활용된다.
생화학적 기능
[편집]세포 내 신호전달
[편집]ATP는 인산기를 전달하는 효소인 키네이스의 기질 여갈을 함으로써 신호전달에 관여한다. 키네이스는 가장 일반적인 ATP-결합 단백질이다. 키네이스들은 몇 개의 공통적인 접힘을 공유한다.[24] 키네이스에 의한 단백질의 인산화는 미토젠 활성화 단백질 키네이스(MAP kinase) 캐스케이드와 같은 캐스케이드를 활성화시킬 수 있다.[25]
ATP는 또한 G 단백질 연결 수용체 신호전달 경로에서 가장 흔한 아데닐산 고리화효소의 기질이며, 세포 내 저장소에서 칼슘을 방출함으로써 칼슘 신호를 촉발시키는 역할을 하는 2차 신호전달자인 고리형 아데노신 일인산(cAMP)으로 전환될 수 있다.[26] 신호 전달의 이러한 형태는 다른 여러 세포 과정의 조절에 관여하지만 뇌 기능에서 특히 중요하다.[27]
DNA와 RNA의 합성
[편집]ATP는 RNA의 합성에 필요한 4가지 기질 중 하나이다. RNA의 합성은 RNA 중합효소에 의해 촉진된다.[28] ATP가 디옥시리보뉴클레오타이드인 dATP로 대체되는 것을 제외하면 DNA의 합성에서도 비슷한 과정이 일어난다. 자연계에서 일어나는 많은 축합 반응들과 마찬가지로 DNA 복제와 전사도 ATP를 소비한다.
단백질 합성에서 아미노산 활성화
[편집]아미노아실-tRNA 합성효소는 tRNA에 아미노산을 결합시키는 데 ATP를 소비하며, 아미노아실-tRNA 복합체를 형성하도록 한다. 아미노아실 전이효소는 AMP-아미노산을 tRNA에 결합시킨다. 짝지음 반응은 다음의 두 단계로 진행된다.
- 아미노산 + ATP ⟶ 아미노산-AMP + PPi
- 아미노산-AMP + tRNA ⟶ 아미노산-tRNA + AMP
아미노산은 에스터 결합을 통해 tRNA의 3' 말단(서열 CCA의 A)에 있는 뉴클레오타이드와 결합한다.
ATP-결합 카세트 수송체
[편집]농도 기울기에 역행해서 세포 밖으로 물질을 운반하는 것은 종종 ATP의 가수분해와 관련이 있다. 운반은 ATP-결합 카세트 수송체(ABC 수송체)에 의해 매개된다. 인간의 게놈은 약물, 지질, 기타 화합물을 세포 밖으로 운반하는 데 사용되는 48가지의 ATP-결합 카세트 수송체를 암호화하고 있다.[29]
세포 외 신호전달 및 신경전달
[편집]세포는 퓨린작동성 신호전달이라고 불리는 과정에서 다른 세포와 연락하기 위해 ATP를 분비한다. ATP는 신경계의 많은 부분에서 신경전달물질로 작용하고, 혈관의 산소 공급 등에 영향을 미친다. ATP는 통로 단백질[30][31]을 통해 세포막을 통해 직접 분비되거나 세포막과 융합되는 소낭[32]으로 펌핑된다. 세포는 퓨린작동성 수용체 단백질인 P2X와 P2Y를 사용하여 ATP를 감지한다.
단백질 용해도
[편집]ATP는 최근 생물학적 향수성(向水性) 물질로 작용하는 것으로 제안되었으며,[33] 프로테옴 전체의 용해도에 영향을 미치는 것으로 밝혀졌다.[34]
ATP 유사체
[편집]생화학 실험실에서는 종종 ATP-의존적인 분자 과정을 탐구하기 위해 생체 외(in vitro) 연구를 수행한다. ATP 유사체는 종종 다른 기질과 함께 ATP와 복합체를 형성하는 단백질의 구조를 결정하기 위해 X선 결정학을 사용한다.
키네이스와 같은 ATP-의존성 효소의 저해제는 ATP-의존성 반응과 관련된 결합 부위 및 전이 상태를 조사하는 데 필요하다.
가장 유용한 ATP 유사체는 ATP처럼 가수분해되지 않는다. 대신에 ATP 유사체들은 ATP-결합 상태와 밀접하게 관련된 구조로 효소를 붙잡아 둔다. 아데노신 5'-γ-싸이오삼인산(adenosine 5′-γ-thiotriphosphate)은 감마 인산의 산소 중 하나가 황 원자로 대체된 매우 일반적인 ATP 유사체이다. 이러한 ATP 유사체는 ATP보다 매우 느린 속도로 가수분해되고, ATP-의존성 과정의 저해제로 작용한다. 결정학적 연구에서 ATP 가수분해의 전이 상태는 바나드산 이온이 결합된 상태에 의해 모델링된다.
일부 효소는 고농도에서 상당한 속도로 ATP 유사체를 가수분해할 수 있기 때문에 ATP 유사체를 사용한 실험의 결과를 해석할 때는 주의해야 한다.[35]
역사
[편집]ATP는 카를 로만(Karl Lohmann)[36][37]과 옌드라시크(Jendrassik)[38]에 의해 1929년에 발견되었고, 이와는 별도로 하버드 의학대학원의 사이러스 피스크(Cyrus Fiske)와 옐라프라가다 수바로(Yellapragada Subba Rao)에 의해 발견되었는데,[39] 두 팀은 인산화물에 대한 실마리를 찾기 위해 서로 경쟁하였다. ATP는 1941년 프리츠 앨버트 리프먼에 의해 세포에서 에너지 생성 반응과 에너지 요구 반응 사이의 중개 물질로 제안되었다.[40] ATP는 1948년 알렉산더 토드에 의해 실험실에서 처음으로 합성되었다.[41] 1997년 노벨 화학상은 아데노신 삼인산(ATP)의 합성의 기초가 되는 효소 메커니즘을 밝힌 공로로 폴 D. 보이어, 존 E. 워커와 이온전달 효소인 Na+-K+ ATPase를 처음으로 발견한 옌스 크리스티안 스코우에게 공동으로 수여되었다.[42]
같이 보기
[편집]- 아데노신 이인산 (ADP)
- 아데노신 일인산 (AMP)
- 아데노신-테트라포스파테이스
- ATP에이스
- ATP 측정법
- ATP 가수분해
- 시트르산 회로
- 크레아틴
- 고리형 아데노신 일인산 (cAMP)
- 뉴클레오타이드 교환인자
- 포스파젠
- 기질수준 인산화
- 산화적 인산화
- 광인산화
각주
[편집]- ↑ 가 나 “Adenosine 5'-triphosphate disodium salt Product Information” (PDF). Sigma. 2019년 3월 23일에 원본 문서 (PDF)에서 보존된 문서. 2019년 3월 22일에 확인함.
- ↑ Knowles, J. R. (1980). “Enzyme-catalyzed phosphoryl transfer reactions”. 《Annu. Rev. Biochem.》 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- ↑ Törnroth-Horsefield, S.; Neutze, R. (December 2008). “Opening and closing the metabolite gate”. 《Proc. Natl. Acad. Sci. USA》 105 (50): 19565–19566. doi:10.1073/pnas.0810654106. PMC 2604989. PMID 19073922.
- ↑ 가 나 Storer, A.; Cornish-Bowden, A. (1976). “Concentration of MgATP2− and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions”. 《Biochem. J.》 159 (1): 1–5. doi:10.1042/bj1590001. PMC 1164030. PMID 11772.
- ↑ Wilson, J.; Chin, A. (1991). “Chelation of divalent cations by ATP, studied by titration calorimetry”. 《Anal. Biochem.》 193 (1): 16–19. doi:10.1016/0003-2697(91)90036-S. PMID 1645933.
- ↑ Garfinkel, L.; Altschuld, R.; Garfinkel, D. (1986). “Magnesium in cardiac energy metabolism”. 《J. Mol. Cell. Cardiol.》 18 (10): 1003–1013. doi:10.1016/S0022-2828(86)80289-9. PMID 3537318.
- ↑ Saylor, P.; Wang, C.; Hirai, T.; Adams, J. (1998). “A second magnesium ion is critical for ATP binding in the kinase domain of the oncoprotein v-Fps”. 《Biochemistry》 37 (36): 12624–12630. doi:10.1021/bi9812672. PMID 9730835.
- ↑ Lin, X.; Ayrapetov, M; Sun, G. (2005). “Characterization of the interactions between the active site of a protein tyrosine kinase and a divalent metal activator”. 《BMC Biochem.》 6: 25. doi:10.1186/1471-2091-6-25. PMC 1316873. PMID 16305747.
- ↑ 틀:Merck13th
- ↑ Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002). 《Bioenergetics 3》 3판. San Diego, CA: Academic. ISBN 978-0-12-518121-1.
- ↑ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2003). 《Biochemistry》. New York, NY: W. H. Freeman. 376쪽. ISBN 978-0-7167-4684-3.
- ↑ Chance, B.; Lees, H.; Postgate, J. G. (1972). “The Meaning of "Reversed Electron Flow" and "High Energy Electron" in Biochemistry”. 《Nature》 238 (5363): 330–331. doi:10.1038/238330a0. PMID 4561837.
- ↑ Gajewski, E.; Steckler, D.; Goldberg, R. (1986). “Thermodynamics of the hydrolysis of adenosine 5′-triphosphate to adenosine 5′-diphosphate” (PDF). 《J. Biol. Chem.》 261 (27): 12733–12737. PMID 3528161. 2007년 9월 27일에 원본 문서 (PDF)에서 보존된 문서. 2019년 8월 27일에 확인함.
- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). 《Biochemistry》 6판. New York, NY: W. H. Freeman. 413쪽. ISBN 978-0-7167-8724-2.
- ↑ Beis, I.; Newsholme, E. A. (1975년 10월 1일). “The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates”. 《Biochem. J.》 152 (1): 23–32. doi:10.1042/bj1520023. PMC 1172435. PMID 1212224.
- ↑ 가 나 Rich, P. R. (2003). “The molecular machinery of Keilin's respiratory chain”. 《Biochem. Soc. Trans.》 31 (6): 1095–1105. doi:10.1042/BST0311095. PMID 14641005.
- ↑ 가 나 다 Lodish, H.; Berk, A.; Matsudaira, P.; Kaiser, C. A.; Krieger, M.; Scott, M. P.; Zipursky, S. L.; Darnell, J. (2004). 《Molecular Cell Biology》 5판. New York, NY: W. H. Freeman. ISBN 978-0-7167-4366-8.
- ↑ 가 나 다 라 마 Voet, D.; Voet, J. G. (2004). 《Biochemistry》 1 3판. Hoboken, NJ: Wiley. ISBN 978-0-471-19350-0.
- ↑ Abrahams, J.; Leslie, A.; Lutter, R.; Walker, J. (1994). “Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria”. 《Nature》 370 (6491): 621–628. doi:10.1038/370621a0. PMID 8065448.
- ↑ 가 나 Dahout-Gonzalez, C.; Nury, H.; Trézéguet, V.; Lauquin, G.; Pebay-Peyroula, E.; Brandolin, G. (2006). “Molecular, functional, and pathological aspects of the mitochondrial ADP/ATP carrier”. 《Physiology》 21 (4): 242–249. doi:10.1152/physiol.00005.2006. PMID 16868313.
- ↑ Ronnett, G.; Kim, E.; Landree, L.; Tu, Y. (2005). “Fatty acid metabolism as a target for obesity treatment”. 《Physiol. Behav.》 85 (1): 25–35. doi:10.1016/j.physbeh.2005.04.014. PMID 15878185.
- ↑ “Integrated Risk Information System” (PDF). 2013년 3월 15일.
- ↑ Allen, J. (2002). “Photosynthesis of ATP-electrons, proton pumps, rotors, and poise”. 《Cell》 110 (3): 273–276. doi:10.1016/S0092-8674(02)00870-X. PMID 12176312.
- ↑ Scheeff, E.; Bourne, P. (2005). “Structural evolution of the protein kinase-like superfamily”. 《PLoS Comput. Biol.》 1 (5): e49. doi:10.1371/journal.pcbi.0010049. PMC 1261164. PMID 16244704.
- ↑ Mishra, N.; Tuteja, R.; Tuteja, N. (2006). “Signaling through MAP kinase networks in plants”. 《Arch. Biochem. Biophys.》 452 (1): 55–68. doi:10.1016/j.abb.2006.05.001. PMID 16806044.
- ↑ Kamenetsky, M.; Middelhaufe, S.; Bank, E.; Levin, L.; Buck, J.; Steegborn, C. (2006). “Molecular details of cAMP generation in mammalian cells: a tale of two systems”. 《J. Mol. Biol.》 362 (4): 623–639. doi:10.1016/j.jmb.2006.07.045. PMC 3662476. PMID 16934836.
- ↑ Hanoune, J.; Defer, N. (2001). “Regulation and role of adenylyl cyclase isoforms”. 《Annu. Rev. Pharmacol. Toxicol.》 41: 145–174. doi:10.1146/annurev.pharmtox.41.1.145. PMID 11264454.
- ↑ Joyce, C. M.; Steitz, T. A. (1995). “Polymerase structures and function: variations on a theme?”. 《J. Bacteriol.》 177 (22): 6321–6329. doi:10.1128/jb.177.22.6321-6329.1995. PMC 177480. PMID 7592405.
- ↑ Borst, P.; Elferink, R. Oude (2002). “Mammalian ABC transporters in health and disease” (PDF). 《Annual Review of Biochemistry》 71: 537–592. doi:10.1146/annurev.biochem.71.102301.093055. PMID 12045106.
- ↑ Romanov, Roman A.; Lasher, Robert S.; High, Brigit; Savidge, Logan E.; Lawson, Adam; Rogachevskaja, Olga A.; Zhao, Haitian; Rogachevsky, Vadim V.; Bystrova, Marina F.; Churbanov, Gleb D.; Adameyko, Igor; Harkany, Tibor; Yang, Ruibiao; Kidd, Grahame J.; Marambaud, Philippe; Kinnamon, John C.; Kolesnikov, Stanislav S.; Finger, Thomas E. (2018). “Chemical synapses without synaptic vesicles: Purinergic neurotransmission through a CALHM1 channel-mitochondrial signaling complex”. 《Science Signaling》 11 (529): eaao1815. doi:10.1126/scisignal.aao1815. ISSN 1945-0877. PMC 5966022. PMID 29739879.
- ↑ Dahl, Gerhard (2015). “ATP release through pannexon channels”. 《Philosophical Transactions of the Royal Society B: Biological Sciences》 370 (1672): 20140191. doi:10.1098/rstb.2014.0191. ISSN 0962-8436. PMC 4455760. PMID 26009770.
- ↑ Larsson, Max; Sawada, Keisuke; Morland, Cecilie; Hiasa, Miki; Ormel, Lasse; Moriyama, Yoshinori; Gundersen, Vidar (2012). “Functional and Anatomical Identification of a Vesicular Transporter Mediating Neuronal ATP Release”. 《Cerebral Cortex》 22 (5): 1203–1214. doi:10.1093/cercor/bhr203. ISSN 1460-2199. PMID 21810784.
- ↑ Hyman, Anthony A.; Krishnan, Yamuna; Alberti, Simon; Wang, Jie; Saha, Shambaditya; Malinovska, Liliana; Patel, Avinash (2017년 5월 19일). “ATP as a biological hydrotrope”. 《Science》 (영어) 356 (6339): 753–756. doi:10.1126/science.aaf6846. ISSN 0036-8075. PMID 28522535.
- ↑ Savitski, Mikhail M.; Bantscheff, Marcus; Huber, Wolfgang; Dominic Helm; Günthner, Ina; Werner, Thilo; Kurzawa, Nils; Sridharan, Sindhuja (2019년 3월 11일). “Proteome-wide solubility and thermal stability profiling reveals distinct regulatory roles for ATP”. 《Nature Communications》 (영어) 10 (1): 1155. doi:10.1038/s41467-019-09107-y. ISSN 2041-1723. PMC 6411743. PMID 30858367.
- ↑ Resetar, A. M.; Chalovich, J. M. (1995). “Adenosine 5′-(gamma-thiotriphosphate): an ATP analog that should be used with caution in muscle contraction studies”. 《Biochemistry》 34 (49): 16039–16045. doi:10.1021/bi00049a018. PMID 8519760.
- ↑ “Karl Lohmann”. 《www.nndb.com》. 2018년 1월 21일에 확인함.
- ↑ Lohmann, K. (August 1929). “Über die Pyrophosphatfraktion im Muskel” [On the pyrophosphate fraction in muscle]. 《Naturwissenschaften》 (독일어) 17 (31): 624–625. doi:10.1007/BF01506215.
- ↑ Vaughan, Martha; Hill, Robert L.; Simoni, Robert D. (2002). “The Determination of Phosphorus and the Discovery of Phosphocreatine and ATP: the Work of Fiske and SubbaRow”. 《Journal of Biological Chemistry》 277 (32): e21.
- ↑ Maruyama, K. (March 1991). “The discovery of adenosine triphosphate and the establishment of its structure”. 《J. Hist. Biol.》 24 (1): 145–154. doi:10.1007/BF00130477.
- ↑ Lipmann, F. (1941). “Metabolic generation and utilization of phosphate bond energy.”. 《Adv. Enzymol.》 1: 99–162. ISSN 0196-7398.
- ↑ “History: ATP first discovered in 1929”. 《The Nobel Prize in Chemistry 1997》. Nobel Foundation. 2010년 5월 26일에 확인함.
- ↑ “The Nobel Prize in Chemistry 1997”. 《www.nobelprize.org》. 2018년 1월 21일에 확인함.
외부 링크
[편집] 위키미디어 공용에 아데노신 삼인산 관련 미디어 분류가 있습니다.
위키미디어 공용에 아데노신 삼인산 관련 미디어 분류가 있습니다.- ATP - 두산세계대백과사전
- ATP bound to proteins in the PDB
- ScienceAid: Energy ATP and Exercise
- PubChem entry for Adenosine Triphosphate
- KEGG entry for Adenosine Triphosphate


![{\displaystyle {\frac {[\mathrm {cyt~c_{red}} ]}{[\mathrm {cyt~c_{ox}} ]}}=\left({\frac {[\mathrm {NADH} ]}{[\mathrm {NAD} ]^{+}}}\right)^{\frac {1}{2}}\left({\frac {[\mathrm {ADP} ][\mathrm {P_{i}} ]}{[\mathrm {ATP} ]}}\right)K_{\mathrm {eq} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/baed008d658c507750599ae155a9a1c11da873e7)