헴 A
| |||
| 이름 | |||
|---|---|---|---|
| 별칭
iron cytoporphyrin IX, formilporphyrin
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChemSpider | |||
| MeSH | Heme+a | ||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C49H56O6N4Fe | |||
| 몰 질량 | 852.837 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
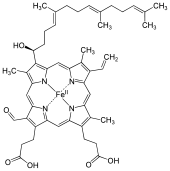
헴 A(영어: heme A)는 철 원자를 킬레이트화하는 포르피린이라고 불리는 거대 고리 리간드로 구성된 배위 결합 복합체인 헴이다. 헴 A는 생체분자이며 많은 생물체에 의해 자연적으로 생성된다. 용액에 있을 때 종종 이색성 녹색/빨간색으로 나타나는 헴 A는 헤모글로빈의 구성 요소로 혈액 내 빨간색 색소인 헴 B와 구조적으로 관련되어 있다.
다른 헴과의 관계
[편집]헴 A는 고리의 8번 위치에 있는 메틸기 곁사슬이 폼일기로 산화되고 아이소프레노이드 사슬인 하이드록시에티리파르네실기가 철 테트라피롤 헴의 고리의 2번 위치에 있는 비닐기 곁사슬에 부착된다는 점에서 헴 B와 다르다. 헴 A는 헴 O와 유사하다. 둘 다 2번 위치에 파르네실기가 첨가되어 있지만 헴 O는 8번 위치에 폼일기가 없고 여전히 메틸기를 가지고 있다는 점이 다르다. 환원된 Fe(II) 형태의 헴에 대한 핵자기 공명(NMR) 및 적외선(IR) 실험을 기반으로 한 헴 A의 정확한 구조가 1975년에 발표되었다.[1] 철이 없는 형태의 다이메틸 에스터의 합성을 통해 구조가 확인되었다.[2]
역사
[편집]헴 A는 1951년에 독일의 생화학자 오토 하인리히 바르부르크에 의해 처음으로 분리되었으며, 그에 의해 내재성 막 단백질로 금속단백질인 사이토크롬 c 산화효소의 활성 성분으로 밝혀졌다.[3]
입체화학
[편집]하이드록실기와 결합한 탄소인 고리 I의 3번 위치에 있는 첫 번째 탄소에 대한 정확한 기하학적 입체배치에 대한 최종적인 구조에 관한 질문은 카이랄 S 입체배치인 것으로 나타났다.[4]
헴 B와 마찬가지로 헴 A는 종종 헴 철과 보존된 아미노산 곁사슬 사이의 배위 결합을 통해 아포단백질에 부착된다. 중요한 호흡 단백질인 사이토크롬 c 산화효소(CCO)에서 산소 반응 중심의 헴 A에 대한 이 리간드 5는 히스티딜기이다.[5] 히스티딘은 헤모글로빈과 미오글로빈을 포함한 많은 헴단백질의 일반적인 리간드이다.
 |
사이토크롬 c 산화효소의 일부인 사이토크롬 a의 헴 A는 두 개의 히스티딘 잔기로 결합되어 있다(분홍색으로 표시).[6]
헴 A를 포함하는 금속단백질의 예로는 사이토크롬 c 산화효소가 있다. 이 매우 복잡한 단백질은 각각 다른 기능을 하는 두 개의 서로 다른 부위에 헴 A를 포함하고 있다. 사이토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합하여 6배위된다. 사이토크롬 a3의 헴의 철은 때때로 5개의 다른 원자와 결합되어 있으며 6번째 부위는 이산소(산소 분자, O2)와 결합할 수 있다.[6] 또한 이 효소는 3개의 구리, 마그네슘, 아연, 여러 칼륨 이온 및 나트륨 이온과 결합한다. 사이토크롬 c 산화효소에 있는 두 개의 헴 A기는 서로, 즉 구리 이온과 밀접하게 연관된 단백질인 사이토크롬 c 사이에서 쉽게 전자를 교환하는 것으로 생각된다.
폼일기와 아이소프레노이드 곁사슬은 모두 사이토크롬 c 산화효소에 의한 산소 환원의 에너지 보존에 중요한 역할을 하는 것으로 생각된다. 사이토크롬 c 산화효소는 미토콘드리아의 막 사이 공간으로 양성자를 펌핑하여 에너지를 보존하는 역할을 하는 것으로 생각된다. S. 요시카와(S. Yoshikawa)의 영향력 있는 그룹이 발표한 바와 같이 헴 A의 폼일기 및 하이드록시에틸파르네실기는 모두 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.[7]
같이 보기
[편집]- 헴
- 헴단백질
- 사이토크롬 c 산화효소 (세포 호흡의 복합체 IV)
각주
[편집]- ↑ Caughey, W.S.; Smythe, G.A.; O'Keefe, D.H.; Maskasky, J.E.; Smith, M.L. (1975). “Heme A of Cytochrome c Oxidase”. 《Journal of Biological Chemistry》 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Battersby, Alan R.; McDonald, Edward; Thompson, Mervyn; Chaudhry, Irshad A.; Clezy, Peter S.; Fookes, Christopher J. R.; Hai, Ton That (1985). “Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase”. 《Journal of the Chemical Society, Perkin Transactions 1》: 135. doi:10.1039/P19850000135.
- ↑ Warburg, O; Gewitz H S. (1951). “Cytohämin aus Herzmuskel”. 《Zeitschrift für Physiologische Chemie》 288 (1): 1–4. doi:10.1515/bchm2.1951.288.1.1. PMID 14860765.
- ↑ Yamashita E, Aoyama H, Yao M, 외. (2005). “Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution”. 《Acta Crystallographica D》 61 (10): 1373–1377. doi:10.1107/S0907444905023358. PMID 16204889.
- ↑ Tsukihara T, Shimokata K, Katayama Y, 외. (2003). “The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process”. 《PNAS》 100 (26): 15304–15309. Bibcode:2003PNAS..10015304T. doi:10.1073/pnas.2635097100. PMC 307562. PMID 14673090.
- ↑ 가 나 Yoshikawa, S.; Shinzawa-Itoh, K.; Nakashima, R.; 외. (1998). “Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase”. 《Science》 280 (5370): 1723–1729. doi:10.1126/science.280.5370.1723. PMID 9624044. S2CID 37147458.
- ↑ Shimokata K, Katayama Y, Murayama H, 외. (2007). “The proton pumping pathway of bovine heart cytochrome c oxidase”. 《PNAS》 104 (10): 4200–4205. Bibcode:2007PNAS..104.4200S. doi:10.1073/pnas.0611627104. PMC 1820732. PMID 17360500.