헴 C
| |
| 식별자 | |
|---|---|
3D 모델 (JSmol)
|
|
| ChemSpider | |
| MeSH | heme+C |
PubChem CID
|
|
| |
| 성질 | |
| C34H36O4N4S2Fe | |
| 몰 질량 | 684.64904 g/mol |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
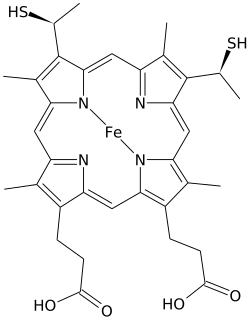
헴 C(영어: Heme C)는 중요한 종류의 헴이다. 금속단백질에 의해 보결분자단으로 배치된 금속포르피린 중에서 헴은 가장 널리 사용되는 것 중 하나이며[1] 헴단백질로 알려진 단백질의 부류를 정의한다. 헴은 혈액의 붉은색 색소인 헤모글로빈의 구성 요소로 가장 일반적으로 인식되지만 미오글로빈, 사이토크롬, 카탈레이스, 헴 과산화효소 및 내피 산화 질소 생성효소와 같은 생물학적으로 중요한 여러 다른 헴단백질에서도 발견된다.[2][3]
헴이라는 용어는 "피(blood)"를 의미하는 그리스어 "αἷμα (haima)"로부터 유래되었다.
역사[편집]
헴 C의 정확한 구조는 20세기 중반에 스웨덴의 생화학자 K. G. 파울(K. G. Paul)에 의해 발표되었다.[4] 이 연구는 스웨덴의 위대한 생화학자인 후고 테오렐이 처음으로 추론한 구조를 확증해 주었다. 헴의 환원된 형태인 Fe(II)의 핵자기 공명(NMR) 및 적외선(IR) 실험을 기반으로 한 헴 C의 구조는 1975년에 확인되었다.[5] 싸이오에터 결합에 대한 절대적인 입체화학적 입체배치를 포함하는 헴 C의 구조는 척추동물의 단백질인 사이토크롬 c에 대해 처음으로 제시되었으며[6] 현재는 단백질을 함유하는 다른 많은 헴 C로 확장된다.
특성[편집]
헴 C는 헴 B의 두 비닐기 곁사슬이 아포단백질에 대한 공유 싸이오에터 결합으로 대체된다는 점에서 헴 B와 다르다. 두 개의 싸이오에터 결합은 일반적으로 단백질의 시스테인 잔기에 의해 만들어진다. 이러한 결합은 온화한 조건에서도 헴-단백질 복합체인 홀로단백질로부터 분리될 수 있는 보다 쉽게 해리되는 헴 B와 비교하여 헴 C가 홀로단백질인 사이토크롬 c로부터 쉽게 분리되는 것을 허용하지 않는다. 이는 주로 전자 운반체 역할을 하는 수많은 C형 사이토크롬과 함께 매우 광범위한 사이토크롬 c 구조 및 기능을 허용한다. 사이토크롬 c의 산화환원전위는 단백질의 구조와 용매 상호작용의 작은 변화에 의해 미세 조정될 수 있다.[7]
홀로단백질에 결합된 헴 C 단위의 수는 매우 다양하다. 척추동물의 세포의 경우 단백질당 하나의 헴 C가 있는 것이 일반적이지만 세균의 경우 이 숫자는 종종 홀로단백질당 2, 4, 5, 6 심지어 16이 되기도 한다. 헴 C기의 수와 배열은 관련이 있으며 적절한 홀로단백질의 기능에 필요하다는 점은 일반적으로 수용된다. 예를 들어 여러 개의 헴 C기를 포함하는 단백질은 다중 전자 전달 반응과 관련되어 있으며, 특히 중요한 것은 대기 중의 질소를 두 개의 유기 암모니아 분자로 환원시키는 데 필요한 6개의 전자이다. 세균성 헴단백질의 경우 헴 C 대 아미노산의 비율이 높은 것이 일반적이므로 일부 사이토크롬 c 단백질의 내부는 다른 헴단백질에 비해 많은 헴 C기로 채워져 있는 것처럼 보인다. 보통 단세포 생물의 일부 헴단백질에는 5개의 헴 C가 포함될 수 있다.[8] 사이토크롬 bc1 복합체는 헴 C를 포함하는 또 다른 중요한 효소이다.
싸이오에터 결합은 홀로단백질의 기능을 크게 자유롭게 하는 것으로 보인다. 일반적으로 사이토크롬 c는 사이토크롬 b보다 더 넓은 범위의 산화환원전위에 걸쳐 미세 조정될 수 있다. 이것은 사이토크롬 c가 거의 모든 생물에 존재하는 중요한 이유일 수 있다. 헴 C는 또한 헴 C를 포함해야 하는 세포질의 사이토크롬 c의 단지 몇 분자만이 프로그램된 세포 사멸로 이어지는 아폽토시스에서 중요한 역할을 한다.[9] 사이토크롬 c는 사람의 혈청에서 측정될 수 있으며 염증의 지표로 사용될 수 있다.[10]
이러한 적도 방향으로의 공유 결합 외에도 헴 철은 일반적으로 두 아미노산의 곁사슬에 축 방향으로 배위되어 철을 6배위로 만든다. 예를 들어 포유류와 참치의 사이토크롬 c는 히스티딘과 메티오닌의 곁사슬의 축 방향으로 배위된 단일 헴 C를 포함한다.[11] 아마도 헴을 단백질에 고정하는 두 개의 공유 결합으로 인해 헴 C의 철은 때때로 리신의 아미노기 또는 물의 축 방향으로 연결된다.
같이 보기[편집]
각주[편집]
- ↑ Poulos, Thomas L. (2014년 4월 9일). “Heme Enzyme Structure and Function”. 《Chemical Reviews》 (영어) 114 (7): 3919–3962. doi:10.1021/cr400415k. ISSN 0009-2665. PMC 3981943. PMID 24400737.
- ↑ Paoli, M. (2002). “Structure-function relationships in heme-proteins.” (PDF). 《DNA Cell Biol.》 21 (4): 271–280. doi:10.1089/104454902753759690. hdl:20.500.11820/67200894-eb9f-47a2-9542-02877d41fdd7. PMID 12042067. S2CID 12806393. 2018년 7월 24일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Alderton, W.K. (2001). “Nitric oxide synthases: structure, function and inhibition.”. 《Biochem. J.》 357 (3): 593–615. doi:10.1042/bj3570593. PMC 1221991. PMID 11463332.
- ↑ Paul, K.G.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). “The splitting with silver salts of the cysteine-porphyrin bonds in cytochrome c”. 《Acta Chemica Scandinavica》 4: 239–244. doi:10.3891/acta.chem.scand.04-0239.
- ↑ Caughey, W.S.; Smythe, G.A.; O'Keeffe, D.H.; Maskasky, J.E.; Smith, M.L. (1975). “Heme A of Cytochrome c Oxidase”. 《Journal of Biological Chemistry》 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Takano T.; Trus B.L.; Mandel N.; Mandel G.; Kallai O.B.; Swanson R.; Dickerson R.E. (1977). “Tuna cytochrome c at 2.0 A resolution. II. Ferrocytochrome structure analysis.”. 《Journal of Biological Chemistry》 252 (2): 776–785. doi:10.1016/S0021-9258(17)32784-9. PMID 188826.
- ↑ Berghuis, A.M.; Brayer, G.D. (1992). “Oxidation state-dependent conformational changes in cytochrome c.”. 《J. Mol. Biol.》 223 (4): 959–976. doi:10.1016/0022-2836(92)90255-i. PMID 1311391.
- ↑ Gwyer James D., Richardson David J., Butt Julea N. (2005). “Diode or Tunnel-Diode Characteristics? Resolving the Catalytic Consequences of Proton Coupled Electron Transfer in a Multi-Centered Oxidoreductase”. 《Journal of the American Chemical Society》 127 (43): 14964–14965. doi:10.1021/ja054160s. PMID 16248601.
- ↑ Bowman, S.E.J., Bren, K.L. (2008). “The chemistry and biochemistry of heme C: functional bases for covalent attachment”. 《Nat. Prod. Rep.》 25 (6): 1118–1130. doi:10.1039/b717196j. PMC 2654777. PMID 19030605.
- ↑ Eleftheriadis, T.; Pissas, G.; Liakopoulos, V.; Stafanidis, I. (2016). “Cytochrome c as a Potentially Clinical Useful Marker of Mitochondrial and Cellular Damage.”. 《Front. Immunol.》 7: 279. doi:10.3389/fimmu.2016.00279. PMC 4951490. PMID 27489552.
- ↑ Yeh, S.R., Han, S., and Rousseau, D.L. (1998). “Cytochrome c folding and unfolding”. 《Accounts of Chemical Research》 31 (11): 727–735. doi:10.1021/ar970084p.
