조효소 B
| |
| 이름 | |
|---|---|
| IUPAC 이름
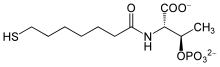
2-[(7-mercapto-1-oxoheptyl)amino]-3-phosphonooxybutanoic acid
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C 11H 22NO 7PS | |
| 몰 질량 | 343.333641 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
조효소 B(영어: coenzyme B)는 메테인 생성균의 산화환원반응에 필요한 조효소이다. 조효소 B의 전체 화학명은 7-머캅토헵타노일트레오닌포스페이트(영어: 7-mercaptoheptanoylthreoninephosphate)이다.[1] 조효소 B에는 주요 반응 부위인 싸이올이 포함되어 있다.
조효소 B는 2-메틸싸이오에테인설포네이트(메틸-조효소 M, 약칭 CH
3–S–CoM)과 반응하여 메테인 생성 경로에서 메테인을 방출한다.[2]
- CH3-S-CoM + HS-CoB → CH4 + CoB-S-S-CoM
이러한 전환은 보결분자단으로 보조 인자 F430을 포함하는 효소인 조효소 B 설포에틸싸이오트랜스퍼레이스에 의해 촉매된다.
HS-CoB와 HS-CoM을 모두 활용하는 관련 질환은 푸마르산 환원효소에 의해 촉매되는 푸마르산의 석신산으로의 환원 과정이다.[3]
- HS-CoM + HS-CoB + −O
2CCH=CHCO−
2 → −O
2CCH
2–CH
2CO−
2 + CoB-S-S-CoM
메테인 생성 경로에서 조효소 B의 중요성[편집]
조효소 B는 메테인 생성 경로의 마지막 단계에서 중요한 구성 요소이다.[4] 조효소 B는 조효소 M(메틸-조효소)을 메테인과 헤테로다이설파이드로 환원시키는 전자 공여체 역할을 한다.[5] 하나는 조효소 B를 사용하고 다른 하나는 조효소 B를 사용하지 않는 두 개의 개별 실험에서 메테인 분자가 형성되기 전에 조효소 B를 사용하면 보다 더 효율적이고 일관된 결합 절단이 일어남을 나타낸다.[6]
같이 보기[편집]
각주[편집]
- ↑ Noll KM, Rinehart KL, Tanner RS, Wolfe RS (1986). “Structure of component B (7-mercaptoheptanoylthreonine phosphate) of the methylcoenzyme M methylreductase system of Methanobacterium thermoautotrophicum”. 《Proc. Natl. Acad. Sci. U.S.A.》 83 (12): 4238–42. doi:10.1073/pnas.83.12.4238. PMC 323707. PMID 3086878.
- ↑ Thauer RK (September 1998). “Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture”. 《Microbiology》 144 (Pt 9): 2377–406. doi:10.1099/00221287-144-9-2377. PMID 9782487. 2020년 5월 17일에 원본 문서에서 보존된 문서. 2022년 4월 1일에 확인함.
- ↑ Heim S, Künkel A, Thauer RK, Hedderich R (April 1998). “Thiol:fumarate reductase (Tfr) from Methanobacterium thermoautotrophicum—identification of the catalytic sites for fumarate reduction and thiol oxidation”. 《Eur. J. Biochem.》 253 (1): 292–9. doi:10.1046/j.1432-1327.1998.2530292.x. PMID 9578488.
- ↑ Dey, Mishtu; Li, Xianghui; Kunz, Ryan C; Ragsdale, Stephen W (2010년 12월 22일). “Detection of Organometallic and Radical Intermediates in the Catalytic Mechanism of Methyl-Coenzyme M Reductase Using the Natural Substrate Methyl-Coenzyme M and a Coenzyme B Substrate Analogue”. 《Biochemistry (Easton)》 49 (51): 10902–10911. doi:10.1021/bi101562m. PMID 21090696.[깨진 링크(과거 내용 찾기)]
- ↑ Cedervall, Peder E; Dey, Mishtu; Pearson, Arwen R; Ragsdale, Stephen W; Wilmot, Carrie M (2010년 7월 22일). “Structural Insight into Methyl-Coenzyme M Reductase Chemistry Using Coenzyme B Analogues.”. 《Biochemistry (Easton)》 49 (35): 7683–7693. doi:10.1021/bi100458d. PMC 3098740. PMID 20707311.
- ↑ Horng, Yih-Chern; Becker, Donald F; Ragsdale, Stephen W (2001년 10월 30일). “Mechanistic Studies of Methane Biogenesis by Methyl-Coenzyme M Reductase: Evidence that Coenzyme B Participates in Cleaving the C−S Bond of Methyl-Coenzyme M”. 《Biochemistry (Easton)》 40 (43): 12875–12885. doi:10.1021/bi011196y. PMID 11669624.[깨진 링크(과거 내용 찾기)]
