만노스

| |
| 식별자 | |
|---|---|
| ChEMBL | |
| ChemSpider |
|
| MeSH | Mannose |
PubChem CID
|
|
| UNII | |
| 성질 | |
| C6H12O6 | |
| 몰 질량 | 180.156 g·mol−1 |
자화율 (χ)
|
-102.90·10−6 cm3/mol |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
만노스(영어: mannose)는 6개의 탄소 원자가 포함된 단당류이고, 알데하이드기를 가지고 있는 알도스이며, 화학식은 C6H12O6이다. 만노스와 포도당은 2번 탄소(C-2)에서 입체화학적 성질이 다른 에피머이다. 만노스는 사람의 물질대사, 특히 특정 단백질의 글리코실화에서 중요하다. 글리코실화에 관한 몇 가지 선천성 질환은 만노스 대사에 관여하는 효소들의 돌연변이와 관련이 있다.[1]
만노스는 필수적인 영양소는 아니지만, 인체 내에서 포도당으로부터 생성되거나 포도당으로 전환될 수 있다. 만노스는 2~5 kcal/g의 열량을 제공한다. 만노스는 소변으로 부분적으로 배설된다.
어원[편집]
만노스와 만니톨의 어원은 성경에 등장하는 "만나(manna)"이다. 성경은 만나를 시나이 반도를 지나는 동안 이스라엘 백성들에게 공급된 음식으로 기록하고 있다. 몇 가지 나무들과 관목들은 만니톨을 원래 분비된 채로 분비하는 "만나나무" (Fraxinus ornus)와 같이 만나라고 불리는 물질을 생산할 수 있다.
구조[편집]
만노스는 일반적으로 두 가지 다른 크기의 고리, 피라노스(6원자 고리) 형태 및 푸라노스(5원자 고리) 형태로 존재한다. 각각의 고리 형성 부위는 아노머 탄소에서 α- 또는 β-입체배치를 가질 수 있다. 수용액에서 4가지 형태의 이성질체들은 상호전환된다.
| D-만노스의 구조 | ||
|---|---|---|
| 골격 구조식 | 하워스 투영식 | |
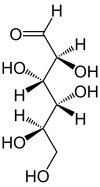
|
 α-D-만노푸라노스 <1 % |
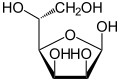 β-D-만노푸라노스 <1 % |
 α-D-만노피라노스 67 % |
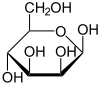 β-D-만노피라노스 33 % | |
물질대사[편집]
| 일반적인 단당류의 대사과정 |
|---|
 |
글리코실화에 사용되는 대부분의 만노스는 포도당으로부터 유래되는 것으로 생각되지만, 배양된 간암세포에서 당단백질의 생합성을 위한 만노스의 대부분은 포도당이 아닌 세포 외부의 만노스로부터 유래한다.[2] 간에서 생성되는 많은 당단백질들은 혈류로 분비되므로 만노스는 신체 전체에 걸쳐 분포한다.[3]
만노스는 단백질의 N-결합 글리코실화를 포함하는 당포합체에 존재한다. 또한 C-만노실화는 콜라겐-유사 부위에서 발견될 수 있다.
많은 다당류와 당단백질의 소화 과정에서 만노스가 생성되고, 만노스는 헥소키네이스에 의해 인산화되어 만노스 6-인산을 생성한다. 만노스 6-인산은 포스포만노스 이성질화효소에 의해 과당 6-인산으로 전환된 다음 해당과정으로 들어가거나 간세포에서 포도당신생합성 경로를 통해 포도당 6-인산으로 전환된다.
만노스는 N-결합 글리코실화에서 주요 단당류이다. N-결합 글리코실화는 단백질의 번역 후 변형이다. 이것은 단백질이 세포내막계로 들어올 때 동시에 번역되는 방식으로 소포체에서 당단백질로 Glc3Man9GlcNAc2의 일괄 전달에 의해 개시된다. 포도당은 완전하게 접힌 단백질 상에서 가수분해되고, 만노스 잔기는 소포체 및 골지체의 만노시데이스에 의해 가수분해된다. 일반적으로, 성인의 당단백질은 N-아세틸글루코사민, 갈락토스, 시알산에 의해 순차적으로 변형되어 묻힌 3개의 만노스 잔기만을 함유한다. 이것은 포유류의 선천적 면역 체계가 노출된 만노스 잔기들을 인식하도록 조정하기 때문에 중요하다. 이러한 활성은 효모의 표면에 만난의 형태로 만노스 잔기들이 존재하기 때문에 발생한다. 인간 면역결핍 바이러스(HIV)는 바이러스 표면에 글리칸의 밀집된 클러스터링으로 인해 상당량의 만노스 잔기들이 나타난다.[4][5] 이러한 만노스 잔기들은 항체를 광범위하게 중화시키기 위한 표적이다.[6]
생명공학[편집]
효모에서 생산된 재조합 단백질은 포유류 세포에서 사용되는 패턴과 다른 패턴으로 만노스를 첨가시킬 수 있다.[7] 포유류에서 정상적으로 생산되는 재조합 단백질의 차이는 백신의 효과에 영향을 줄 수 있다.
형성[편집]
만노스는 만니톨의 산화에 의해 형성될 수 있다.
또한 만노스는 로브리 드 브륀-반 에켄슈타인 전환(Lobry-de Bruyn-van Ekenstein transformation)에서 포도당으로부터 형성될 수 있다.
입체배치[편집]
만노스와 글루코스는 2번 탄소(C-2)에서 입체화학적 성질이 다른 에피머이다. 만노스는 수용액에서 주로 피라노스 고리 형태로 존재한다. 이러한 단순한 차이로 인해 만노스와 글루코스는 서로 다른 생화학적 특성을 갖는다. 이와 같은 변화는 다른 알도헥소스들에서도 동일한 효과를 나타낸다.
만노스 PTS 투과효소[편집]
포스포엔올피루브산-의존성 당 운반 인산기전이효소 시스템은 기질을 운반하는 동시에 인산화시킨다. 만노스 XYZ 투과효소 복합체는 이러한 효소군의 일원이며, 이러한 독특한 방식은 세균에 의해 당 섭취를 위해 사용되며 특히 만노스 XYZ 투과효소 복합체의 경우 외인성 육탄당을 해당과정을 통한 우선적인 대사에 대비해서 인산에스터를 세포질로 방출시킨다.[8] 만노스 XYZ 투과효소 복합체는 박테리오파지 람다에 의한 대장균(E. coli)의 감염에도 관련되며, 소단위체 ManX와 ManY는 람다 파지 감염에 관여한다.[9] 만노스 XYZ 투과효소 복합체는 3개의 폴리펩타이드 사슬(ManX, ManY, ManZ)에 4개의 도메인을 가지고 있다. ManX 소단위체는 세포막의 세포질 쪽으로 호모다이머(homodimer)를 형성한다. ManX는 각각의 도메인이 인산화 부위를 갖고 있으며, 힌지(hinge) 펩타이드에 의해 연결된 2개의 도메인 IIA 와 IIB를 포함하고 있고, IIA 와 IIB간에 인산기 전달이 일어난다.[10] ManX는 세포막에 결합하거나 분리될 수 있다.[9] ManY 및 ManZ 소단위체는 6개의 막 관통 부위를 갖는 소수성의 내재성 막단백질이다.[11] 포스포엔올피루브산의 인산기는 E1 (효소 1), HPr (히스티딘 단백질) 인산기 운반체를 통해 만노스 XYZ 투과효소 복합체의 ManX, ManY, ManZ 소단위체를 거쳐 유입된 헥소스(육탄당)을 인산화시켜 헥소스 6-인산을 생성한다.
같이 보기[편집]
각주[편집]
- ↑ Freeze, H. H.; Sharma, V. (2010). “Metabolic manipulation of glycosylation disorders in humans and animal models”. 《Seminars in Cell & Developmental Biology》 21 (6): 655–662. doi:10.1016/j.semcdb.2010.03.011. PMC 2917643. PMID 20363348.
- ↑ Alton, G.; Hasilik, M.; Niehues, R.; Panneerselvam, K.; Etchison, J. R.; Fana, F.; Freeze, H. H. (1998). “Direct utilization of mannose for mammalian glycoprotein biosynthesis”. 《Glycobiology》 8 (3): 285–295. doi:10.1093/glycob/8.3.285. PMID 9451038.
- ↑ Davis, J. A.; Freeze, H. H. (2001). “Studies of mannose metabolism and effects of long-term mannose ingestion in the mouse”. 《Biochimica et Biophysica Acta》 1528 (2–3): 116–126. doi:10.1016/S0304-4165(01)00183-0. PMID 11687298.
- ↑ Pritchard, Laura K.; Spencer, Daniel I. R.; Royle, Louise; Bonomelli, Camille; Seabright, Gemma E.; Behrens, Anna-Janina; Kulp, Daniel W.; Menis, Sergey; Krumm, Stefanie A. (2015년 6월 24일). “Glycan clustering stabilizes the mannose patch of HIV-1 and preserves vulnerability to broadly neutralizing antibodies”. 《Nature Communications》 (영어) 6: 7479. doi:10.1038/ncomms8479. PMC 4500839. PMID 26105115.
- ↑ Pritchard, Laura K.; Vasiljevic, Snezana; Ozorowski, Gabriel; Seabright, Gemma E.; Cupo, Albert; Ringe, Rajesh; Kim, Helen J.; Sanders, Rogier W.; Doores, Katie J. (2015년 6월 16일). “Structural Constraints Determine the Glycosylation of HIV-1 Envelope Trimers”. 《Cell Reports》 (영어) 11 (10): 1604–1613. doi:10.1016/j.celrep.2015.05.017. ISSN 2211-1247. PMC 4555872. PMID 26051934.
- ↑ Crispin, Max; Doores, Katie J (2015년 4월 1일). “Targeting host-derived glycans on enveloped viruses for antibody-based vaccine design”. 《Current Opinion in Virology》. Viral pathogenesis • Preventive and therapeutic vaccines 11: 63–69. doi:10.1016/j.coviro.2015.02.002. PMC 4827424. PMID 25747313.
- ↑ Vlahopoulos, S.; Gritzapis, A. D.; Perez, S. A.; Cacoullos, N.; Papamichail, M.; Baxevanis, C. N. (2009). “Mannose addition by yeast Pichia Pastoris on recombinant HER-2 protein inhibits recognition by the monoclonal antibody herceptin”. 《Vaccine》 27 (34): 4704–4708. doi:10.1016/j.vaccine.2009.05.063. PMID 19520203.
- ↑ Postma, P. W.; Lengeler, J. W.; Jacobson, G. R. (1993). “Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria”. 《Microbiological Reviews》 57 (3): 543–594. PMC 372926. PMID 8246840.
- ↑ 가 나 Erni, B.; Zanolari, B. (1985). “The mannose-permease of the bacterial phosphotransferase system. Gene cloning and purification of the enzyme IIMan/IIIMan complex of Escherichia coli”. 《The Journal of Biological Chemistry》 260 (29): 15495–15503. PMID 2999119.
- ↑ Erni, B.; Zanolari, B.; Graff, P.; Kocher, H. P. (1989). “Mannose permease of Escherichia coli. Domain structure and function of the phosphorylating subunit”. 《The Journal of Biological Chemistry》 264 (31): 18733–18741. PMID 2681202.
- ↑ Huber, F.; Erni, B. (1996). “Membrane topology of the mannose transporter of Escherichia coli K12”. 《European Journal of Biochemistry / FEBS》 239 (3): 810–817. doi:10.1111/j.1432-1033.1996.0810u.x. PMID 8774730.
