단백질
단백질(蛋白質, 문화어: 계란소)은 생화학에서 생물의 몸을 구성하는 고분자 유기 물질이다. 흰자질이라고도 한다.
단백질 영어명 프로틴(protein)은 그리스어의 proteios(중요한 것)에서 유래된 것이다. 단백질의 한자 표기에서 단(蛋)이 새알을 뜻하는 것에서 알 수 있듯, 단백질은 달걀 등의 새알의 흰자위를 이루는 주요 성분이다. 단백질이라는 한자어는 독일어 아이바이스슈토프(독일어: Eiweißstoff)에서 비롯되었는데, 독일어를 직역하면 "흰자 물질"이라는 뜻이다.
수많은 아미노산의 연결체로 20가지의 서로 다른 아미노산들이 펩타이드 결합이라고 하는 화학 결합으로 길게 연결된 것을 폴리펩타이드라고 한다. 여러 가지의 폴리펩타이드 사슬이 4차 구조를 이루어 고유한 기능을 갖게 되었을 때 비로소 단백질이라고 불리며[출처 필요] 단백질과 폴리펩타이드는 엄밀히 말하면 다른 분자이지만 경우에 따라 구분 없이 쓰이기도 한다. 일반적으로는 분자량이 비교적 작으면 폴리펩타이드라고 하며, 분자량이 매우 크면 단백질이라고 한다.
단백질은 생물체 내의 구성 성분, 세포 안의 각종 화학반응의 촉매 역할(효소), 항체를 형성하여 면역을 담당하는 등 여러 가지 형태로 중요한 역할을 수행한다. 화학식은 (NH2CHRnCOOH)n이다.
단백질은 트립신이라는 단백질 분해효소의 작용에 의해 소화된다. 그런데 콩에는 트립신의 활동을 방해하는 콩트립신 저해제라는 단백질이 들어있어 콩을 날로 먹으면 소화가 잘 되지 않는다. 하지만 콩을 가열할 경우 이 단백질 성분이 변성되어 저해기능을 잃는다. 결국 트립신이 활성화되어 소화효소의 침입이 용이해지는 것이다.[1]
단백질의 변성은 천연단백질이 물리적인 요인(가열, 건조, 교반, 압력, X선, 초음파, 진동, 동결)이나 화학적인 요인(산, 염기, 요소, 유기용매, 중금속, 계면활성제) 혹은 효소의 작용 등으로 원래의 성질을 잃어버리는 현상이다.
구조
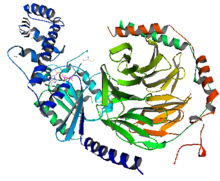
[편집]단백질은 고유한 3차원 구조로 접히는(Folding) 폴리펩타이드 사슬을 말한다. 단백질이 자연 상태에서 접히는 구조는 단백질의 이 폴리펩타이드를 이루는 아미노산들의 서열(sequence)에 의해 결정된다. 생화학자들은 단백질의 구조를 4개의 단계로 나누어 설명한다.
- 1차 구조: 아미노산 서열 한 개의 단백질이 가지는 구조는 상호작용하는 다른 분자들과 환경에 의해서 바뀔 수 있다. 이러한 구조의 변형은 단백질의 생물학적인 기능인 촉매 작용, 다른 분자와의 결합, 기계적 움직임 등에 매우 중요한 역할을 한다. 이러한 선형 단백질의 1차 구조는 공유 결합인 펩타이드 결합으로 이루어지고, 이러한 펩타이드 결합은 단백질이 리보솜에 의해 합성될 당시에 형성된다. 단백질의 2차, 3차, 4차 구조는 단백질을 이루는 뼈대(Backbone Chain)와 곁사슬(Side Chain) 구조들 간의 결합에 의해서 유지된다. 이 결합은 수소 결합, 소수성 결합, 이온 결합과 같은 비공유 결합과, 디설피드 결합과 같은 공유 결합으로 나뉜다.
- 2차 구조: 단백질의 2차 구조는 뼈대(Backbone Chain)에 의해 형성된다. 뼈대에 속해있는 모든 아미노산이 갖고 있는 카보닐기의 산소 원자와 아민기의 수소 원자 사이에 수소결합이 형성되어 열역학적으로 안정한 상태(가장 낮은 자유에너지를 가진 상태)를 갖게 된다. 이때 단백질의 2차 구조가 주로 알파나선(α-helix)이나 베타 면(β-sheet)의 모양을 취하게 되는 이유는 폴리펩타이드 위에서 바로 옆에 위치한 두 아미노산 사이에서 곁사슬과 뼈대의 원자들끼리 서로 밀어내는 힘을 최소화하는 안정한 모양이 알파나선이나 베타 면의 모양을 이루기 때문이다. 이는 뼈대의 수소결합(hydrogen bond)에 의한 일차적 접힘(folding)으로 가장 안정한 2차구조가 알파 나선이나 베타면의 모양을 이룸을 나타낸다. 라마찬드란 조사구(Ramachandran plot)는 이러한 추세를 좀 더 명확하게 보여준다.
- 3차 구조: 단백질의 3차 구조는 단백질을 이루는 곁사슬들의 소수성 결합에 의해 결정된다. 디설피드 결합이나 수소 결합등이 3차 구조를 더 안정시켜 주지만 3차 구조를 결정하는 가장 중요한 힘은 소수성 결합이다.
- 4차 구조: 단백질의 4차 구조는 여러 개의 폴리펩타이드가 소수성 결합에 의해 모여 하나의 단백질로 작용하는 것으로, 하나의 폴리펩타이드가 단백질로서 고유 역할을 하는 경우 존재하지 않기도 한다. 3차 구조와 마찬가지로 디설피드 결합과 수소결합, 이온 결합 등에 의해 더욱 안정해진다.
아미노산 서열이 복잡한 3차 구조를 이루는 과정을 단백질 접힘(Protein Folding)이라고 한다. 보통은 각자 단백질의 고유한 3차 구조는 그 아미노산 서열이 가질 수 있는 가장 자유 에너지가 낮은 상태이다. 또한 자유 에너지가 낮은 상태가 생물학적 기능을 수행하는 활성 상태이다.[출처 필요] 하지만 단백질은 이 보다 높은 에너지 상태에도 존재할 수가 있다. 단지 그 에너지가 높기에, 자연 상태에서 높은 에너지 상태에 존재하는 단백질의 양은 극히 소수에 불과하다.[출처 필요] 가장 안정한 상태에서 단백질의 구조가 완전히 풀리는 상태(2, 3, 4차 구조가 모두 사라진 상태)에 도달하는 데 필요한 에너지가 단백질의 열역학적인 안정성을 결정한다.
아미노산 서열의 양끝단을 N 말단과 C 말단이라고 한다. 이는 단백질의 한쪽 끝이 아미노기(-NH₂)를 가지고, 다른 쪽은 카복실기(-COOH)를 갖기에 붙여진 이름이다.
연구 방법
[편집]용액 내의 단백질 검출 방법은 뷰렛 반응 또는 크산토프로테인 반응을 이용하는 것이다.
단백질의 구조를 직접적으로 연구하는 방법은 X선 회절법이다. 단백질의 결정에 X선을 쬐어, 그 X선이 휘는 모양을 관측하여 구조에 대해 연구한다. 또한 고해상도의 원자간력 현미경(AFM; Atomic Force Microscope)을 이용하여 단백질의 구조를 직접적으로 관찰하기도 한다.
또한 단백질의 서열을 알기 위해서는 에드만 분해(Edman Degradation), 질량 분석법(Mass Spectrometry)등을 사용한다. 요즘에는 시간이 오래걸리는 에드만 분해보다는 질량 분석법을 주로 사용한다. 단백질 서열 분석에 질량 분석법을 사용하는 연구에 2002년 노벨 화학상이 시상되었다.
그 외에 전기영동(Electrophoresis), 분석(Assay)등 여러 가지 다양한 방법들을 통해 단백질을 연구한다.
역사
[편집]단백질은 18세기 앙투안 푸르크루아 등에 의해 독립적인 생물학적 분자들로 인식되었으며, 열기나 산(acid)을 이용한 치료를 통해 응고, 응집을 할 수 있는 분자의 능력으로 식별되었다.[2]
단백질은 네덜란드의 화학자 헤라르뒤스 요하네스 멀더에 의해 처음 기술되었으며 1838년 스웨덴의 화학자 야코브 베르셀리우스에 의해 명명되었다.[3][4]
같이 보기
[편집]각주
[편집]- ↑ 사마키 타케오 외 1 (2004). 《부엌에서 알 수 있는 거의 모든 것의 과학》. 구성회 옮김. 휘슬러. 13쪽. ISBN 89-90457-24-6.
- ↑ Thomas Burr Osborne (1909): The Vegetable Proteins, History pp 1 to 6, from archive.org
- ↑ Mulder GJ (1838). “Sur la composition de quelques substances animales”. 《Bulletin des Sciences Physiques et Naturelles en Néerlande》: 104.
- ↑ Harold H (1951). “Origin of the Word 'Protein.'”. 《Nature》 168 (4267): 244–244. Bibcode:1951Natur.168..244H. doi:10.1038/168244a0. ISSN 0028-0836.
외부 링크
[편집]- ProteinSequence.org Archived 2021년 1월 24일 - 웨이백 머신: 단백질 서열 포털 사이트
- 프로테오믹스 관련 전 세계 웹사이트