프로테아좀
프로테아좀(영어: proteasome)은 세포 내에서 여분의 단백질을 분해하고 재활용하는 거대 분자이자 '단백질 분해효소 복합체'다. 세포 내의 단백질이, 아직 알려지지 않은 기작에 의해 인지되어, 유비퀴틴과 결합을 하게 된다. 최소한 4개 이상으로 연결된 폴리유비퀴틴 사슬이 단백질과 결합을 하게 되면, 폴리유비퀴틴 인지 도메인을 갖고 있는 프로테아좀의 19S 부분과 결합을 하게 된다. 그 후, deubiquitinating enzyme에 의해 유비퀴틴은 단백질에서 떨어져 나간다. 프로테아좀에 붙어 있는 단백질은 defolding이 되어 프로테아좀의 20S 부분으로 들어가게 된다. 20S subunit은 protease 활성도를 갖고 있어서, 20S 안쪽으로 들어 오는 단백질을 작은 가닥의 아미노산 서열로 자르게 된다. 이렇게 잘린 아미노산 가닥은 일부는 class I MHC로 loading이 되어 presentation이 되고, 일부는 각각의 아미노산으로 분해되어 단백질 사용에 재사용된다.
구조[편집]

26S프로테아좀은 프로테아제 활성을 가진 관통형의 20S프로테아좀의 양쪽에 19S복합체가 2개 결합한 구조이다.
- 20S프로테아좀 (CP : core particle)
- 20S프로테아좀은 α소단위 7분자로 구성된 α-ring과 β소단위의 7분자로 구성된 β-ring이 αββα순으로 겹쳐진 관통구조를 하고있다. 안의 빈 공간은 단백질분해 장소로 β1, β2, β5가 각각 트립신(trypsin), 키모트립신(chymotrypsin), 펩타이딜-글루타밀 펩타이드(peptidyl-glutamyl peptide) 가수분해(PGPH) 활성을 가지고 있다. 보통 20S프로테아좀의 상태로는 α-ring이 닫혀 있어 기질이 안에 들어갈 수 없다. 20S 프로테아좀 분자집합은 PAC1, 2, 3, 4(Pba1, 2, 3, 4), Ump1 등 분자 샤페론에 의해 정상적으로 조립된다.[1]
- 19S복합체 (RP : regulatory particle, PA700)
- 관통형 20S프로테아좀 양끝에 결합해 뚜껑 역할을 한다. 19S복합체는 base와 lid로 구성되어 있다. Base는 Rpt1-6와 Rpn1-2 8개 단백질 분자로 구성되어 20S프로테아좀의 α-ring 개폐를 제어하고, 표적단백질을 펴는 것(unfolding)에 관여한다. lid는 Rpn3,5-9,11,12의 8개 단백질 분자로 구성되어 탈유비퀴틴화 반응에 관여한다. 또, base와 lid를 연결하는 rpn10 소단위는 표적단백질의 인식, 포착에 관여한다.
- 11S복합체(PA28)
- 11S복합체는 19S복합체와 같이 20S프로테아좀의 양 끝에 결합하는 8량체이다. ATPase활성을 가진 소단위를 가지고 있지 않고, 짧은 펩타이드 분해에 기여한다.
기작[편집]
유비퀴틴-프로테아솜 경로[편집]

- 표적단백질이 유비퀴틴활성화 효소(E1), 결합효소(E2), 전이효소(E3)에 의해 유비퀴틴화(Ubiquitination) 된다.
- 표적단백질에 결합한 유비퀴틴 사슬이 19S복합체에 결합한다.
- 표적단백질로부터 유비퀴틴사슬이 잘려 떨어진다. 잘려 떨어진 유비퀴틴은 재이용된다.
- 표적단백질의 입체구조가 풀려(unfolding) 20S프로테아솜 속으로 들어간다.
- β-ring내부의 프로테아제활성에 의해 표적단백질이 분해된다.
저해제[편집]
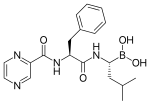
26S프로테아좀을 저해하는 bortezomib(VELCADE)는 혈액암의 일종인 다발성골수종에 유효한 것이 보고되어 항암제로 임상응용되고 있다.[2]。
각주[편집]
- ↑ Ramos PC, Dohmen RJ (2008). “PACemakers of proteasome core particle assembly”. 《Structure》 16 (9): 1296–304. doi:10.1016/j.str.2008.07.001. PMID 18786393.
- ↑ Fisher RI, Bernstein SH, Kahl BS, Djulbegovic B, Robertson MJ, de Vos S, Epner E, Krishnan A, Leonard JP, Lonial S, Stadtmauer EA, O'Connor OA, Shi H, Boral AL and Goy A.(2006)"Multicenter phase II study of bortezomib in patients with relapsed or refractory mantle cell lymphoma."J.Clin.Oncol. 24,4867–74. PMID 17001068
| 이 글은 생물학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |
