핵산의 2차 구조
핵산의 2차 구조(Nucleic acid Secondary Structure)는 단일 핵산 중합체 내에서 또는 2개의 중합체 사이의 염기쌍 상호 작용이다. 그것은 핵산 분자에서 쌍을 이루는 염기의 목록으로 표현 될 수 있다.[1] 생물학적 DNA와 RNA의 2차 구조는 서로 다르다. 생물학적 DNA는 대부분 완전 염기쌍 이중 나선으로 존재하는 반면, 생물학적 RNA는 단일 가닥이며 종종 복잡한 염기쌍 상호 작용을 형성한다. 리보스에서 여분의 하이드록시기에서 유래하는 수소 결합을 형성한다.
기본 개념[편집]
염기쌍[편집]
분자 생물학에서, 상보적인 DNA 또는 RNA 가닥 상에서 수소 결합을 통해 결합된 2개의 뉴클레오타이드를 염기쌍(base pair, bp)라고 한다. 표준 왓슨과 크릭 염기쌍에서, 아데닌(A)은 티민(T)과 염기쌍을 형성하고 구아닌(G)은 DNA에서 사이토신(C)과 염기쌍을 형성한다. RNA에서 티민은 유라실(U)로 대체된다. 워블 염기쌍과 후그스틴 염기쌍과 같은 대체 수소 결합 패턴도 발생하며, 특히 RNA에서는 복잡하고 기능적인 핵산의 3차 구조를 발생시킨다. 중요하게도 결합은 전령 RNA에 있는 코돈들이 단백질 변환 중에 운반 RNA에 있는 안티코돈에 의해 인식되는 메커니즘이다. 일부 DNA 결합 효소, RNA 결합 효소는 유전자의 특정 조절 영역을 식별하는 특정 염기쌍 패턴을 인식 할 수 있다. 수소 결합은 위에서 설명한 염기쌍 규칙을 따르는 기본적은 화학적 메커니즘이다. 수소 결합 공여체 및 수용체의 적절한 기하학적 대응은 올바른 염기만이 안정적으로 형성 될 수 있게한다. 높은 G+C 함량을 갖는 DNA는 낮은 G+C 함량을 갖는 DNA보다 더 안정적이지만, 일반적인 생각과는 달리, 수소 결합은 DNA를 크게 안정화시키지 않으며 안정화는 주로 스택 상호 작용에 기인한다.[2]
더 큰 핵염기인 아데닌과 구아닌은 퓨린(purine)이라고 불리는 이중 고리 화학 구조의 구성원이다. 더 작은 핵염기, 사이토신 및 티민(RNA에서는 우라실)은 피리미딘(pyrimidines)이라 불리는 단일 고리형 화학 구조의 구성원이다. 퓨린과 피리미딘은 서로 상보적이다. 피리미딘-피리미딘 쌍은 수소 결합이 확립되기에는 분자 사이가 너무 멀리 떨어져 있기 때문에 에너지적으로 불리하다. 또한 퓨린-퓨린 쌍은 분자가 너무 가까워서 반발력이 심하기 때문에 에너지적으로 불리하다. 따라서 가능한 다른 쌍은 퓨린-피리미딘 쌍인 G+C와 A+T이다.
핵산 혼성화[편집]
핵산의 혼성화는 이중 나선을 형성하기 위해 상보적인 염기쌍과의 결합 과정이다. Melting은 이중 나선의 가닥 사이의 상호 작용이 파괴되어 2개의 핵산 가닥으로 분리시키는 과정이다. 이 결합은 약한 열, 효소 또는 물리적 힘에 의해 쉽게 분리된다. 핵산의 특정 지점에서 Melting이 우선적으로 일어난다.[3] T, A 풍부 서열은 C, G 풍부 영역보다 더 쉽게 Melting된다. 또한 특정 염기 단계는 DNA Melting, 특히 TA 및 TG 염기 단계에 영향을 받기 쉽다.[4] 이러한 기계적 특징은 전사를 위해 DNA를 Melting하는 RNA 중합 효소를 돕기 위해 많은 유전자의 시작에서 TATAA(TATA 박스)와 같은 서열의 사용에 의해 반영된다.
중합효소 연쇄 반응(PCR)에 사용된 온화한 가열에 의한 가닥 분리는 분자가 약 10,000개 미만의 염기쌍(10 킬로베이스 쌍 또는 10kbps)을 제공한다. DNA 가닥의 얽힘은 긴 세그먼트를 분리하기 어렵게 만든다. 그래서 세포는 DNA Melting 효소(헬리케이스)가 DNA 회전효소와 동시에 작용하게하여 이 가닥 중 하나의 인산염 골격을 화학적으로 절단하여 다른 주위 공간으로 회전 할 수 있게 함으로써 이 문제를 피한다. 헬리케이스는 가닥을 풀어 DNA 중합효소와 같은 서열-판독 효소의 진행을 촉진시킨다.
2차 구조 모티프[편집]

핵산의 2차 구조는 일반적으로 나선(연속 염기쌍)과 다양한 종류의 루프(나선으로 둘러싸인 짝을 이루지 않은 뉴클레오타이드)로 나뉜다. 종종 이들 요소 또는 이들의 조합은, 테트라루프, 슈도 노트 및 스템-루프를 포함하는 추가 카테고리로 추가로 분류된다.
이중 나선[편집]
이중 나선(Double Helix)은 DNA의 2차 구조와 밀접하게 연결된 핵산 분자에서 중요한 핵산의 3차 구조이다. 이중 나선은 다수의 연속적인 염기쌍의 영역에 의해 형성된다.
핵산 이중 나선은 쌍을 이루는 2개의 뉴클레오타이드 가닥을 포함하는 나선형 폴리머이며, 보통 시계 방향으로 회전한다. 나선의 단일 회전은 약 10개의 뉴클레오타이드를 구성하고, 메이저 그루브(Major Groove) 및 마이너 그루브(Minor Groove)를 포함하며, 메이저 그루브는 마이너 그루브보다 넓다.[5] 메이저 그루브와 마이너 그루브의 폭의 차이를 고려할 때, DNA에 결합하는 많은 단백질은 메이저 그루브에 결합하는 경향이 크다. DNA의 경우 생물학적으로 관련된 세 가지 형태는 A-DNA, B-DNA 및 Z-DNA이며 RNA 이중 나선은 A 형태의 DNA와 유사한 구조를 갖는다.[6]
스템-루프 구조[편집]

종종 핵산 분자의 2차 구조는 줄기와 고리로 독특하게 분해 될 수 있다. 염기쌍을 이루는 나선이 짧고 짝이 없는 고리로 끝나는 스템-루프 구조(Stem-Loop, 종종 헤어핀이라고도 함)는 매우 일반적이며 클로버 잎 구조와 같은 더 큰 구조적 모티프이다. 운반 RNA에서 발견되는 것과 같은 4-나선 접합이 그 예이다. 내부 루프(더 긴 쌍의 나선에 있는 짧은 일련의 짝이 없는 베이스)와 벌지(나선의 한 가닥이 반대쪽 가닥에 상대가 없는 추가 삽입된 염기가 있는 영역)도 자주 발생한다.
생물학적 RNA에는 기능적으로 중요한 2차 구조 요소가 있다. 그 예는 Rho-독립적 종료기, 운반 RNA의 cloverleaf 구조이다. 실험 및 계산 방법을 포함한 접근 방식으로 RNA 분자의 2차 구조를 결정하기 위한 적극적인 연구가 진행 중이다(RNA 구조 예측 소프트웨어 목록 참조).
슈도 노트[편집]
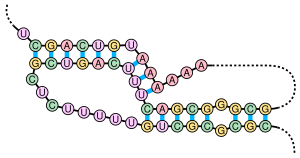
슈도 노트(Pseudoknot)는 하나의 줄기의 절반이 다른 줄기의 두 절반 사이에 삽입되는, 적어도 두 개의 스템-루프 구조를 포함하는 핵산의 2차 구조이다. 슈도 노트는 매듭 모양의 3차원 형태로 접히지만 실제 위상적 매듭은 아니다. 슈도 노트의 염기쌍은 잘 중첩되지 않는다.
슈도 노트는 촉매 활성을 갖는 다양한 구조를 형성 할 수 있으며[8], 몇 가지 중요한 생물학적 과정은 슈도 노트를 형성하는 RNA 분자에 의존한다. 예를 들어, 인간 텔로머레이스의 RNA 요소는 그 활성에 중요한 슈도 노트를 함유한다.[7] 간염 델타바이러스 리보자임은 활성 부위에 슈도 노트를 갖는 촉매 RNA의 잘 알려진 예이다.[9][10] 또한 DNA는 슈도 노트를 형성할 수 있지만, 일반적인 생체 조건에서는 존재하지 않는다.
2차 구조 예측[편집]
이 문단은 비어 있습니다. 내용을 추가해 주세요. |
각주[편집]
- ↑ Dirks, Robert M.; Lin, Milo; Winfree, Erik & Pierce, Niles A. (2004). “Paradigms for computational nucleic acid design”. 《Nucleic Acids Research》 32 (4): 1392–1403. doi:10.1093/nar/gkh291. PMC 390280. PMID 14990744.
- ↑ Yakovchuk, Peter; Protozanova, Ekaterina; Frank-Kamenetskii, Maxim D. (2006). “Base-stacking and base-pairing contributions into thermal stability of the DNA double helix”. 《Nucleic Acids Research》 34 (2): 564–574. doi:10.1093/nar/gkj454. PMC 1360284. PMID 16449200.
- ↑ “Predicting DNA duplex stability from the base sequence”. 《PNAS》 83 (11): 3746–3750. 1986. Bibcode:1986PNAS...83.3746B. doi:10.1073/pnas.83.11.3746. PMC 323600. PMID 3459152.
- ↑ Richard Owczarzy (2008년 8월 28일). “DNA melting temperature - How to calculate it?”. 《High-throughput DNA biophysics》. owczarzy.net. 2015년 4월 30일에 원본 문서에서 보존된 문서. 2008년 10월 2일에 확인함.
- ↑ Alberts; 외. (1994). 《The Molecular Biology of the Cell》. New York: Garland Science. ISBN 978-0-8153-4105-5.
- ↑ “Protein-DNA recognition”. 《Annu Rev Biochem》 53: 293–321. 1984. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ 가 나 “Functional analysis of the pseudoknot structure in human telomerase RNA”. 《Proc Natl Acad Sci USA》 102 (23): 8080–5. 2005. Bibcode:2005PNAS..102.8080C. doi:10.1073/pnas.0502259102. PMC 1149427. PMID 15849264.
- ↑ Staple, David W.; Butcher, Samuel E. (2005년 6월 14일). “Pseudoknots: RNA Structures with Diverse Functions”. 《PLOS Biol》 3 (6): e213. doi:10.1371/journal.pbio.0030213. ISSN 1545-7885. PMC 1149493. PMID 15941360.
- ↑ Doudna, Jennifer A.; Ferré-D'Amaré, Adrian R.; Zhou, Kaihong (October 1998). “Crystal structure of a hepatitis delta virus ribozyme”. 《Nature》 395 (6702): 567–574. Bibcode:1998Natur.395..567F. doi:10.1038/26912. PMID 9783582.
- ↑ Lai, Michael M. C. (1995년 6월 1일). “The Molecular Biology of Hepatitis Delta Virus”. 《Annual Review of Biochemistry》 64 (1): 259–286. doi:10.1146/annurev.bi.64.070195.001355. ISSN 0066-4154. PMID 7574482.


