아이소류신
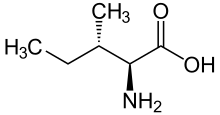 L-아이소류신의 골격 구조식
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
isoleucine
| |||
| 별칭
(2S,3S)-2-amino-3-methylpentanoic acid
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.726 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C6H13NO2 | |||
| 몰 질량 | 131.175 g·mol−1 | ||
자화율 (χ)
|
−84.9·10−6 cm3/mol | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
아이소류신(영어: isoleucine) (기호: Ile 또는 I)[1]은 단백질의 생합성에 사용되는 α-아미노산이다. 아이소류신은 α-아미노기(생물학적 조건에서 양성자화된 −NH+
3 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 가지가 있는 탄화수소 곁사슬(3개의 다른 탄소 원자에 결합된 중심 탄소 원자)를 포함하고 있다. 아이소류신은 비극성, 비전하(생리학적 pH에서), 가지사슬, 지방족 아미노산으로 분류된다. 아이소류신은 사람에게 필수적인 아미노산으로 신체에서 합성되지 않으며 음식을 통해 섭취해야 한다. 아이소류신은 세균과 같은 다른 생물체에서 류신 생합성 효소들을 사용하여 피루브산으로부터 합성될 수 있다.[2] 아이소류신은 AUU, AUC, AUA 코돈에 의해 암호화되어 있다.
물질대사
[편집]생합성
[편집]필수 영양소로서 아이소류신은 체내에서 합성되지 않기 때문에 일반적으로 단백질의 구성 요소로 섭취해야 한다. 식물과 미생물에서 아이소류신은 피루브산과 α-케토뷰티르산에서부터 시작하여 여러 단계를 거쳐 합성된다. 아이소류신의 생합성에 관여하는 효소들은 다음과 같다.[3]
- 아세토락트산 생성효소 (또한 아세토하이드록시산 생성효소라고도 함)
- 아세토하이드록시산 아이소머로리덕테이스
- 다이하이드록시산 탈수효소
- 발린 아미노기전이효소
분해
[편집]아이소류신은 포도당생성성 아미노산이면서 케톤체생성성 아미노산이다. 아이소류신은 α-케토글루타르산으로 아미노기 전이 후에 탄소 골격은 산화되어 프로피오닐-CoA와 아세틸-CoA로 분해된다. 프로피오닐-CoA는 시트르산 회로의 대사 중간생성물인 석시닐-CoA로 전환되며, 석시닐-CoA는 포도당신생합성을 위해 옥살로아세트산으로 전환(따라서 포도당생성성 아미노산)될 수 있다. 포유류에서 아세틸-CoA는 탄수화물로 전환될 수 없지만, 옥살로아세트산과 축합하여 시트르산을 형성함으로써 시트르산 회로에 공급되거나 케톤체(따라서 케톤체생성성 아미노산) 또는 지방산의 합성에 사용될 수 있다.[4]
인슐린 저항성
[편집]다른 가지사슬 아미노산들과 마찬가지로 아이소류신은 인슐린 저항성과 관련이 있다. 당뇨병에 걸린 쥐 및 사람의 혈액에서 높은 수준의 아이소류신이 관찰된다.[5] 하루 동안 아이소류신이 결핍된 먹이를 섭취한 쥐는 인슐린 감수성이 개선되었으며, 1주일 동안 아이소류신이 결핍된 먹이를 섭취한 쥐는 혈당 수치가 유의미하게 감소되었다.[6] 식이로 유발된 비만 및 인슐린 저항성 쥐에서 아이소류신의 수치가 감소된 식이(다른 가지사슬 아미노산의 유무에 관계없이)는 지방 감소 및 인슐린 감수성의 개선을 초래한다.[7][8] 저단백질 식이의 유익한 대사 효과를 위해서는 아이소류신의 섭취를 줄이는 것이 필요하다.[8] 사람의 경우 단백질을 제한한 식단은 아이소류신의 혈중 농도를 낮추고 공복 혈당 수치를 감소시킨다.[9] 사람의 경우 아이소류신의 식이 수준이 높아질수록 체질량 지수가 높아진다.[8]
필요 요건
[편집]미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다. 19세 이상의 성인의 경우 매일 체중 1 kg당 19 mg의 아이소류신이 필요하다.[10]
영양 공급원
[편집]아이소류신은 동물에서 생성되지는 않지만 다량으로 저장된다. 다량의 아이소류신이 함유된 식품에는 계란, 콩 단백질, 해조류, 칠면조, 닭고기, 양고기, 치즈 및 생선이 있다.[11]
이성질체
[편집]일반명 아이소류신 D-아이소류신 L-아이소류신 DL-아이소류신 D-알로아이소류신 L-알로아이소류신 DL-알로아이소류신 동의어 (R)-아이소류신 L(+)-아이소류신 (R*,R*)-아이소류신 알로아이소류신 PubChem (영어) 아이소류신 - PubChem (영어) 아이소류신 - PubChem (영어) 아이소류신 - PubChem (영어) 아이소류신 - PubChem EINECS 번호 207-139-8 206-269-2 200-798-2 216-143-9 216-142-3 221-464-2 CAS 등록번호 443-79-8 319-78-8 73-32-5 1509-35-9 1509-34-8 3107-04-8
합성
[편집]아이소류신은 2-브로모뷰테인과 말론산 다이에틸로부터 시작되는 다단계 반응으로부터 합성될 수 있다.[12] 합성 아이소류신은 1905년에 프랑스의 화학자 루이 보우볼트에 의해 처음으로 보고되었다.[13]
독일의 화학자 펠릭스 에를리히는 1903년에 헤모글로빈에서 아이소류신을 발견했다.
같이 보기
[편집]각주
[편집]- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ Kisumi M, Komatsubara S, Chibata I (July 1977). “Pathway for isoleucine formation form pyruvate by leucine biosynthetic enzymes in leucine-accumulating isoleucine revertants of Serratia marcescens”. 《Journal of Biochemistry》 82 (1): 95–103. doi:10.1093/oxfordjournals.jbchem.a131698. PMID 142769.
- ↑ Nelson DL, Cox MM (2000). 《Lehninger, Principles of Biochemistry》 3판. New York: Worth Publishing. ISBN 1-57259-153-6.
- ↑ Cole, Jeffrey T. (2014년 11월 14일). 〈Chapter 2: Metabolism of BCAAs〉 (PDF). Rajendram, Rajkumar; Preedy, Victor R.; Patel, Vinood B. 《Branched Chain Amino Acids in Clinical Nutrition》 1. ISBN 978-1-4939-1923-9. 2018년 2월 14일에 원본 문서 (PDF)에서 보존된 문서. 2022년 6월 7일에 확인함.
- ↑ Lynch CJ, Adams SH (December 2014). “Branched-chain amino acids in metabolic signalling and insulin resistance”. 《Nature Reviews. Endocrinology》 10 (12): 723–36. doi:10.1038/nrendo.2014.171. PMC 4424797. PMID 25287287.
- ↑ Xiao F, Yu J, Guo Y, Deng J, Li K, Du Y, 외. (June 2014). “Effects of individual branched-chain amino acids deprivation on insulin sensitivity and glucose metabolism in mice”. 《Metabolism》 63 (6): 841–50. doi:10.1016/j.metabol.2014.03.006. PMID 24684822.
- ↑ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, 외. (February 2018). “Restoration of metabolic health by decreased consumption of branched-chain amino acids”. 《The Journal of Physiology》 596 (4): 623–645. doi:10.1113/JP275075. PMC 5813603. PMID 29266268.
- ↑ 가 나 다 Yu D, Richardson NE, Green CL, Spicer AB, Murphy ME, Flores V, 외. (May 2021). “The adverse metabolic effects of branched-chain amino acids are mediated by isoleucine and valine”. 《Cell Metabolism》 33 (5): 905–922.e6. doi:10.1016/j.cmet.2021.03.025. PMC 8102360. PMID 33887198.
- ↑ Fontana L, Cummings NE, Arriola Apelo SI, Neuman JC, Kasza I, Schmidt BA, 외. (July 2016). “Decreased Consumption of Branched-Chain Amino Acids Improves Metabolic Health”. 《Cell Reports》 16 (2): 520–530. doi:10.1016/j.celrep.2016.05.092. PMC 4947548. PMID 27346343.
- ↑ Institute of Medicine (2002). 〈Protein and Amino Acids〉. 《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽.
- ↑ “Foods highest in Isoleucine”. 《Self Nutrition Data》. Condé Nast.
List is in order of highest to lowest of per 200 Calorie serving of the food, not volume or weight.
- ↑ Marvel, C. S. (1941). “dl-Isoleucine (α-Amino-β-methylvaleric acid)”. 《Organic Syntheses》 21: 60. doi:10.15227/orgsyn.021.0060.; 《Collective Volume》 3, 495쪽
- ↑ Bouveault, L.; Locquin, R. (1905). “Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse” [Effect of sodium on the ethers of single-function monobasic acids of the fatty series]. 《Compt. Rend.》 (프랑스어) 140: 1593–1595.