탄소: 두 판 사이의 차이
잔글 봇: 틀 이름 및 스타일 정리 |
InternetArchiveBot (토론 | 기여) 1 개의 출처 구조, 0 개의 링크를 깨진 것으로 표시 #IABot (v2.0beta10) |
||
| 1번째 줄: | 1번째 줄: | ||
{{원소 정보/탄소}} |
{{원소 정보/탄소}} |
||
'''탄소'''(炭素←{{llang|ja|炭素|단소}}, {{llang|en|Carbon|카번}})는 [[주기율표]]에서 기호는 '''C'''(←{{llang|la|Carbonium|카르보니움}})이고 [[원자번호]]는 6인 [[화학 원소]]이다. [[비금속]] 원소이며, 4개의 공유결합을 형성할 수 있는 [[원자가 전자]]가 4개인 원소이다. 존재하는 동위 원소는 총 3개이지만, [[탄소-12|{{위 첨자|12}}C]]와 [[탄소-13|{{위 첨자|13}}C]]가 안정적인 동위 원소인 반면에 [[탄소-14|{{위 첨자|14}}C]]는 [[반감기]]가 약 5730년인 [[방사성 동위 원소]]이다.<ref name="isotopes">{{웹 인용|url=http://www.webelements.com/webelements/elements/text/C/isot.html|title=Carbon – Naturally occurring isotopes|publisher=WebElements Periodic Table|accessdate=2008-10-09}}</ref> 탄소는 [[원소 발견 역사|아주 오래 전에 존재가 밝혀진 원소들]] 중 하나이다.<ref name=D2>{{웹 인용|url=http://www.caer.uky.edu/carbon/history/carbonhistory.shtml|title=History of Carbon|accessdate=2013-01-10}}</ref> |
'''탄소'''(炭素←{{llang|ja|炭素|단소}}, {{llang|en|Carbon|카번}})는 [[주기율표]]에서 기호는 '''C'''(←{{llang|la|Carbonium|카르보니움}})이고 [[원자번호]]는 6인 [[화학 원소]]이다. [[비금속]] 원소이며, 4개의 공유결합을 형성할 수 있는 [[원자가 전자]]가 4개인 원소이다. 존재하는 동위 원소는 총 3개이지만, [[탄소-12|{{위 첨자|12}}C]]와 [[탄소-13|{{위 첨자|13}}C]]가 안정적인 동위 원소인 반면에 [[탄소-14|{{위 첨자|14}}C]]는 [[반감기]]가 약 5730년인 [[방사성 동위 원소]]이다.<ref name="isotopes">{{웹 인용|url=http://www.webelements.com/webelements/elements/text/C/isot.html|title=Carbon – Naturally occurring isotopes|publisher=WebElements Periodic Table|accessdate=2008-10-09}}</ref> 탄소는 [[원소 발견 역사|아주 오래 전에 존재가 밝혀진 원소들]] 중 하나이다.<ref name=D2>{{웹 인용|url=http://www.caer.uky.edu/carbon/history/carbonhistory.shtml|title=History of Carbon|accessdate=2013-01-10|보존url=https://web.archive.org/web/20121101085829/http://www.caer.uky.edu/carbon/history/carbonhistory.shtml#|보존날짜=2012-11-01|깨진링크=예}}</ref> |
||
탄소는 [[지구 지각 내 원소 함량|지각을 구성하는 원소]]들 중에 15번째로 풍부하며, 우주에서 [[수소]], [[헬륨]], [[산소]] 다음인 [[원소 존재 비율|4번째로 풍부한 원소]]이다. 이렇게 탄소는 풍부하며, 탄소 화합물로서 다양한 유기 화합물을 구성할 수도 있고, 상온 상태에서 [[중합체]]를 형성할 수도 있기 때문에 우리 삶은 탄소와 밀접한 관련이 있다. 예로서 탄소는 우리 몸에서 [[산소]] 다음인 두 번째로 풍부한 원소(18.5%)이다. <ref>{{웹 인용|url=http://www.daviddarling.info/encyclopedia/E/elbio.html|제목=Biological Abundance of Elements|저자=The Internet Encyclopedia of Science|날짜=2008-10-09}}</ref> |
탄소는 [[지구 지각 내 원소 함량|지각을 구성하는 원소]]들 중에 15번째로 풍부하며, 우주에서 [[수소]], [[헬륨]], [[산소]] 다음인 [[원소 존재 비율|4번째로 풍부한 원소]]이다. 이렇게 탄소는 풍부하며, 탄소 화합물로서 다양한 유기 화합물을 구성할 수도 있고, 상온 상태에서 [[중합체]]를 형성할 수도 있기 때문에 우리 삶은 탄소와 밀접한 관련이 있다. 예로서 탄소는 우리 몸에서 [[산소]] 다음인 두 번째로 풍부한 원소(18.5%)이다. <ref>{{웹 인용|url=http://www.daviddarling.info/encyclopedia/E/elbio.html|제목=Biological Abundance of Elements|저자=The Internet Encyclopedia of Science|날짜=2008-10-09}}</ref> |
||
2018년 11월 11일 (일) 04:20 판
 탄소의 동소체, 흑연(좌)과 다이아몬드(우) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 라틴어명 | Carbonium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 한자명 | 炭素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량 (Ar, standard) | [12.0096, 12.0116] 12.011 (보편) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 14족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 2주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | p-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 반응성 비금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
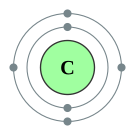
| 준위별 전자 수 | 2, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 검은색(흑연) 무색(다이아몬드) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | (다이아몬드) 3823.15 K (흑연) 3948.15 K (비결정) 3948.15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | (승화) (흑연) 4300 K (다이아몬드) 5100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | (흑연) 2.267 g·cm−3 (다이아몬드) 3.513 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 삼중점 | 4600 K, 10,800 kPa[1][2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | (흑연) 117 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | (흑연) 8.517 J/(mol·K) (25 °C) (다이아몬드) 6.115 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 4, 2 (약한 산성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 2.55 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 70 pm (실험값) 67 pm (계산값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 77 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 (흑연) | 육방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 (다이아몬드) | 다이아몬드 입방정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | (흑연) (119-165) W/(m·K) (다이아몬드) (900-2320) W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 정렬 | 반자성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 굳기계 | (흑연) 0.5 (다이아몬드) 10.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-44-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
탄소(炭素←일본어: 炭素 단소[*], 영어: Carbon 카번[*])는 주기율표에서 기호는 C(←라틴어: Carbonium 카르보니움[*])이고 원자번호는 6인 화학 원소이다. 비금속 원소이며, 4개의 공유결합을 형성할 수 있는 원자가 전자가 4개인 원소이다. 존재하는 동위 원소는 총 3개이지만, 12C와 13C가 안정적인 동위 원소인 반면에 14C는 반감기가 약 5730년인 방사성 동위 원소이다.[3] 탄소는 아주 오래 전에 존재가 밝혀진 원소들 중 하나이다.[4]
탄소는 지각을 구성하는 원소들 중에 15번째로 풍부하며, 우주에서 수소, 헬륨, 산소 다음인 4번째로 풍부한 원소이다. 이렇게 탄소는 풍부하며, 탄소 화합물로서 다양한 유기 화합물을 구성할 수도 있고, 상온 상태에서 중합체를 형성할 수도 있기 때문에 우리 삶은 탄소와 밀접한 관련이 있다. 예로서 탄소는 우리 몸에서 산소 다음인 두 번째로 풍부한 원소(18.5%)이다. [5]
탄소는 흑연, 다이아몬드, 비정질 탄소 같은 다양한 동소체를 가지고 있다. [6] 탄소의 물리적 성질은 동소체에 따라 다르다. 예를 들면, 흑연은 불투명한 검은색이지만 다이아몬드는 매우 투명하다. 흑연은 종이에다 이름을 적을 수 있을 정도로 연하지만 다이아몬드는 천연물 중에서는 가장 단단한 물질이다. 흑연은 좋은 전기 전도체이지만 다이아몬드는 전기 전도도가 낮다. 일반적으로 다이아몬드, 탄소 나노 튜브, 흑연은 알려진 모든 물질 중에서 가장 높은 열전도율을 가진다. 모든 탄소 동소체들은 상온에서 고체이며, 흑연은 열역학으로 가장 안정한 구조이다. 또한 화학적 저항력이 강하며, 반응성이 큰 산소와 반응할 때도 고온이 필요하다.
무기화합물에서 탄소의 산화수는 일반적으로 +4이다. 다만 예외적으로 일산화 탄소와 전이금속 카보닐 복합체는 산화수가 +2이다. 무기 탄소화합물은 석회암, 백운암, 이산화 탄소가 대부분이지만, 석탄, 이탄, 석유, 메테인 하이드레이트 같은 유기적 침전물에도 상당히 많다. 탄소는 다른 원소와 비교해서 수많은 화합물을 결합한다. 표준 조건 하에서 이론적으로 가능한 화합물은 밝혀진 것만 거의 1천만 개 정도이다. [7] 그래서 탄소는 종종'원소의 제왕'이라고 불렸다.[8]
역사
탄소는 유사 이전부터 목탄의 형태로 사용되어 왔으며, “carbon”이라는 이름은 숯을 뜻하는 라틴어 carbo에서 왔다. 이 이름은 라부아지에가 명명하였다. 한자어 탄소(炭素)는 독일어 Kohlenstoff에서 유래하였다.
주요 화합물
CO2(이산화탄소), CO(일산화탄소), CH4(메테인), C6H12O6(포도당), C2H6(에테인), 탄화수소 등과 같은 상당수기 유이 이에 해당한다. 그러나 오늘날에는 탄소가 포함되어 있다 하더라도, 무조건 탄소가 있다고 해서 유기물이 될 수 있는 것은 아니다. 이것은 일산화탄소는 무기물에 해당되기 때문이다. 따라서 오늘날에는 홑원소물질인 탄소, 산화탄소, 금속의 탄산염, 시안화물·탄화물 등을 제외한 탄소화합물을 총칭한 분자를 유기물로 본다.
특성

탄소 동소체에는 부드러운 흑연과 가장 단단한 자연물인 다이아몬드가 있다. 탄소 원자는 같은 탄소 원자는 물론 다른 원자와 쉽게 화학 결합을 하며, 적합한 다가 원자와 안정된 다양한 공유 결합을 이룰 수 있다. 발견된 화합물의 거의 대부분은 약 1천만 개로 추정되는 탄소 화합물이다.[7] 탄소는 가장 높은 승화점을 가지고 있는 원소이다. 삼중점은 10.8 ± 0.2 MPa에 4,600 ± 300 K (~4,330 °C or 7,820 °F)으로 대기압에서 녹는점이 없고, [1][2] 3,900 K의 승화점을 가진다. [9][10] 흑연은 열역학적으로 안정하지만 결합에 취약한 전이된 파이 결합 때문에 표준 조건에서 다이아몬드보다 반응성이 훨씬 뛰어나다. 예를 들면, 표준 조건에서 높은 온도의 진한 질산은 흑연의 육각형 구조를 보존하는 대신 더 큰 구조를 분해하면서 흑연을 C6(CO2H)6의 멜리트산으로 산화시킨다. [11]
탄소는 온도 5,800 K (5,530 °C; 9,980 °F)의 탄소 아크로 승화한다. 따라서, 동소체꼴에 상관없이 탄소는 텅스텐과 레늄 같이 가장 높은 녹는점을 가진 금속의 녹는점에서도 고체 상태를 유지한다. 열역학적으로 산화되기 쉬우나, 탄소는 철이나 구리 같이 표준 조건에서 약한 환원제로 작용하는 원소보다 산화에 더 효과적으로 저항한다.
탄소는 여섯 번째 원소로, 바닥 상태 전자 배열은 1s22s22p2이며 원자가 전자는 4개이다. 1~4차 이온화 에너지는 1086.5, 2352.6, 4620.5, 6222.7 kJ/mol로 3~7족의 같은 14족 원소보다 크다. 탄소의 전기음성도는 2.5로, 마찬가지로 같은 14족 원소(1.8~1.9)보다 훨씬 크지만 대부분의 인근 비금속과 2~3주기의 전이 금속과 가까운 수치다. 탄소의 공유 반지름은 배위수와 결합한 원자에 따라 다양하지만 평균적으로 77.2 pm (C–C), 66.7 pm (C=C), 60.3 pm (C≡C)이다. 일반적으로 공유 반지름은 배위수가 낮을수록, 결합 차수가 높을 수록 감소한다.[12]
탄소 화합물은 지구상 모든 생물들의 삶에 근본적으로 영향을 끼치며, 탄소-질소 순환은 태양과 여러 별들에 의해 만들어진 에너지를 제공해주는 역할을 한다. 다양한 화합물을 형성하지만 대체로 표준 조건에서는 상대적으로 반응성이 낮다. 표준 온도 압력에서 매우 강한 산화제를 제외하고는 반응성이 낮다. 황산, 염산, 염소, 그리고 다른 알칼리 금속과 반응하지 않는다. 고온에서 탄소는 산소와 반응하여 일산화 탄소를 형성하며, 금속 산화물을 환원시킨다. 이 발열 반응은 제철 산업에서 철을 제련하고 강철의 탄소 함량을 조절하기 위해 다음과 같이 쓰인다.
- Fe
3O
4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
다음은 탄소의 기체와의 반응으로, 황과 반응시 이황화탄소를, 수증기와 반응시 일산화탄소를 생성한다.
- C(s) + H2O(g) → CO(g) + H2(g).
탄소는 고온에서 일부 금속과 결합하여 강철에서의 철 탄화물인 시멘타이트나, 연마제로나 바이트로 끝을 강화하는데 쓰이는 탄화텅스텐 같은 금속 탄화물을 형성한다.
탄소 동소체는 서로 매우 다른 특성을 가지고 있다.
| 흑연은 매우 부드러운 물질 중 하나이다. | 인조 초고경도 다이아몬드는 매우 단단한 물질이다.[13] |
| 흑연은 극평활 특성을 지녀 매우 좋은 평활제이다.[14] | 다이아몬드는 최고의 연마제이다. |
| 흑연은 전기 전도체이다.[15] | 다이아몬드는 우수한 전기 절연체이며[16], 그 어떤 물질 보다 최고의 파괴전계영역을 자랑한다. |
| 흑연은 방화, 열 차폐 등으로 단열재로 쓰이기도 하지만, 어떤 구조로는 좋은 열 전도체로 쓰일 수도 있다. | 다이아몬드는 자연물 중에서는 알려진 가장 좋은 열전도체이다. |
| 흑연은 불투명하다. | 다이아몬드는 매우 투명하다. |
| 흑연은 육방정계의 결정을 형성한다.[17] | 다이아몬드는 등축정계의 결정을 형성한다. |
| 비정질 탄소는 완벽한 등방성 광물이다. | 탄소 나노튜브는 가장 잘 알려진 이방성 광물 중 하나이다. |
그리고 물리학에서 탄소는 원자간의 상대 질량을 나타내는 기본 단위로서의 역할을 한다(12C, 즉 탄소 12를 12로 기준함. 이에 적용하면 수소 원자의 질량은 1이 됨).
그리고 자연에 미량으로 존재하는 14C, 즉 탄소 14는 방사성 원소로서 5730년의 반감기를 통하여 14N으로 변환되는 현상(반감기가 지나면 양이 절반씩 줄어든다)을 이용하여 약 500~5만 년 정도의 화석이나 고고학적 표본의 연대를 측정하는 방사성 탄소연대 측정법에 사용한다. 생물이 살아있을 때는 방사성 탄소도 계속 공급되다가 생물이 죽으면 더이상 탄소가 공급되지 않아 방사성 탄소의 양이 더이상 늘어나지 않고 14N로 변화한다.
유기물
유기물(유기 화합물, organic Compounds)는 구조의 기본 골격으로 탄소 원자를 갖는 화합물을 통칭한다. 이에 반하여 무기물(무기 화합물, Inorganic Compunds)은 탄소를 포함하지 않는 화합물의 통칭이나, 영어 명칭에서 보듯이, 유기물은 생명체의 활동에 의해 생기는 것이라는 의미로 생성된 명칭이어서, 탄소를 포함하지만 생물 유래가 아닌 화합물은 무기물로 분류한다.
동소체
탄소는 원자끼리의 결합 방식에 따라 다음과 같은 여러 가지 동소체가 존재한다.
- 다이아몬드(자연계에서 가장 단단한 광물)
- 흑연
- 그래핀
- 풀러렌
- Chaoite - 운석 충돌로 만들어진 광물
- Lonsdaleite
- 어모퍼스 탄소
- 탄소 나노폼
- 탄소 나노튜브
- 응집 다이아몬드 나노막대
- 그을음
- 'Glassy carbon'
탄산
앙금 생성 반응을 통해 산출되는 탄산 칼슘, 탄산 바륨 등은 흰색 앙금이며, 이 앙금들은 산과 쉽게 반응하여 이산화 탄소 와 물을 발생한다. 따라서 탄산 이온(CO32-)을 검출할 때, 이러한 앙금이 유용하다.
용도
유기물
생명 현상을 유지하는 데 필요한 기본적인 화합물로서, 사람뿐만이 아닌 모든 생명 활동의 기본으로 수많은 유기물이 존재하고, 생물체가 유기물을 사용된다.
무기물
탄소를 포함하지만 무기물로 분류된 화합물 중 대표적인 것이 이산화탄소인데, 최근 지구 온난화와 관련하여 탄소 배출권 등의 형태로 사용량을 규제하려는 움직임이 커지고 있다. 유기물질은 광물에서 얻을수 있는 무기물질의 상대적 개념으로 살아있거나 있었던 생물에서 얻어지는 물질을 유기화합물이라 했었는데 오늘 날에는 화합물의 구성원자중 탄소를 포함하며 그 물질을 분해하는 과정에서 에너지를 얻을수 있으면 유기물, 없으면 무기물이라 한다.
동소체
과거부터 연필 등의 형태로 사용되어온 흑연과 보석이면서 모든 광물 중 가장 경도가 높은 다이아몬드, 극저온 상태에서 초전도 현상을 보이고 수지의 내구성 및 내열성을 높일 수 있는 풀러렌, 반도체의 성질을 가지는 탄소 나노튜브 등이 사용된다. 다른 동소체로, 그래핀이라는 2차원 구조의 물질이 있다.
같이 보기
각주
- ↑ 가 나 Haaland, D (1976). “Graphite-liquid-vapor triple point pressure and the density of liquid carbon”. 《Carbon》 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ↑ 가 나 Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. 《Carbon》 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ↑ “Carbon – Naturally occurring isotopes”. WebElements Periodic Table. 2008년 10월 9일에 확인함.
- ↑ “History of Carbon”. 2012년 11월 1일에 원본 문서에서 보존된 문서. 2013년 1월 10일에 확인함.
- ↑ The Internet Encyclopedia of Science (2008년 10월 9일). “Biological Abundance of Elements”.
- ↑ “World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)”. 2008년 10월 9일. 2008년 10월 5일에 원본 문서에서 보존된 문서. 2017년 8월 2일에 확인함.
- ↑ 가 나 Chemistry Operations (2003년 12월 15일). “Carbon”. Los Alamos National Laboratory. 2008년 9월 13일에 원본 문서에서 보존된 문서. 2008년 10월 9일에 확인함.
- ↑ Deming, Anna (2010). “King of the elements?”. 《Nanotechnology》 21. doi:10.1088/0957-4484/21/30/300201. 2016년 11월 15일에 확인함.
- ↑ Greenville Whittaker, A. (1978). “The controversial carbon solid−liquid−vapour triple point”. 《Nature》 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ↑ Zazula, J. M. (1997). “On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam” (PDF). CERN. 2009년 6월 6일에 확인함.
- ↑ Greenwood and Earnshaw, pp. 289–292
- ↑ Greenwood and Earnshaw, pp. 276–8
- ↑ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). “Materials: Ultrahard polycrystalline diamond from graphite”. 《Nature》 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ↑ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). “Superlubricity of Graphite” (PDF). 《Physical Review Letters》 92 (12). Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101.
- ↑ Deprez, N.; McLachan, D. S. (1988). “The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction”. 《Journal of Physics D: Applied Physics》 (Institute of Physics) 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ↑ Collins, A. T. (1993). “The Optical and Electronic Properties of Semiconducting Diamond”. 《Philosophical Transactions of the Royal Society A》 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ↑ Delhaes, P. (2001). 《Graphite and Precursors》. CRC Press. ISBN 90-5699-228-7.
외부 링크
- “탄소”. 《네이버캐스트》.
- (영어) 탄소 - WebElements.com