알칼리 금속
알칼리 금속(alkali metal, -金屬)은 화학 원소 리튬(Li), 나트륨(Na), 칼륨(K), 루비듐(Rb), 세슘(Cs), 프랑슘(Fr)으로 구성된 화학 계열이다. 수소와 함께 주기율표의 s-구역에 있는 1족 원소를 구성한다.[주 1] 모든 알칼리 금속은 최외각 전자를 s 오비탈에 가지고 있다. 이 공유 전자 구성은 알칼리 금속들이 매우 유사한 성질을 갖도록 한다.[주 2] 대표 원소의 이름을 따서 리튬족이라고도 한다.
알칼리 금속은 표준 온도 압력에서 광택이 있고 무르고 반응성이 높은 금속이며, 최외각 전자 껍질의 전자 하나를 쉽게 잃어 +1 전하를 가진 양이온을 이룬다. 무른 금속이므로 칼로 쉽게 자를 수 있으며, 잘린 반짝이는 표면은 공기 중의 수분과 산소와 결합하여 산화하여 빠르게 변색된다. 리튬의 경우엔 공기 중의 질소와도 반응한다. 반응성이 높기 때문에 공기와의 반응을 방지하기 위해 기름 속에 저장해야 하며, 자연적으로는 염의 형태로만 발견되며, 자유 원자로는 발견되지 않는다. 다섯 번째 알칼리 금속인 세슘은 모든 금속 중에서 가장 반응성이 높다. 모든 알칼리 금속은 물과 반응하며, 무거운 알칼리 금속은 가벼운 금속보다 더 격렬하게 반응한다.
발견된 모든 알칼리 금속은 자연에서 화합물 형태로만 발견된다. 나트륨이 가장 풍부하며 그 다음으로 칼륨, 리튬, 루비듐, 세슘 순이며, 높은 방사성을 띤 프랑슘은 매우 드물게 발견된다. 프랑슘은 붕괴 계열의 중간 산물 형태인 미량 동위원소로만 발견된다. 알칼리 금속의 다음 원소 후보인 우누넨늄(Uue)을 합성하기 위한 실험이 진행되었으나 성공을 거두지는 못했다. 우누넨늄은 초중량 원소의 화학적 성질에 큰 영향을 미치는 상대론적 효과의 예측에 의하면 알칼리 금속이 아닐 수 있으며 알칼리 금속에 속하더라도 다른 알칼리 금속과는 물리적, 화학적 성질에 어느 정도 차이가 있을 것으로 예측된다.
대부분의 알칼리 금속은 많은 응용 분야에서 쓰이고 있다. 순수한 원소의 가장 잘 알려진 응용은 원자 시계에 루비듐과 세슘을 사용하는 것이며, 그중 세슘 원자 시계는 1초를 정의하는 기준이 된다. 나트륨은 효율적인 조명 기구인 나트륨등에 사용된다. 먹는 소금은 염화 나트륨이 주성분으로, 고대부터 사용되어 왔다. 리튬은 정신의학 약과 리튬 전지의 산화극 소재로 사용된다. 나트륨과 칼륨은 필수 무기질로, 전해질로 주요한 생물학적 역할을 하고 있으며, 다른 알칼리 금속은 필수는 아니지만, 신체에 유익하고 해로운 다양한 영향을 미친다.
역사[편집]

나트륨 화합물인 소금(염화 나트륨)은 고대부터 인간 활동에 있어 중요한 상품으로, 급여를 뜻하는 영어 단어 "salary"도 로마 병사에게 소금 구입을 위해 지급된 돈을 가리키는 단어 살라리움(salarium)에서 유래되었다.[2] 고대부터 칼리가 사용되었으나 나트륨 화합물인 소금과는 근본적으로 다른 물질이라는 것은 알 수 없었다. 1702년에 게오르크 에른스트 슈탈은 나트륨염과 칼륨염의 근본적인 차이를 제시하는 실험적 증거를 얻었고,[3] 1736년 앙리 루이 뒤하멜 뒤 몽소는 이 차이를 증명할 수 있었다.[4] 당시 칼륨과 나트륨 화합물의 정확한 화학적 구성과, 칼륨과 나트륨의 화학 원소로서의 지위는 그 당시 알려져 있지 않았기 때문에 앙투안 라부아지에는 1789년 그의 화학 원소 목록에 어떤 알칼리 원소도 포함시키지 않았다.[5][6]
순수한 칼륨은 1807년 영국의 험프리 데이비에 의해 처음으로 분리되었다. 데이비는 새롭게 발명된 볼타 전지를 이용하여 가성 칼리(KOH, 수산화 칼륨)의 용융된 소금을 전기 분해하여 추출했다. 이전의 칼리 수용액을 이용한 전기 분해 시도는 칼륨의 높은 반응성으로 인해 성공하지 못했다.[7]:68 칼륨은 전기 분해를 통해 분리된 최초의 금속이다.[8] 같은 해 말, 데이비는 유사한 물질인 가성 소다(NaOH, 수산화 나트륨)로부터 비슷한 방법을 통해 나트륨을 추출한 것을 보고했고, 두 원소가 다르다는 것을 증명했다.[5][6][9][10]

페탈라이트(LiAlSi4O10)는 1800년 브라질의 화학자 조제 보니파시우 지 안드라다가 스웨덴 우퇴섬의 광산에서 발견했다.[11][12][13] 하지만 1817년이 되어서야 화학자 옌스 야코브 베르셀리우스의 실험실에서 일하던 요한 아우구스트 아르프베손이 페탈라이트 광석을 분석하여 새로운 원소의 존재를 감지했다.[14][15] 이 새로운 원소는 나트륨과 칼륨과 유사한 화합물을 형성하지만 탄산염과 수산화물은 다른 알칼리 금속보다 물에 덜 녹고 알칼리성은 더 강한 점에 주목했다.[16] 베르셀리우스는 식물의 재에서 발견된 칼륨, 동물의 피에 풍부한 나트륨과 달리 단단한 광물에서 발견된 것을 반영하여 이 미지의 물질의 이름을 "돌"을 뜻하는 그리스어 λιθoς(lithos)에서 유래한 "리(lithion)/리티나(lithina)"라 지었다. 이 물질 안에 있는 금속의 이름을 리튬(lithium)이라고 지었다.[17][12][15] 리튬, 나트륨, 칼륨은 1850년 요한 볼프강 되베라이너가 발견한 원소의 주기성, 즉 비슷한 성질을 가지고 있다고 지적한 동일한 족의 원소 중 하나이다.[18]

루비듐과 세슘은 로베르트 분젠과 구스타프 키르히호프가 1859년 발명한 분광기를 이용해 발견한 최초의 원소이다.[19] 다음 해에 분젠과 키르히호프는 독일 바트뒤르카임의 광천수에서 세슘을 발견했다. 루비듐의 발견은 이듬해 독일 하이델베르크에서 레피돌라이트 광물에서 발견했다.[20] 루비듐과 세슘의 이름은 방출 스펙트럼에서 가장 두드러진 선으로 루비듐은 밝은 빨간 선(짙은 빨간색, 또는 밝은 빨간색을 뜻하는 라틴어 루비두스(rubidus)), 세슘은 하늘색 선(하늘색을 뜻하는 라틴어 카이시우스(caesius))에서 왔다.[21][22]
1865년경 존 뉴랜즈는 일련의 논문을 발표했는데 원자량이 증가하는 순으로 원소를 나열했을 때 유사한 물리적 화학적 성질을 가진 원소가 8개 간격으로 되풀이됨을 보였다. 그는 이런 주기성을 음악의 옥타브에 비유하여 한 옥타브 떨어진 음표가 비슷한 음악적 기능을 가지는 것과 비교하였다.[23][24] 뉴랜즈는 논문에서 당시 알려진 모든 알칼리 금속(리튬에서 세슘까지)을 알칼리 금속처럼 +1 산화 상태 특성을 가진 구리, 은, 탈륨과 한 족으로 묶었다. 뉴랜즈는 할로젠과 수소를 표의 같은 자리에 배치했다.[18]
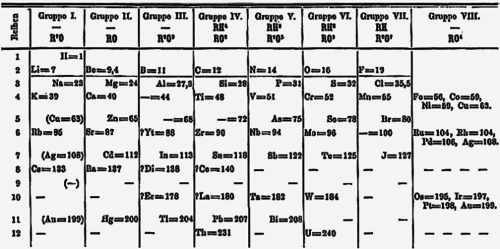
1869년 이후 드미트리 멘델레예프는 리튬을 나트륨, 칼륨, 루비듐, 세슘, 탈륨을 가진 족의 맨 위에 배치하는 주기율표를 제안했다.[25] 2년 후 멘델레예프는 자신의 주기율표를 수정하여 수소를 리튬이 속한 I족 위에 배치하고, 탈륨도 붕소족으로 이동시켰다. 이 1871년판에서는 구리, 은, 금을 두 번 배치하였는데 한 번은 IB족의 일부로, 한 번은 오늘날의 8족에서 11족 원소를 아우르는 'VIII족'의 일부로 배치하였다.[26][주 3] 18열 주기율표 도입 후 IB족 원소는 d-구역의 현재 위치로 이동했고, IA족에는 알칼리 금속이 남았다. 이후 1988년 IA족 이름이 1족으로 바뀌었다.[1] 관용명인 "알칼리 금속"은 1족 원소의 수산화물이 모두 물에 용해되었을 때 강한 알칼리라는 사실에서 유래한다.[27]
프랑스 파리 퀴리 연구소의 마르게리트 페레가 1939년 220 keV의 붕괴 에너지가를 가진 것으로 보고된 악티늄-227 샘플을 정제하여 프랑슘을 발견하기까지 적어도 네 번의 오류와 불완전한 발견이 있었다.[28][29][30][31] 그러나 페레는 에너지 준위가 80 keV 미만인 붕괴 입자를 발견했다. 페레는 이 붕괴 활동이 이전에 확인되지 않았던 붕괴 생성물에 의해 일어났을 수도 있다고 생각했는데 이 물질은 정제 과정에서 분리되었으나 순수한 악티늄-227에서 다시 나타났다. 다양한 실험을 통해 이 미지의 원소가 토륨, 라듐, 납, 비스무트, 탈륨일 가능성을 제거했다. 이번 새로운 생성물은 (세슘 염과 공침하는 등의) 알칼리 금속의 화학적 특성을 보여 페레는 악티늄-227의 알파 붕괴로 생겨난 87번 원소라고 믿게 되었다.[32] 페레는 그 후 악티늄-227에서 베타 붕괴와 알파 붕괴의 비율을 결정하려고 시도했다. 그의 첫 번째 실험에서 알파 붕괴 비율이 0.6%로 나왔고, 이 수치는 후에 1%로 수정되었다.[33]
- 227
89Ac
223
87Fr
223
88Ra
219
86Rn
주기율표에서 프랑슘 아래의 다음 원소(에카프랑슘)는 119번 원소인 우누넨늄(Uue)이 될 것이다. 우누넨늄의 합성은 1985년 캘리포니아주 버클리의 슈퍼HILAC 가속기에서 칼슘-48으로 아인슈타이늄-254의 표적을 폭격하여 처음 시도되었다. 원자가 확인되지 않아 300 nb의 한계 수율로 이어졌다.[34][35]
- 254
99Es
+ 48
20Ca
→ 302
119Uue
* → 원자 발견 안됨[주 4]
존재[편집]
태양계 내부[편집]

오도-하킨스 규칙은 수소를 제외하고 원자 번호가 짝수인 원소가 홀수인 원소보다 더 흔하다는 내용이다. 이 규칙은 홀수 원자 번호를 가진 원소는 짝없는 양성자 하나를 가지고 있으며, 다른 양성자를 포획할 가능성이 더 높기 때문에 원자 번호가 증가한다고 주장한다. 짝수 원자 번호를 가진 원소는 양성자가 짝을 가지며, 짝진 양성자 간에 서로의 스핀을 상쇄하여 안정성을 높인다.[37][38][39] 모든 알칼리 금속을 홀수 원자 번호를 가지며, 태양계 내에서 인접한 원자 번호를 가진 원소(비활성 기체와 알칼리 토금속)만큼 흔하지 않다. 루비듐 이후의 무거운 알칼리 금속은 항성 핵합성에서는 만들어지지 않고, 초신성에서만 합성될 수 있기에 가벼운 금속보다 덜 풍부하다. 리튬은 대폭발 핵합성이나 항성 핵합성 어느 쪽에서도 잘 합성되지 않기 때문에 나트륨이나 칼륨보다 훨씬 덜 풍부하다. 5개에서 8개의 핵자를 가진 안정적인 원자핵이 없기 때문에 대폭발 과정에서 미량의 리튬, 베릴륨, 붕소만 합성된다. 항성 핵합성에서는 세 개의 헬륨 핵을 합성하여 탄소를 형성하는 삼중 알파 과정을 통해 이 세 원소를 건너뛴다.[36]
지구[편집]

지구는 태양을 형성한 것과 같은 물질의 구름으로부터 만들어졌지만, 태양계의 형성과 진화 과정에서 행성들은 서로 다른 구성비를 갖게 되었다. 결국, 지구의 자연사는 지구의 각 부분이 다른 원소 농도를 갖게 했다. 지구의 질량은 약 5.98×1024 kg이다. 대부분 철(32.1%), 산소(30.1%), 규소(15.1%), 마그네슘(13.9%), 황(2.9%), 니켈(1.8%), 칼슘(1.5%), 알루미늄(1.4%)으로 구성됐으며 나머지 1.2%는 미량의 다른 원소로 구성됐다. 행성의 분화로 인해 지구의 핵은 주로 철(88.8%)로 구성되어 있으며, 소량의 니켈(5.8%), 황(4.5%) 및 1% 미만의 미량 원소로 구성되어 있다고 파악된다.[40]
알칼리 금속은 높은 반응성으로 인해 자연적으로는 순수한 금속 형태로 산출되지 않는다. 산소와 쉽게 결합하며, 이산화 규소와 강하게 결합하며, 상대적으로 밀도가 낮은 광물을 이뤄, 지구 중심부로 가라앉지 않고 지구 표면 근처에 남게 된다. 칼륨, 루비듐, 세슘도 이온 반지름이 크기 때문에 부적합 원소이다.[41]
나트륨과 칼륨은 지구의 지각에서 가장 풍부한 10가지 원소에 속한다.[42][43] 나트륨은 지각에서 6번째로 풍부한 원소로, 지각 질량의 약 2.6%를 차지하며, 칼륨은 지각에서 7번째로 풍부한 원소로, 지각 질량의 약 1.5%를 차지한다.[44] 나트륨은 여러 많은 광물에서 발견되며, 그 중 가장 흔한 것은 바닷물에 녹아있는 방대한 양의 일반 소금(염화 나트륨)이다. 다른 고체 퇴적물로는 암염, 각섬석, 빙정석, 칠레 초석, 제올라이트 등이 있다.[44] 이런 고체 퇴적물의 대부분은 고대의 바다가 증발한 결과 만들어졌으며, 지금도 미국 유타주의 그레이트솔트호나 중동의 사해 등에서 만들어지고 있다.[7]:69
화학적 유사성에도 불구하고 리튬은 크기가 작아서 일반적으로는 나트륨이나 칼륨과 함께 산출되지 않는다.[7]:69 상대적으로 반응성이 낮기 때문에 많은 양의 바닷물에서 발견되는데, 바닷물에는 약 0.14~0.25 ppm,[45][46] 또는 25 마이크로몰라로 추정된다.[47] 마그네슘과의 대각 관계는 종종 철마그네슘 광물에서 마그네슘을 대신할 수 있게 하는데, 지각에서의 농도는 갈륨과 나이오븀과 비슷한 약 18 ppm이다. 상업적으로 가장 중요한 리튬 광물은 스포듀민으로, 전 세계적으로 널리 산출된다.[7]:69
루비듐은 아연만큼 풍부하고 구리보다 더 풍부하다. 백류석, 폴루사이트, 광로석, 진왈다이트, 레피돌라이트 등의 광물로 자연적으로 산출되지만,[48] 이들 광물은 루비듐과 함께 다른 알칼리 금속도 함유하고 있다.[7]:70 세슘은 안티모니, 카드뮴, 주석, 텅스텐과 같이 일반적으로 알려진 일부 원소보다 풍부하지만, 루비듐보다는 훨씬 덜 풍부하다.[49]
프랑슘-223은 프랑슘의 유일한 천연 동위 원소로,[50][51] 악티늄-227의 알파 붕괴 생성물로 우라늄 광물에서 미량으로 발견된다.[52] 주어진 우라늄 표본에서, 1018 개의 우라늄 원자 당 하나의 프랑슘 원자가 있을 것으로 추정된다.[53][54] 22분의 짧은 반감기 때문에 지구 표면에는 많아봐야 30 그램의 프랑슘만이 있는 것으로 계산되었다.[55][56]
성질[편집]
물리적 및 화학적 성질[편집]
알칼리 금속의 물리적 및 화학적 성질은 ns1 원자가 전자 배치를 하고 있어 약한 금속 결합을 가진 것으로 쉽게 설명될 수 있다. 모든 알칼리 금속은 부드럽고 밀도가 낮은 데다 녹는점과 끓는점이 낮으며 승화열, 기화열, 해리열도 낮다. 체심 입방 격자의 결정 구조를 가지며, 바깥의 s 전자가 매우 쉽게 들뜨기 때문에 독특한 불꽃색을 가진다. ns1 전자 배열 때문에 원자 반지름과 이온 반지름이 매우 크며, 높은 열전도도와 전기 전도도를 가진다. 화학적 성질은 최외곽 s-궤도에 있는 유일한 원자가 전자를 잃고 +1 산화 상태를 가지는 것이 지배적인데 전자를 잃어 이온화되는 것이 쉽고, 두 번째 이온화 에너지는 매우 높기 때문이다. 대부분의 화학 작용은 처음 다섯 원소에서 대부분 관찰된다. 프랑슘의 화학적 성질은 높은 방사성 때문에 잘 확립되어 있지 않다. 프랑슘에 대해 알려진 것이 거의 없지만, 예상대로 세슘과 가깝게 행동한다는 것을 보여준다. 프랑슘의 물리적 성질은 대량으로 관찰한 적이 없기 때문에 더 피상적이다. 문헌에서 찾을 수 있는 데이터는 거의 대부분 추측성 외삽이다.
| 이름 | 리튬 | 나트륨 | 칼륨 | 루비듐 | 세슘 | 프랑슘 |
|---|---|---|---|---|---|---|
| 원자 번호 | 3 | 11 | 19 | 37 | 55 | 87 |
| 표준 원자량 (u)[주 5][50][51] | 6.94(1)[주 6] | 22.98976928(2) | 39.0983(1) | 85.4678(3) | 132.9054519(2) | [223][주 7] |
| 전자 배치 | [He] 2s1 | [Ne] 3s1 | [Ar] 4s1 | [Kr] 5s1 | [Xe] 6s1 | [Rn] 7s1 |
| 녹는점 (°C) | 180.54 | 97.72 | 63.38 | 39.31 | 28.44 | ? |
| 끓는점 (°C) | 1342 | 883 | 759 | 688 | 671 | ? |
| 밀도 (g·cm−3) | 0.534 | 0.968 | 0.89 | 1.532 | 1.93 | ? |
| 융해열 (kJ·mol−1) | 3.00 | 2.60 | 2.321 | 2.19 | 2.09 | ? |
| 기화열 (kJ·mol−1) | 136 | 97.42 | 79.1 | 69 | 66.1 | ? |
| 단원자 기체 생성열 (kJ·mol−1) | 162 | 108 | 89.6 | 82.0 | 78.2 | ? |
| 25 °C에서의 전기 저항 (nΩ·cm) | 94.7 | 48.8 | 73.9 | 131 | 208 | ? |
| 원자 반지름 (pm) | 152 | 186 | 227 | 248 | 265 | ? |
| M+ 양이온의 이온 반지름 (pm) | 76 | 102 | 138 | 152 | 167 | ? |
| 첫번째 이온화 에너지 (kJ·mol−1) | 520.2 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8[59] |
| 전자 친화도 (kJ·mol−1) | 59.62 | 52.87 | 48.38 | 46.89 | 45.51 | ? |
| M2 해리 엔탈피 (kJ·mol−1) | 106.5 | 73.6 | 57.3 | 45.6 | 44.77 | ? |
| 폴링 전기 음성도 | 0.98 | 0.93 | 0.82 | 0.82 | 0.79 | ?[주 8] |
| 앨런 전기 음성도 | 0.91 | 0.87 | 0.73 | 0.71 | 0.66 | 0.67 |
| 표준 전극 전위 (E°(M+→M0); V)[62] | −3.04 | −2.71 | −2.93 | −2.98 | −3.03 | ? |
| 불꽃색 주 방출/흡수 파장 (nm) |
진홍색 670.8 |
노란색 589.2 |
보라색 766.5 |
자주색 780.0 |
파랑색 455.5 |
? |
알칼리 금속은 다른 족 원소끼리에 비해 서로 더 비슷하다.[27] 실제로 유사성이 너무 커서 이온 반지름이 비슷한 칼륨, 루비듐, 세슘을 분리하기가 상당히 어렵다. 리튬과 나트륨은 조금 더 차이가 난다. 예를 들어, 표 아래로 이동할 때, 알려진 모든 알칼리 금속은 원자 반지름이 증가하고,[63] 전기 음성도가 감소하고,[63] 반응성이 증가하며,[27] 녹는점과 끓는점이 낮아지고,[63] 융해열과 기화열도 감소한다.[7]:75 칼륨이 나트륨보다 밀도가 낮다는 점을 제외하면 일반적으로 표 아래로 이동하면 밀도가 높아진다.[63] 매끄러운 경향성을 보이지 않는 알칼리 금속의 아주 적은 특성 중 하나는 환원 전위이다: 리튬의 값은 변칙적이고 다른 것들보다 더 음성을 띤다.[7]:75 이는 Li+ 이온이 기체 단계에서 매우 높은 수화 에너지를 가지고 있기 때문이다. 리튬 이온이 물의 구조를 현저하게 교란하여 엔트로피에 더 큰 변화를 일으키지만, 이 높은 수화 에너지는 기체 상태에서 이온화하는 어려움에도 불구하고 환원 전위는 가장 전기 양성인 알칼리 금속임을 나타내기에 충분하다.[7]:75
안정된 알칼리 금속은 세슘을 제외하면 모두 은색 금속이다.[64] 세슘은 옅은 황금색 색조를 가지며, 색이 뚜렷한 세 금속 중 하나이다(다른 두 금속은 구리와 금이다).[7]:74 또한 무거운 알칼리 토금속인 칼슘, 스트론튬, 바륨은 물론이고 란타넘족의 유로퓸과 이터븀도 옅은 노란색을 띠지만 세슘에 비해 색이 덜 두드러진다.[7]:74 알칼리 금속의 광채는 산화로 인해 공기 중에서 빠르게 변색된다.[27] 알칼리 금속은 체심 입방 격자 결정 구조로 결정화되며,[7]:73 바깥 s 전자가 쉽게 들뜨기 때문에, 독특한 불꽃색을 가지고 있다. 이 불꽃색은 일반적으로 이온을 가진 모든 염이 용해되기 때문에 이들을 식별하는 가장 일반적인 방법이다.[7]:75
모든 알칼리 금속은 반응성이 매우 높으며, 자연에서 원소 형태로는 결코 발견되지 않는다.[17] 이 때문에 보통 광물유나 등유에 저장된다.[65] 할로젠과 공격적으로 반응하여 알칼리 금속 할로젠화물을 형성하는데, 흰색의 이온 결정 화합물로 플루오린화 리튬(LiF)을 제외하고는 모두 물에 녹는다.[27] 알칼리 금속은 또한 물과 반응하여 강한 알칼리 수산화물을 형성하므로 매우 주의하여 다루어야 한다. 무거운 알칼리 금속은 가벼운 금속보다 더 강력하게 반응한다. 예를 들어, 동일한 몰 수의 금속이 물에 빠졌을 때 세슘은 칼륨보다 더 큰 폭발을 일으킨다.[27][66][49] 알칼리 금속은 유효 핵전하가 낮고,[27] 전자 하나를 잃어 비활성 기체의 전자 배열에 도달할 수 있으므로,[27] 주기율표의 같은 주기 원소 중에서 첫 번째 이온화 에너지가 가장 낮다.[67] 알칼리 금속은 물 이외에도 알코올, 페놀, 기체 암모니아, 알카인 등의 양성자 주개와도 반응한다. 환원제로서의 큰 힘은 다른 산화물이나 할로젠화물에서 금속을 해방시키는데 매우 유용하게 쓰인다.[7]:76
모든 알칼리 금속의 두 번째 이온화 에너지는 핵에 더 가까운 완전한 껍질 안에 있기 때문에 매우 높다.[27][67] 따라서 알칼리 금속은 거의 항상 하나의 전자를 잃어 양이온을 형성한다.[7]:28 예외적인 경우로 알칼리화물이 있는데, -1 산화 상태의 알칼리 금속을 함유하고 있는 불안정한 화합물로, 이례적인 알칼리화물의 발견 이전에는 알칼리 금속은 음이온을 형성할 수 없다고 예상되었고 양이온으로만 염을 만들 수 있다고 생각되었다. 알칼리 음이온은 s-전자 껍질을 채웠기 때문에, 존재하기에 충분한 안정성을 제공한다. 리튬을 제외한 모든 안정한 알칼리 금속은 알칼리화물을 형성할 수 있는 것으로 알려져 있으며,[68][69][70] 알칼리화물은 특이한 화학량론과 낮은 이온화 퍼텐셜 때문에 이론적 관심이 많다. 알칼리화물은 화학적으로 전자화물과 유사하며, 전자화물은 갇힌 전자가 음이온 역할을 하는 염이다.[71] 알칼리화물의 특히 두드러진 예는 "역수소화 나트륨", H+Na−(두 이온 모두 착이온이다)이며,[72] 일반적인 수소화 나트륨인 Na+H−과는 반대로, 수소에서 나트륨으로 두 전자의 이동 때문에 높은 에너지로 인해서 여러 유도체는 준안정 또는 안정적이나 분리되면 불안정하다.[72][73]
수용액에서 알칼리 금속 이온은 화학식 [M(H2O)n]+의 아쿠아 이온을 형성하며, 여기서 n은 용매화 수이다. 이온의 배위수와 모양은 이온 반지름에서 예측된 결과와 잘 일치한다. 수용액에서 금속 이온에 직접 부착된 물 분자는 일차 배위권에 속한다. 물 분자와 금속 이온 사이의 결합은 산소 원자가 두 전자를 모두 제공하는 공유 결합이다. 배위 결합된 물 분자는 수소 결합을 통해 다른 물 분자에 부착될 수 있다. 이 경우 이차 배위권에 있다고 한다. 그러나 알칼리 금속 양이온의 경우, 양이온의 +1 전하가 이차 배위권과 강한 수소 결합을 형성할 수 있을 만큼 일차 배위권의 물 분자를 편극시킬 만큼 충분히 높지 않아 2차 배위권이 잘 형성되지 않아, 보다 안정적인 실체를 생성한다.[74][75]:25 Li+에 대한 용매화 수는 실험적으로 4로 결정되어, 사면체 모양의 [Li(H2O)4]+를 형성한다. 리튬 아쿠아 이온에 대해 3에서 6의 용매화 수가 발견되며, 4 미만의 용매화 수는 접촉 이온쌍의 형성 결과일 수 있으며, 높은 용매화 수는[Li(H2O)4]+의 면에 접근하는 물 분자로 해석될 수 있지만, 분자 역학 시뮬레이션 결과는 팔면체 헥사아쿠아 이온의 존재를 가리킨다. 나트륨 이온의 일차 배위권에는 아마도 6개의 물 분자가 있어, 팔면체 [Na(H2O)6]+ 이온을 형성할 것이다.[57][75]:126–127 더 무거운 알칼리 금속의 경우 팔면체 모양의 헥사아쿠아 이온을 형성한다고 생각했으나, 그 이후로 칼륨과 루비듐은 엇사각기둥 모양의 [K(H2O)8]+와 [Rb(H2O)8]+ 이온을 형성하며, 세슘은 12극의 [Cs(H2O)12]+ 이온을 형성하는 것이 밝혀졌다.[76]
리튬[편집]
리튬의 화학은 작은 Li+ 양이온이 음이온에 극성을 주고, 화합물에 더 많은 공유 결합성을 주기 때문에 나머지 알칼리 금속의 화학과는 몇 가지 차이점을 보여준다.[27] 리튬과 마그네슘은 비슷한 원자 반지름으로 인해 대각 관계를 가지기 때문에[27] 어느 정도 비슷한 성질을 보인다. 예를 들어 리튬은 안정된 질화물을 형성하는데, 이는 (마그네슘이 속한) 모든 알칼리 토금속에서는 일반적인 성질이지만 알칼리 금속 중에서는 독특하다.[77] 또한 각각의 족 중에서 리튬과 마그네슘만이 충분한 공유 결합성을 가진 유기 금속 화합물(예: LiMe, MgMe2)을 형성한다.[78]
플루오린화 리튬은 물에 잘 녹지 않는 유일한 알칼리 금속 할로젠화물이며,[27] 수산화 리튬은 흡습성이 없는 유일한 알칼리 금속 수산화물이다.[27] 반대로 극성을 띠기 어려운 큰 음이온을 갖는 과염소산 리튬이나 다른 리튬염은 다른 알칼리 금속의 유사 화합물보다 훨씬 안정적인데, Li+가 용매화 에너지가 높기 때문일 것이다.[7]:76 이 효과는 대부분의 단순한 리튬염이 일반적으로 수화물 형태로 발견된다는 뜻인데, 무수 형태가 극도로 흡습성이 높기 때문이다. 이것은 염화 리튬이나 브로민화 리튬을 제습기나 에어컨에 사용할 수 있게 해준다.[7]:76
프랑슘[편집]
프랑슘은 또한 높은 원자량으로 인해 약간의 차이를 보일 것으로 예측되며 전자가 빛의 속도에 상당히 근접한 비율로 이동하게 되어 상대론적 효과가 더욱 두드러진다. 알칼리 금속의 전기 음성도와 이온화 에너지가 감소하는 추세와는 대조적으로 프랑슘의 전자 음성도와 이온화 에너지는 7s 전자의 상대론적 안정화로 인해 세슘보다 높을 것으로 예측되며, 또한 원자 반지름은 비정상적으로 낮을 것으로 예상된다. 따라서 기대와는 달리 세슘은 프랑슘이 아닌 알칼리 금속 중 가장 반응성이 높다.[59][79]:1729[80] 프랑슘의 모든 알려진 물리적 성질은 첫 번째 이온화 에너지, 전자 친화도, 음이온 극성 등은 리튬에서 세슘으로의 추세를 벗어나지만 프랑슘에 대한 알려진 데이터의 부족으로 인해 많은 출처가 상대론적 효과로 인해 리튬에서 세슘으로의 추세를 쓰기 어렵다는 점을 무시한 채 외삽된 값을 제시하고 있다.[80] 상대성을 고려해 예측된 프랑슘의 몇 안되는 특성에는 전자 친화도 (47.2 kJ/mol)[81]와 Fr2 분자의 해리 엔탈피 (42.1 kJ/mol)가 있다.[82] CsFr 분자는 Cs+Fr−로 분극되며, 프랑슘의 7s 부껍질이 세슘의 6s 부껍질보다 상대론적 효과에 훨씬 더 강하게 영향을 받는다는 것을 보여준다.[80] 과산화 프랑슘(FrO2)은 6p 전자로부터의 결합 기여 때문에 다른 알칼리 금속 과산화물과는 달리 상당한 공유 결합성을 가질 것으로 예상된다.[80]
원자핵[편집]
| Z |
알칼리 금속 |
안정 |
붕괴 |
불안정: 기울임꼴 홀수-홀수 핵종은 분홍색
| ||
|---|---|---|---|---|---|---|
| 3 | 리튬 | 2 | — | 7 Li |
6 Li |
|
| 11 | 나트륨 | 1 | — | 23 Na |
||
| 19 | 칼륨 | 2 | 1 | 39 K |
41 K |
40 K |
| 37 | 루비듐 | 1 | 1 | 85 Rb |
87 Rb |
|
| 55 | 세슘 | 1 | — | 133 Cs |
||
| 87 | 프랑슘 | — | — | 원시 동위 원소 없음 (223 Fr 은 붕괴로 만들어지는 핵종이다.) | ||
| 방사성: 40K, t1/2 1.25 × 109 년; 87Rb, t1/2 4.9 × 1010 년; 223Fr, t1/2 22.0 분 | ||||||
모든 알칼리 금속의 원자 번호는 홀수이다. 따라서 알칼리 금속의 동위 원소의 핵은 홀수-홀수(양성자수와 중성자수 모두 홀수) 또는 홀수-짝수(양성자수는 홀수, 중성자수는 짝수)이다. 홀수-홀수 핵은 질량수가 짝수이고, 홀수-짝수 핵은 질량수가 홀수이다. 홀수-홀수 원시 핵종은 드물다. 왜냐하면 대부분의 홀수-홀수 핵은 베타 붕괴와 관련하여 매우 불안정한데, 붕괴 생성물이 짝수-짝수 핵이고, 핵 짝짓기 효과로 인해 더 강하게 결합되기 때문이다.[83]
홀수-홀수 핵의 희귀성 때문에 알칼리 금속의 거의 모든 원시 동위 원소는 홀수-짝수(경량의 안정 동위 원소인 리튬-6과 장수명 방사성 동위 원소인 칼륨-40만이 예외이다)이다. 홀수 질량수인 경우, 짝수-홀수 핵과 홀수-짝수 핵 사이의 결합 에너지 차이가 없기 때문에 하나의 베타 안정성 핵종만 있을 수 있다. 동일한 질량수(동중 원소)의 다른 핵종은 최소 질량의 핵종을 향해 자유롭게 베타 붕괴가 일어난다. 두 종륭의 핵자 중 어느 쪽이라도 홀수인 경우에 불안정하다는 효과 때문에 알칼리 금속과 같은 홀수 원자 번호의 원소는 짝수 원자 번호의 원소보다 적은 수의 안정 동위 원소를 갖는 경향이 있다. 안정 동위 원소가 하나인 26개의 원소 중 하나를 제외하고는 모두 홀수 원자 번호를 갖고 있으며, 하나를 제외하고는 모두 짝수 개의 중성자를 가지고 있다. 두 규칙의 유일한 예외는 베릴륨으로, 원자 번호가 낮기 때문이다.[83]
리튬과 세슘을 제외한 모든 알칼리 금속은 적어도 하나의 천연 방사성 동위 원소를 가지고 있다. 나트륨-22와 나트륨-24는 우주선에 의해 생겨나는 미량 방사성 동위 원소이며,[84] 칼륨-40과 루비듐-87은 매우 긴 반감기를 가지고 있어 자연적으로 발견된다.[85] 프랑슘의 모든 동위 원소는 방사성이다.[85] 세슘은 20세기 초까지는 방사성 물질로 생각되었으나,[86][87] 자연적으로 발견되는 방사성 동위 원소는 없다.[85] 칼륨의 천연 방사성 동위 원소인 칼륨-40은 천연 칼륨의 약 0.012%를 차지하며,[88] 따라서 천연 칼륨은 약한 방사성을 띤다. 이러한 자연 방사성은 1925년 87번 원소(세슘 이후의 다음 알칼리 금속) 발견에 대한 잘못된 주장을 뒷받침하는 근거가 되었다.[28][29] 천연 루비듐은 마찬가지로 약한 방사성이 있으며, 27.83%는 장수명 방사성 동위 원소 루비듐-87이다.[7]:74
30.17년의 반감기를 가진 세슘-137은 스트론튬-90과 함께 사용 후 최대 수백 년까지 사용후 핵연료의 방사능 대부분을 담당하는 두 가지 주요 중생 핵분열 생성물이다. 체르노빌 사고에서 아직 남아 있는 방사능의 대부분을 차지한다. 세슘-137은 고에너지 베타 붕괴를 겪으며 결국 안정적인 바륨-137이 된다. 감마선의 강한 방출체이다. 세슘-137은 중성자 포획률이 매우 낮으며, 가능성은 낮지만, 결국 붕괴하게 된다.[89] 세슘-137은 삼중수소와 유사하게 수문학 연구에서 추적자로 사용되어 왔다.[90] 거의 모든 핵실험과 일부 원자력 사고, 특히 고이아니아 사고와 체르노빌 사고를 통해 소량의 세슘-134와 세슘-137이 환경으로 방출되었다. 2005년 현재 세슘-137은 체르노빌 원자력 발전소 주변의 출입 금지 구역의 주요 방사선원이다.[91] 알칼리 금속이 가진 화학적 성질인 염의 높은 수용성으로 인해 자연에서 쉽게 움직이고 퍼져나가며 필수 무기질인 나트륨과 칼륨으로 착각하여 몸에 흡수되기 때문에 수명이 짧은 핵분열 생성물 중 가장 문제가 되는 물질이다.[92]:114
주기성[편집]
알칼리 금속은 다른 족 원소끼리에 비해 서로 더 비슷하다.[27] 실제로 유사성이 너무 커서 이온 반지름이 비슷한 칼륨, 루비듐, 세슘을 분리하기가 상당히 어렵다. 리튬과 나트륨은 조금 더 차이가 난다. 예를 들어, 표 아래로 이동할 때, 알려진 모든 알칼리 금속은 원자 반지름이 증가하고,[63] 전기 음성도가 감소하고,[63] 반응성이 증가하며,[27] 녹는점과 끓는점이 낮아지고,[63] 융해열과 기화열도 감소한다.[7]:75 칼륨이 나트륨보다 밀도가 낮다는 점을 제외하면, 일반적으로 표 아래로 이동하면 밀도가 증가한다.[63]
원자 및 이온 반지름[편집]

알칼리 금속의 원자 반지름은 아래로 내려갈수록 증가한다.[63] 차폐 효과 때문에 원자가 하나보다 많은 전자 껍질을 가질 때 각 전자는 핵으로부터의 전기적 인력 뿐만 아니라 다른 전자로부터의 전기적 반발이 생긴다.[93] 알칼리 금속에서 최외곽 전자는 내부 전자에 의해 일부 핵 전하가 취소되기 때문에 +1의 순 전하만을 느낀다. 알칼리 금속의 내부 전자의 수는 항상 핵 전하보다 하나 적다. 따라서 알칼리 금속의 원자 반지름에 영향을 미치는 유일한 요인은 전자 껍질의 수이다. 이 숫자가 아래로 내려갈수록 증가하기 때문에 원자 반지름도 아래로 갈수록 증가하게 된다.[63]
알칼리 금속의 이온 반지름은 원자 반지름보다 훨씬 작다. 이는 알칼리 금속의 가장 바깥쪽 전자가 내부 전자와 다른 전자 껍질에 있기 때문에, 제거되면 원자는 전자 껍질이 하나 더 적어지고, 크기도 작아진다. 또한 유효 핵 전하가 증가하여 전자가 핵쪽으로 더 강하게 끌려, 이온 반지름이 감소한다.[27]
첫 번째 이온화 에너지[편집]

원소 또는 분자의 첫 번째 이온화 에너지는 원소 또는 분자의 기체 원자 한 몰에서 가장 느슨하게 유지되는 전자를 이동시켜 전하 +1의 기체 이온 한 몰을 형성하는 데 필요한 에너지이다. 첫 번째 이온화 에너지에 영향을 미치는 요인은 핵전하, 내부 전자에 의한 차폐 효과, 그리고 핵으로부터 가장 느슨하게 유지되는 전자(전형 원소의 경우엔 항상 가장 바깥 전자이다)와의 거리이다. 처음 두 가지 요인은 가장 느슨하게 유지되는 전자의 유효 핵전하를 변화시킨다. 알칼리 금속의 가장 바깥 전자는 항상 같은 유효 핵전하(+1)를 느끼기 때문에, 첫 번째 이온화 에너지에 영향을 미치는 유일한 요인은 가장 바깥쪽 전자에서 핵까지의 거리 뿐이다. 이 거리가 주기율표에서 아래로 내려갈수록 증가하기 때문에 가장 바깥쪽 전자는 핵으로부터 덜 끌리게 되고, 따라서 첫 번째 이온화 에너지가 감소한다.[63] (이 추세는 7s 궤도의 상대론적 안정화와 수축으로 인해 프랑슘에서 깨져 프랑슘의 원자가 전자가 비상대론적 계산에서 예상했던 것보다 핵에 더 가깝게 된다. 이로 인해 프랑슘의 가장 바깥쪽 전자가 핵으로부터 더 많은 인력을 띠게 되며, 세슘보다 약간 더 첫 번째 이온화 에너지를 증가시킨다.)[79]:1729
알칼리 금속의 두 번째 이온화 에너지는 두 번째로 느슨하게 유지되는 전자가 완전히 채워진 전자 껍질의 일부로 제거하기 어렵기 때문에 첫 번째 이온화 에너지보다 훨씬 높다.[27]
반응성[편집]
알칼리 금속의 반응성은 아래로 내려가면서 증가한다. 이는 알칼리 금속의 첫 번째 이온화 에너지와 원자화 엔탈피라는 두 요인이 복합적으로 작용한 결과이다. 알칼리 금속의 첫 번째 이온화 에너지가 아래로 갈수록 줄기 때문에, 가장 바깥쪽 전자가 원자에서 제거되어 화학 반응에 참여하기 더 쉬워져 아래로 갈수록 반응성이 증가한다. 원자화 엔탈피는 원소의 금속 결합의 강도를 측정하는데, 아래로 내려갈수록 원자 반지름이 증가하고, 따라서 금속 결합의 길이가 증가하게 되며, 비편재화 전자가 더 무거운 알칼리 금속 핵의 인력에서 더 멀리 벗어나게 된다. 원자화 엔탈피와 첫 번째 이온화 에너지를 더한 값은 알칼리 금속과 다른 물질 사이의 반응의 활성화 에너지와 밀접하게 관련된다. 이 값은 아래로 갈수록 감소하고 활성화 에너지도 감소한다. 따라서 화학 반응이 더 빨리 일어날 수 있고, 반응성은 아래로 갈수록 증가한다.[94]
전기 음성도[편집]

전기 음성도는 원자나 작용기가 전자(또는 전자 밀도)를 자기 쪽으로 끌어당기는 경향을 설명하는 화학적 성질이다.[95] 염화 나트륨에서 염소와 나트륨이 공유 결합을 한다면, 외부 전자에 대한 유효 핵전하가 염소는 +7이지만, 나트륨은 +1이기 때문에 공유 전자 쌍이 염소 쪽으로 끌릴 것이다. 전자 쌍은 염소 원자에 아주 가깝게 끌려 사실상 염소 원자 쪽으로 옮겨진다(이온 결합). 그러나 나트륨 원자가 리튬 원자로 바뀔 경우, 리튬 원자가 작기 때문에, 전자 쌍이 이전처럼 염소 원자에 가까이 끌리지 않고 리튬의 유효 핵전하에 더 강하게 끌리게 된다. 주기율표 아래의 더 큰 알칼리 금속 원자는 결합 전자 쌍이 원자 쪽으로 덜 강하게 끌리기 때문에 전기 음성도가 낮다. 앞서 언급했듯이 프랑슘은 예외적일 것으로 예상된다.[63]
리튬의 높은 전기 음성도 때문에, 리튬 화합물 중 일부는 더 공유 결합의 특성을 가지게 된다. 예를 들어 아이오딘화 리튬(LiI)은 대부분의 공유 화합물처럼 유기 용매에 용해된다. 플루오린화 리튬(LiF)은 물에 녹지 않는 유일한 할로젠화 알칼리 금속이며,[27] 수산화 리튬(LiOH)은 알칼리 금속 수산화물 중 유일하게 흡습성이 없다.[27]
녹는점과 끓는점[편집]
물질의 녹는점은 고체에서 액체로 상이 바뀌는 온도이고, 끓는점은 액체의 증기 압력이 액체를 둘러싼 환경 압력과 같아[96][97] 모든 액체가 기체로 상이 바뀌는 온도이다. 금속이 녹는점까지 가열됨에 따라 원자를 제자리에 유지시키던 금속 결합이 약해져서 원자가 움직일 수 있게 되고, 끓는점에서 금속 결합은 완전히 끊어진다.[63][98] 따라서 알칼리 금속의 녹는점과 끓는점은 금속 결합의 강도가 아래로 갈수록 감소함을 나타낸다.[63] 이는 금속 원자가 양이온과 비편재화 전자 사이의 전자기적 인력에 의해 결합되기 때문이다.[63][98] 아래로 갈수록 원자 반지름이 증가하기 때문에, 이온 핵은 비편재화 전자에서 더 멀어져 금속 결합이 약해져 금속이 더 쉽게 녹고 끓을 수 있어 녹는점과 끓는점을 낮춘다.[63] (늘어난 원자핵의 전하량은 차폐 효과로 인해 관련이 없다.)[63]
밀도[편집]
알칼리 금속은 모두 같은 결정 구조(체심 입방 격자)를 가지고 있으므로,[7] 단위 부피당 질량으로 정의되는 밀도는 특정 부피에 들어갈 수 있는 원자의 수와 원자 하나의 질량 만이 영향을 준다. 첫 번째 요인은 원자의 부피에 따라, 따라서 원자 반지름에 따라 달라며, 아래로 갈수록 원자의 부피는 증가한다. 알칼리 금속 원자의 질량 또한 아래로 갈수록 증가한다. 따라서 알칼리 금속의 밀도의 추세는 원자 질량과 원자 반지름에 따라 달라진다. 이 두 요소에 대한 수치가 알려져 있으면, 알칼리 금속의 밀도의 비를 계산할 수 있다. 결과적으로 칼륨을 제외하고는 알칼리 금속의 밀도는 아래로 갈수록 증가한다. 같은 주기 원소 중에서 알칼리 금속이 가장 원자량이 낮고 가장 원자 반지름이 크기 때문에 주기율표에서 알칼리 금속은 가장 밀도가 낮은 금속이다.[63] 리튬, 나트륨, 칼륨은 주기율표에서 물보다 밀도가 낮은 단 세 금속이다.[27] 리튬은 실온에서 가장 밀도가 낮은 고체로 알려져 있다.[7]:75
주해[편집]
- ↑ 구 IUPAC와 CAS 체계 모두에서, IA족("일에이족"으로 읽으며, "I"는 로마 숫자 1이다.)으로 불린다.[1]
- ↑ 수소도 같은 전자 구성을 가지고 있지만, 1주기 원소는 원자가 p-오비탈이 없어 반응이 매우 다르기 때문에 알칼리 금속으로 간주되지 않는다.
- ↑ 1869년판 멘델레예프의 주기율표에서는 구리와 은이 수소와 수은이 정렬된 그룹에 배치되었고 금은 붕소족의 우라늄과 미발견 원소인 에카알루미늄 아래에 잠정적으로 배치되었다.
- ↑ *는 들뜬 상태를 나타낸다.
- ↑ 괄호 안에 주어진 숫자는 측정 불확정성을 나타낸다. 불확정성은 (괄호 가장 오른쪽에서 왼쪽으로 센) 괄호 앞의 최소 유효 숫자에 적용된다. 예를 들어, 1.00794(7)은 1.00794±0.00007을 나타내며, 1.00794(72)은 1.00794±0.00072을 나타낸다.[58]
- ↑ 표시된 값은 무역과 상업적으로 쓰이는 표본의 일반적인 값이다. 실제 값은 동위 원소 구성비에 따라 6.938에서 6.997까지 분포한다.[51]
- ↑ 프랑슘은 안정적 핵종을 가지고 있지 않으며, 괄호 안의 값은 가장 오래 사는 동위 원소의 질량수이다.[50][51]
- ↑ 라이너스 폴링은 프랑슘의 전기 음성도를 폴링 척도로 0.7로 추정했는데, 이는 세슘과 같은 값이다.[60]세슘의 측정치는 0.79로 개선되었으나 프랑슘의 값을 개선할 만한 실험 데이터는 없다.[61] 프랑슘의 이온화 에너지는 상대론적 효과에서 예측된 것처럼 375.7041(2) kJ/mol인 세슘에 비해 약간 더 높은 392.811(4) kJ/mol로,[59] 이 결과는 둘 중에서 전기 음성도가 낮다는 걸 의미한다.
각주[편집]
- ↑ 가 나 Fluck, E. (1988). “New Notations in the Periodic Table” (PDF). 《Pure Appl. Chem.》 (IUPAC) 60 (3): 431–436. doi:10.1351/pac198860030431. S2CID 96704008. 2012년 3월 24일에 확인함.
- ↑ 하퍼, 더글러스. “salary”. 《온라인 어원 사전》.
- ↑ Marggraf, Andreas Siegmund (1761). 《Chymische Schriften》 (독일어). 167쪽.
- ↑ du Monceau, H. L. D. “Sur la Base de Sel Marine”. 《Mémoires de l'Académie Royale des Sciences》 (프랑스어): 65–68.
- ↑ 가 나 Weeks, Mary Elvira (1932). “The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium”. 《Journal of Chemical Education》 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ↑ 가 나 Siegfried, R. (1963). “The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements”. 《Isis》 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541. PMID 14147904.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 머 버 서 Greenwood, Norman N.; Earnshaw, Alan (1997). 《Chemistry of the Elements》 2판. Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Enghag, P. (2004). 〈11. Sodium and Potassium〉. 《Encyclopedia of the elements》. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4.
- ↑ Davy, Humphry (1808). “On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies”. 《Philosophical Transactions of the Royal Society of London》 98: 1–44. doi:10.1098/rstl.1808.0001.
- ↑ Shaposhnik, V. A. (2007). “History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)”. 《Journal of Analytical Chemistry》 62 (11): 1100–1102. doi:10.1134/S1061934807110160. S2CID 96141217.
- ↑ Ralph, Jolyon; Chau, Ida (2011년 8월 24일). “Petalite: Petalite mineral information and data”. 2011년 11월 27일에 확인함.
- ↑ 가 나 Winter, Mark. “WebElements Periodic Table of the Elements | Lithium | historical information”. 2011년 11월 27일에 확인함.
- ↑ Weeks, Mary (2003). 《Discovery of the Elements》. Whitefish, Montana, United States: Kessinger Publishing. 124쪽. ISBN 978-0-7661-3872-8. 2009년 8월 10일에 확인함.[깨진 링크(과거 내용 찾기)]
- ↑ “Johan Arfwedson”. 2008년 6월 5일에 원본 문서에서 보존된 문서. 2009년 8월 10일에 확인함.
- ↑ 가 나 van der Krogt, Peter. “Lithium”. Elementymology & Elements Multidict. 2010년 10월 5일에 확인함.
- ↑ Clark, Jim (2005). “Compounds of the Group 1 Elements”. 《chemguide》. 2009년 8월 10일에 확인함.
- ↑ 가 나 Krebs, Robert E. (2006). 《The History and Use of Our Earth's Chemical Elements: A Reference Guide》. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2.
- ↑ 가 나 Leach, Mark R. (1999–2012). “The Internet Database of Periodic Tables”. 《meta-synthesis.com》. 2012년 4월 6일에 확인함.
- ↑ Kaner, Richard (2003). “C&EN: It's Elemental: The Periodic Table – Cesium”. American Chemical Society. 2010년 2월 25일에 확인함.
- ↑ Kirchhoff, G.; Bunsen, R. (1861). “Chemische Analyse durch Spectralbeobachtungen” (PDF). 《Annalen der Physik und Chemie》 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ↑ Weeks, Mary Elvira (1932). “The discovery of the elements. XIII. Some spectroscopic discoveries”. 《Journal of Chemical Education》 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ↑ "caesium". 《옥스퍼드 영어 사전》. 옥스퍼드 대학교 출판부. 제 2판 1989.
- ↑ Newlands, John A. R. (1864년 8월 20일). “On Relations Among the Equivalents”. 《Chemical News》 10: 94–95. 2011년 1월 1일에 원본 문서에서 보존된 문서. 2013년 11월 25일에 확인함.
- ↑ Newlands, John A. R. (1865년 8월 18일). “On the Law of Octaves”. 《Chemical News》 12: 83. 2011년 1월 1일에 원본 문서에서 보존된 문서. 2013년 11월 25일에 확인함.
- ↑ Mendelejew, Dimitri (1869). “Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente”. 《Zeitschrift für Chemie》 (독일어): 405–406.
- ↑ Jensen, William B. (2003). “The Place of Zinc, Cadmium, and Mercury in the Periodic Table” (PDF). 《Journal of Chemical Education》 (American Chemical Society) 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. 2010년 6월 11일에 원본 문서 (PDF)에서 보존된 문서. 2012년 5월 6일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 머 버 Royal Society of Chemistry. “Visual Elements: Group 1 – The Alkali Metals”. 《Visual Elements》. Royal Society of Chemistry. 2012년 8월 5일에 원본 문서에서 보존된 문서. 2012년 1월 13일에 확인함.
- ↑ 가 나 Fontani, Marco (2005년 9월 10일). 〈The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do)〉. 《International Conference on the History of Chemistry》. Lisbon. 1–8쪽. 2006년 2월 24일에 원본 문서에서 보존된 문서. 2007년 4월 8일에 확인함.
- ↑ 가 나 Van der Krogt, Peter (2006년 1월 10일). “Francium”. 《Elementymology & Elements Multidict》. 2007년 4월 8일에 확인함.
- ↑ “Education: Alabamine & Virginium”. 《TIME》. 1932년 2월 15일. 2011년 1월 30일에 원본 문서에서 보존된 문서. 2007년 4월 1일에 확인함.
- ↑ MacPherson, H. G. (1934). “An Investigation of the Magneto-Optic Method of Chemical Analysis”. 《Physical Review》 (American Physical Society) 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- ↑ Adloff, Jean-Pierre; Kaufman, George B. (25 September 2005). Francium (Atomic Number 87), the Last Discovered Natural Element 보관됨 4 6월 2013 - 웨이백 머신. The Chemical Educator 10 (5). Retrieved 26 March 2007.
- ↑ 〈Francium〉. 《McGraw-Hill Encyclopedia of Science & Technology》 7. McGraw-Hill Professional. 2002. 493–494쪽. ISBN 978-0-07-913665-7.
- ↑ Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J.; Gregorich, K. E.; Seaborg, G. (1985). “Search for superheavy elements using 48Ca + 254Esg reaction”. 《Physical Review C》 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034.
- ↑ van der Krogt, Peter. “Ununennium”. Elementymology & Elements Multidict. 2011년 2월 14일에 확인함.
- ↑ 가 나 Lodders, Katharina (2003). “Solar System Abundances and Condensation Temperatures of the Elements”. 《The Astrophysical Journal》 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492.
- ↑ Oddo, Giuseppe (1914). “Die Molekularstruktur der radioaktiven Atome”. 《Zeitschrift für Anorganische Chemie》 87: 253–268. doi:10.1002/zaac.19140870118.
- ↑ Harkins, William D. (1917). “The Evolution of the Elements and the Stability of Complex Atoms. I. A New Periodic System Which Shows a Relation Between the Abundance of the Elements and the Structure of the Nuclei of Atoms”. 《Journal of the American Chemical Society》 39 (5): 856–879. doi:10.1021/ja02250a002.
- ↑ North, John (2008). 《Cosmos an illustrated history of astronomy and cosmology》 Rev. a updat판. Univ. of Chicago Press. 602쪽. ISBN 978-0-226-59441-5.
- ↑ Morgan, J. W.; Anders, E. (1980). “Chemical composition of Earth, Venus, and Mercury”. 《Proceedings of the National Academy of Sciences》 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMC 350422. PMID 16592930.
- ↑ Albarède, Francis (2003). 《Geochemistry: an introduction》. Cambridge University Press. ISBN 978-0-521-89148-6.
- ↑ “Abundance in Earth's Crust”. WebElements.com. 2007년 4월 14일에 확인함.
- ↑ “List of Periodic Table Elements Sorted by Abundance in Earth's crust”. Israel Science and Technology Directory.
- ↑ 가 나 Lide, D. R., 편집. (2005). 《CRC Handbook of Chemistry and Physics》 86판. Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ “Lithium Occurrence”. Institute of Ocean Energy, Saga University, Japan. 2009년 5월 2일에 원본 문서에서 보존된 문서. 2009년 3월 13일에 확인함.
- ↑ “Some Facts about Lithium”. ENC Labs. 2011년 7월 10일에 원본 문서에서 보존된 문서. 2010년 10월 15일에 확인함.
- ↑ Schwochau, Klaus (1984). 〈Extraction of metals from sea water〉. 《Inorganic Chemistry》. Topics in Current Chemistry. 124/1984. 91–133쪽. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0.
- ↑ Wise, M. A. (1995). “Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites”. 《Mineralogy and Petrology》 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588. S2CID 140585007.
- ↑ 가 나 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). “Mineral Commodity Profile: Cesium” (PDF). United States Geological Survey. 2009년 11월 22일에 원본 문서 (PDF)에서 보존된 문서. 2009년 12월 27일에 확인함.
- ↑ 가 나 다 Wieser, Michael E.; Berglund, Michael (2009). “Atomic weights of the elements 2007 (IUPAC Technical Report)” (PDF). 《Pure Appl. Chem.》 (IUPAC) 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03. S2CID 98084907. 2012년 2월 7일에 확인함.
- ↑ 가 나 다 라 Wieser, Michael E.; Coplen, Tyler B. (2011). “Atomic weights of the elements 2009 (IUPAC Technical Report)” (PDF). 《Pure Appl. Chem.》 (IUPAC) 83 (2): 359–396. doi:10.1351/PAC-REP-10-09-14. S2CID 95898322. 2012년 2월 11일에 확인함.
- ↑ 《CRC Handbook of Chemistry and Physics》 4. CRC. 2006. 12쪽. ISBN 978-0-8493-0474-3.
- ↑ Emsley, John (2001). 《Nature's Building Blocks》. Oxford: Oxford University Press. 151–153쪽. ISBN 978-0-19-850341-5.
- ↑ Gagnon, Steve. “Francium”. Jefferson Science Associates, LLC. 2007년 3월 31일에 원본 문서에서 보존된 문서. 2007년 4월 1일에 확인함.
- ↑ Winter, Mark. “Geological information”. 《Francium》. The University of Sheffield. 2007년 3월 26일에 확인함.
- ↑ “It's Elemental — The Periodic Table of Elements”. Jefferson Lab. 2007년 4월 29일에 원본 문서에서 보존된 문서. 2007년 4월 14일에 확인함.
- ↑ 가 나 Averill, Bruce A.; Eldredge, Patricia (2007). 〈21.3: The Alkali Metals〉. 《Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry》 1판. Prentice Hall. ISBN 978-0-8053-3799-0. 2013년 6월 24일에 확인함.
- ↑ “Standard Uncertainty and Relative Standard Uncertainty”. 《CODATA reference》. National Institute of Standards and Technology. 2011년 9월 26일에 확인함.
- ↑ 가 나 다 Andreev, S.V.; Letokhov, V.S.; Mishin, V.I. (1987). “Laser resonance photoionization spectroscopy of Rydberg levels in Fr”. 《Phys. Rev. Lett.》 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ↑ Pauling, Linus (1960). 《The Nature of the Chemical Bond》 Thi판. Cornell University Press. 93쪽. ISBN 978-0-8014-0333-0.
- ↑ Allred, A. L. (1961). “Electronegativity values from thermochemical data”. 《J. Inorg. Nucl. Chem.》 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- ↑ Vanýsek, Petr (2011). “Electrochemical Series”, in Handbook of Chemistry and Physics: 92nd Edition Archived 2017년 7월 24일 - 웨이백 머신 (Chemical Rubber Company).
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 Clark, Jim (2005). “Atomic and Physical Properties of the Group 1 Elements”. 《chemguide》. 2012년 1월 30일에 확인함.
- ↑ Gray, Theodore. “Facts, pictures, stories about the element Cesium in the Periodic Table”. 《The Wooden Periodic Table Table》. 2012년 1월 13일에 확인함.
- ↑ The OpenLearn team (2012). “Alkali metals”. 《OpenLearn》. The Open University. 2012년 7월 9일에 확인함.
- ↑ Gray, Theodore. “Alkali Metal Bangs”. Theodore Gray. 2012년 5월 13일에 확인함.
- ↑ 가 나 Lide, D. R., 편집. (2003). 《CRC Handbook of Chemistry and Physics》 84판. Boca Raton, FL: CRC Press.
- ↑ Dye, James L.; Ceraso, Joseph M.; Lok, Mei; Barnett, B. L.; Tehan, Frederick J. (1974). “Crystalline salt of the sodium anion (Na−)”. 《J. Am. Chem. Soc.》 96 (2): 608–609. doi:10.1021/ja00809a060.
- ↑ Tehan, Frederick J.; Barnett, B. L.; Dye, James L. (1974). “Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion”. 《J. Am. Chem. Soc.》 96 (23): 7203–7208. doi:10.1021/ja00830a005.
- ↑ Dye, J. L. (1979). “Compounds of Alkali Metal Anions”. 《Angew. Chem. Int. Ed. Engl.》 18 (8): 587–598. doi:10.1002/anie.197905871.
- ↑ Redko, M. Y.; Huang, R. H.; Jackson, J. E.; Harrison, J. F.; Dye, J. L. (2003). “Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−”. 《J. Am. Chem. Soc.》 125 (8): 2259–2263. doi:10.1021/ja027241m. PMID 12590555.
- ↑ 가 나 Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). “"Inverse sodium hydride": a crystalline salt that contains H+ and Na−”. 《J. Am. Chem. Soc.》 124 (21): 5928–5929. doi:10.1021/ja025655+. PMID 12022811.
- ↑ Sawicka, A.; Skurski, P.; Simons, J. (2003). “Inverse Sodium Hydride: A Theoretical Study” (PDF). 《J. Am. Chem. Soc.》 125 (13): 3954–3958. doi:10.1021/ja021136v. PMID 12656631.
- ↑ Burgess, John (1978). 《Metal Ions in Solution》. Chichester: Ellis Horwood. 20쪽. ISBN 978-0-85312-027-8.
- ↑ 가 나 Richens, David. T. (1997). 《The Chemistry of Aqua Ions》. Wiley. ISBN 978-0-471-97058-3.
- ↑ Persson, Ingmar (2010). “Hydrated metal ions in aqueous solution: How regular are their structures?” (PDF). 《Pure Appl. Chem.》 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22. S2CID 98411500. 2014년 8월 23일에 확인함.
- ↑ Clark, Jim (2005). “Reaction of the Group 1 Elements with Oxygen and Chlorine”. 《chemguide》. 2012년 6월 27일에 확인함.
- ↑ Shriver, Duward; Atkins, Peter (2006). 《Inorganic Chemistry》. W. H. Freeman. 259쪽. ISBN 978-0-7167-4878-6. 2012년 11월 10일에 확인함.
- ↑ 가 나 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). 〈Transactinides and the future elements〉. Morss; Edelstein, Norman M.; Fuger, Jean. 《The Chemistry of the Actinide and Transactinide Elements》 3판. Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5.
- ↑ 가 나 다 라 Thayer, John S. (2010). “Relativistic Effects and the Chemistry of the Heavier Main Group Elements”. 《Relativistic Methods for Chemists》. Challenges and Advances in Computational Chemistry and Physics 10: 81, 84. doi:10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8.
- ↑ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. (2001). “Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)”. 《J. Chem. Phys.》 115 (6): 2389. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413.
- ↑ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. (2015년 6월 22일). 〈s-block Metal-Metal Bonds〉. Liddle, Stephen T. 《Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties》. John Wiley and Sons. 23–24쪽. ISBN 978-3-527-33541-1.
- ↑ 가 나 Various authors (2002). Lide, David R., 편집. 《Handbook of Chemistry & Physics》 88판. CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. 2017년 7월 24일에 원본 문서에서 보존된 문서. 2008년 5월 23일에 확인함.
- ↑ “Universal Nuclide Chart”. 《Nucleonica》. Institute for Transuranium Elements. 2007–2012. 2011년 4월 17일에 확인함.
- ↑ 가 나 다 Sonzogni, Alejandro. “Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. 2018년 10월 10일에 원본 문서에서 보존된 문서. 2012년 10월 4일에 확인함.
- ↑ Patton, I. Jocelyn; Waldbauer, L. J. (1926). “The Radioactivity of the Alkali Metals”. 《Chemical Reviews》 3: 81–93. doi:10.1021/cr60009a003.
- ↑ McLennan, J. C.; Kennedy, W. T. (1908). “On the radioactivity of potassium and other alkali metals”. 《Philosophical Magazine》. 6 16 (93): 377–395. doi:10.1080/14786440908636519.
- ↑ “Potassium-40” (PDF). 《Human Health Fact Sheet》. Argonne National Laboratory, Environmental Science Division. August 2005. 2012년 3월 7일에 원본 문서 (PDF)에서 보존된 문서. 2012년 2월 7일에 확인함.
- ↑ National Institute of Standards and Technology. “Radionuclide Half-Life Measurements”. 2016년 8월 12일에 원본 문서에서 보존된 문서. 2011년 11월 7일에 확인함.
- ↑ Radioisotope Brief: Cesium-137 (Cs-137). U.S. National Center for Environmental Health
- ↑ 《The Radiological Accident in Goiânia》. IAEA. 1988.
- ↑ Delacroix, D.; Guerre, J. P.; Leblanc, P.; Hickman, C. (2002). 《Radionuclide and Radiation Protection Data Handbook 2002》 2판. Nuclear Technology Publishing. ISBN 978-1-870965-87-3.
- ↑ L. Brown, Theodore; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Burdge, Julia R. (2003). 《Chemistry: The Central Science》 8판. US: Pearson Education. ISBN 978-0-13-061142-0.
- ↑ Clark, Jim (2005). “Reaction of the Group 1 Elements with Water”. 《chemguide》. 2012년 6월 18일에 확인함.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). 온라인 수정 버전: (2006–) "Electronegativity". doi 10.1351/goldbook.E01990
- ↑ Goldberg, David E. (1988). 《3,000 Solved Problems in Chemistry》 1판. McGraw-Hill. ISBN 978-0-07-023684-4. Section 17.43, page 321
- ↑ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, 편집. (1999). 《Pollution Prevention: The Waste Management Approach to the 21st Century》. CRC Press. 15 Section 27쪽. ISBN 978-1-56670-495-3.
- ↑ 가 나 Clark, Jim (2000). “Metallic Bonding”. 《chemguide》. 2012년 3월 23일에 확인함.
