가지사슬 아미노산


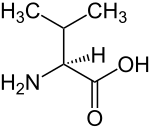
가지사슬 아미노산(영어: branched-chain amino acid, BCAA)은 가지사슬(3개 이상의 탄소 원자와 결합한 중심 탄소 원자)이 있는 지방족 곁사슬을 가지고 있는 아미노산이다. 분지쇄 아미노산이라고도 한다. 단백질생성성 아미노산 중에서는 류신, 아이소류신, 발린의 세 가지 가지사슬 아미노산이 있다.[1] 단백질비생성성 아미노산 중에서는 2-아미노아이소뷰티르산이 가지사슬 아미노산이다.
류신, 아이소류신, 발린은 사람의 9가지 필수 아미노산들 중 하나로, 근육 단백질에 있는 필수 아미노산의 35%, 포유류가 필요로 하는 미리 형성된 아미노산의 40%를 차지한다.[2] 가지사슬 아미노산의 합성은 대사 경로에서 효소를 암호화하는 mRNA의 존재에 의해 결정되는 바와 같이 식물의 모든 위치에서 세포 내의 색소체에서 합성된다.[3]
가지사슬 아미노산은 여러 대사 및 생리학적 역할을 수행한다. 대사적으로 가지사슬 아미노산은 단백질 합성 및 전환, 신호전달 경로 및 포도당의 대사를 촉진한다.[4][5] 가지사슬 아미노산의 산화는 지방산 산화를 증가시키고 비만에 중요한 역할을 할 수 있다. 생리학적으로 가지사슬 아미노산은 면역계와 뇌 기능에서 역할을 한다. 가지사슬 아미노산은 면역 세포에서 발현되는 탈수소효소 및 탈카복실화효소에 의해 효과적으로 분해되며 림프구 생장 및 증식, 세포독성 T 림프구의 활성에 필요하다.[4] 마지막으로 가지사슬 아미노산은 뇌로 운반될 시 방향족 아미노산(페닐알라닌, 티로신, 트립토판)과 동일한 수송 단백질을 공유한다. 가지사슬 아미노산은 일단 뇌로 들어가면 단백질 합성, 신경전달물질 합성, 에너지 생성에 역할을 할 수 있다.[4]
각종 음식을 통해 섭취할 수 있으며 육류, 콩, 우유, 통밀, 옥수수, 견과류, 현미등에 다량 함유되어 있다.
필요 요건
[편집]미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)를 제정했다. 19세 이상의 성인의 경우 매일 체중 1 kg당 42 mg의 류신, 19 mg의 아이소류신, 24 mg의 발린이 필요하다.[6] 체중이 70 kg인 사람의 경우 하루에 2.9 g의 류신, 1.3 g의 아이소류신, 1.7 g의 발린에 해당한다. 총 단백질에 대한 권장 식이 허용량(0.8 g/kg/일, 70 kg의 사람의 경우 56 g)을 충족하거나 초과하는 식단은 가지사슬 아미노산에 대한 권장 식이 허용량을충족하거나 초과한다.
연구
[편집]식이 가지사슬 아미노산은 간성뇌증의 일부 사례를 치료하기 위해 사용되었다.[7] 이들은 간성뇌증의 증상을 완화시키는 효과를 가질 수 있지만 사망률, 영양 또는 전반적인 삶의 질에 도움이 된다는 증거가 없기 때문에 추가적인 연구가 필요하다.[8]
특정 연구에서는 프로 미식 축구 선수들과 이탈리아 축구 선수들 사이에서 근위축성 측삭경화증의 높은 발병률과 가지사슬 아미노산을 포함하는 특정 스포츠 보충제 사이에 연관성이 있을 수 있다고 제안했다.[9] 쥐를 대상으로 한 연구에서 가지사슬 아미노산은 근위축성 측삭경화증 환자에서 일반적으로 관찰되는 것과 유사한 세포 과흥분성을 유발하는 것으로 나타났다. 제안된 기본 메커니즘은 세포 과흥분성이 세포에 의한 칼슘의 흡수를 증가시켜 특히 칼슘 완충 능력이 낮은 신경 세포의 세포 사멸을 초래한다는 것이다.[9] 그러나 가지사슬 아미노산과 근위축성 측삭경화증 사이의 어떤 연결고리는 완전히 확립된 채로 남아 있다. 가지사슬 아미노산은 근위축성 측삭경화증을 앓고 있는 쥐에서 관찰된 것과 유사한 과흥분성을 유발할 수 있지만, 장기간에 걸쳐 제공된 가자사슬 아미노산이 풍부한 식단이 실제로 근위축성 측삭경화증과 유사한 증상을 유도하는지 여부는 아직 불분명하다.[9]
혈중 가지사슬 아미노산의 농도는 비만, 인슐린 저항성을 가진 사람 및 식이 유발 당뇨병을 앓고 있는 쥐에서 증가하며, 가지사슬 아미노산이 비만과 당뇨병의 병인에 기여할 가능성을 시사한다.[10][11] 가지사슬 아미노산을 제한한 식단은 정상 체중 쥐의 포도당 내성을 개선하고 날씬함을 촉진하며,[12] 비만 쥐의 인슐린 감수성과 정상 체중을 회복시키고[13] 비만 쥐의 인슐린 감수성을 촉진한다.[14] 마른 쥐와 비만 쥐에서 가지사슬 아미노산 제한의 이러한 이점은 류신 제한이 아니라 아이소류신과 발린에 의해 매개된다.[15]
파리에서 식이 가지사슬 아미노산을 제한하면 수명이 연장되는 반면,[16] 쥐에서 가지사슬 아미노산을 제한한면 수컷은 수명이 연장되고 노쇠가 감소하지만 암컷은 수명이 연장되지 않는다.[17] 쥐에서 가지사슬 아미노산만으로 식이 보충제를 섭취하면 수명이 단축되고 비만이 촉진된다.[18] 그러나 가지사슬 아미노산이 풍부한 필수 아미노산 보충제를 섭취하면 쥐의 수명이 연장된다.[19]
합성
[편집]5가지 효소(트레오닌 탈수소효소, 아세토하이드록시산 생성효소, 케토산 환원이성질화효소, 다이하이드록시산 탈수소효소, 아미노기전이효소)가 류신, 아이소류신, 발린의 병렬 합성 경로에서 중요한 역할을 한다.[3] 트레오닌 탈수소효소는 트레오닌의 2-케토뷰티르산 및 암모니아로의 탈아미노화 및 탈수를 촉매한다. 아이소류신은 트레오닌 탈수소효소와 함께 음성 피드백 루프를 형성한다. 아세토하이드록시산 생성효소는 두 단계에서 축합 반응을 수행하는 병렬 경로의 첫 번째 효소이다. 즉, 발린 경로에서 피루브산을 아세토아세트산으로 축합하고 아이소류신 경로에서 피루브산과 2-케토뷰티르산을 축합하여 아세토하이드록시뷰티르산을 생성한다. 다음으로 케토산 환원이성질화효소는 이전 단계의 아세토하이드록시산을 환원시켜 발린 경로와 아이소류신 경로 모두에서 다이하이드록시산을 생성한다. 다이하이드록시산 탈수소효소는 다음 단계에서 다이하이드록시산을 전환시킨다. 병렬 경로의 마지막 단계는 최종 생성물인 발린과 아이소류신을 생성하는 아미노기전이효소에 의해 수행된다.[3] 2-옥소아이소발레르산으로부터 류신을 생성하려면 일련의 4가지 효소(아이소프로필말산 생성효소, 아이소프로필말산 이성질화효소, 아이소프로필말산 탈수소효소, 아미노기전이효소)가 더 필요하다.[3]
분해
[편집]가지사슬 아미노산의 분해 과정에는 가지사슬 α-케토산 탈수소효소 복합체가 관여한다. 가지사슬 α-케토산 탈수소효소 복합체가 결핍되면 혈액과 소변에 가지사슬 아미노산(류신, 아이소류신, 발린)과 독성 부산물이 축적되는 데 이러한 상태를 단풍시럽뇨병이라고 한다. 한편 가지사슬 α-케토산 탈수소효소 복합체의 확인되지 않은 활성은 가지사슬 케토산 탈수소효소 키네이스 결핍증을 유발한다.
 |
가지사슬 α-케토산 탈수소효소 복합체는 가지사슬 아미노산을 아실-CoA 유도체로 전환하고, 후속 반응 후에 시트르산 회로로 들어갈 수 있는 아세틸-CoA 또는 석시닐-CoA로 전환된다.[20]
관련된 효소는 가지사슬 아미노산 아미노기전이효소와 3-메틸-2-옥소뷰탄산 탈수소효소이다.
단풍시럽뇨병
[편집]단풍시럽뇨병을 앓고 있는 쥐에서 가지사슬 아미노산의 급성 투여는 뇌의 해마 영역에서 DNA의 손상을 증가시킨다.[21] 그림은 가지사슬 아미노산의 분해 경로와 특히 단풍시럽뇨병에서 부적절한 가지사슬 α-케토산 탈수소효소 복합체의 핵심적인 역할을 보여준다. 가지사슬 아미노산의 만성 투여는 급성 투여에 비해 해마 뿐만 아니라 뇌의 선조체 영역에서도 DNA의 손상을 증가시켰다.[21] 항산화 치료는 이러한 뇌 영역의 DNA 손상을 예방할 수 있었으며, 이는 가지사슬 아미노산이 산화 스트레스 생성을 통해 DNA의 손상을 유발한다는 것을 시사한다.
세포 신호전달
[편집]대부분의 아미노산은 간에서 산화되지만 가지사슬 아미노산은 주로 골격근 및 기타 말초 조직에서 산화된다.[4] 쥐의 횡격막의 근육 생장에 대한 가지사슬 아미노산의 투여 효과를 테스트한 결과, 가지사슬 아미노산의 혼합물만 단독으로 아미노산의 완전한 혼합물과 동일한 생장 효과를 가질 뿐만 아니라 가지사슬 아미노산을 제외한 모든 아미노산 혼합물이 쥐의 횡격막의 근육 생장에 영향을 미치지 않는다는 결론을 내렸다.[22] 아이소류신 또는 발린의 단독 투여는 근육 생장에 영향을 미치지 않았지만, 류신의 단독 투여는 가지사슬 아미노산의 완전한 혼합물만큼 효과적인 것으로 나타났다. 류신은 p70-S6 키네이스 1를 간접적으로 활성화할 뿐만 아니라 번역 개시에서 mRNA에 필수적인 eIF4F 복합체의 조립을 자극한다.[22] p70-S6 키네이스 1은 mTOR 신호전달 경로의 일부이며, 적응성 비대 및 쥐 근육의 회복을 허용하는 것으로 나타났다.[23] 휴식시 단백질 주입은 주입 시작 30분 후 단백질 합성을 자극하고 단백질 합성은 추가로 90분 동안 상승된 상태를 유지한다.[24] 휴식시 류신을 주입하면 골격근에서 p70-S6 키네이스 1의 인산화에 의해 6시간 동안 자극 효과가 지속되며 단백질 합성이 증가한다.[24] 저항 운동 후 가지사슬 아미노산의 투여 없이 저항 운동 세션은 mTOR 인산화에 영향을 미치지 않으며 심지어 Akt 인산화를 감소시킨다. p70-S6 키네이스 1의 일부 인산화가 발견되었다. 트레이닝 세션 후에 가지사슬 아미노산을 투여했을 때 p70-S6 키네이스 1와 S6의 충분한 인산화가 신호전달 캐스케이드의 활성화를 나타낸다.[24]
제2형 당뇨병에서의 역할
[편집]세포 신호전달 외에도 mTOR 경로는 인슐린 분비를 유도하는 β 세포의 생장에도 역할을 한다.[25] 혈액 내의 높은 농도의 포도당은 류신이 간접적인 역할을 하는 mTOR 신호전달 경로의 과정을 개시한다.[23][26] 포도당, 류신 및 기타 활성인자들의 조합은 mTOR이 β 세포의 증식 및 인슐린 분비에 대한 신호전달을 개시하도록 한다. 더 높은 농도의 류신은 mTOR 경로에서 과활성을 유발하고 S6 키네이스가 활성화되어 세린의 인산화를 통해 인슐린 수용체 기질의 억제를 유도한다.[25][26] 세포에서 mTOR 복합체의 증가된 활성은 궁극적으로 β 세포가 인슐린을 방출하지 못하게 하고 S6 키네이스의 억제 효과가 세포에서 인슐린 저항성을 유도하여 제2형 당뇨병의 발병에 기여한다.[25]
메트포르민은 mTOR 경로에 관여하는 단백질을 인산화하는 AMP 키네이스를 활성화할 수 있을 뿐만 아니라 mTOR 복합체가 비활성 상태에서 활성 상태로 진행되도록 한다.[25] 매트포르민은 mTOR 경로에서 류신에 대한 경쟁적 저해제로 작용한다고 제안되었다.
가지사슬 아미노산 보충제가 운동에 미치는 영향
[편집]가지사슬 아미노산은 포도당에 대해 인슐린과 같은 효과를 가지고 있어서 포도당의 수치를 감소시킨다. 운동 전에 섭취한 가지사슬 아미노산은 골격근에 의해 산화되어 운동 중에 에너지로 사용될 수 있기 때문에 간에서 글리코젠 분해의 수준을 증가시킬 필요가 줄어든다. 무산소 운동 중에 포도당 대사로 생성된 피루브산은 젖산으로 전환되며, 젖산이 축적되면 pH 수준이 6.4만큼 낮은 대사성 산증을 유발할 수 있다.[27] 높은 수준의 젖산은 pH의 추가적인 감소를 줄이기 위해 포도당 대사를 중단시킨다. 가지사슬 아미노산 보충제는 근육의 젖산 수치를 감소시켜 포도당 대사를 계속하게 하는 것으로 나타났다.[28] 이것은 간에서 글리코젠 분해 속도를 감소시키고 결과적으로 혈장에서의 포도당의 수준을 낮춘다. 그러나 혈당 수치에 대한 가지사슬 아미노산의 장기적인 영향에 관한 연구에 따르면 가지사슬 아미노산을 지속적으로 보충하면 운동 이외의 혈당 수치에 눈에 띄는 영향을 미치지 않는 것으로 나타났다.[28]
최근의 연구에 따르면 가지사슬 아미노산은 혈액 내의 순환하는 유리 지방산의 수치를 감소시키는 것으로 나타났다.[28] 유리 지방산은 트립토판과 알부민의 결합 부위를 두고 경쟁하며, 혈중 유리 지방산의 수준이 감소하면 알부민에 더 많이 결합하여 유리 트립토판의 수준도 감소한다. 운동을 하는 동안 뇌로 들어가는 유리 트립토판의 수치가 증가하여 피로감을 유발하는 5-하이드록시트립타민(5-HT, 세로토닌)이 증가한다. 혈액 내 유리 지방산의 수치 감소를 통해 가지사슬 아미노산은 뇌로 들어가는 유리 트립토판의 수치를 낮추고 운동으로 인한 피로감을 줄이는 데 도움이 될 수 있다.[29] 뇌에서 트립토판의 흡수가 감소하면 세로토닌의 합성 및 방출이 감소(쥐에서[30])한다. 세로토닌의 감소는 90%에 이를 수 있다. 세로토닌의 수치가 낮으면 피로감이 감소하지만 집중력 부족, 충동 조절 능력 저하, 공격적 행동 및 계획 설계 능력 부족을 유발하기도 한다.
가지사슬 아미노산은 또한 뇌에서 티로신의 흡수를 저해(티로신은 트립토판과 같은 방향족 아미노산이다)한다. 감소된 티로신의 섭취는 뇌에서 카테콜아민의 합성과 방출을 억제한다. 카테콜아민은 신체 기능의 향상과 관련이 있다. 카테콜아민과 세로토닌 합성의 동시적인 감소는 가지사슬 아미노산이 신체 활동에 미치는 상대적으로 중립적인 영향을 설명할 수 있게 한다.[30]
가지사슬 아미노산은 또한 운동 중에 발생하는 암모니아의 혈청 수준의 증가를 감소시키는 것으로 밝혀졌다. 이것은 글루타민의 합성에 사용되는 암모니아의 양을 증가시켜 혈액에 암모니아가 과도하게 축적되는 것을 방지함으로써 이루어진다.[28] 뇌의 암모니아 수치가 증가하면 γ-아미노뷰티르산(GABA)와 글루탐산의 수치가 낮아져 중추신경계 피로가 증가한다. 근육 조직의 암모니아 수준의 증가는 또한 포스포프럭토키네이스(PFK)의 활성을 증가시켜 근육 피로의 주요 원인인 젖산을 증가시킨다.[31]
또한 가지사슬 아미노산 보충제는 운동 후에 근육 세포의 크레아틴 키네이스의 수치를 감소시키는 것으로 나타났다. 크레아틴 키네이스는 근육 손상의 지표이며 ATP로부터 인산기를 전달하여 포스포크레아틴을 생성하는 역할을 한다.[32] 가지사슬 아미노산의 보충은 크레아틴 키네이스의 수준을 감소시켜 세포 내 ATP의 수준을 높이고 피로감을 줄이는 것으로 나타났다.[33]
같이 보기
[편집]- 가지사슬 α-케토산 탈수소효소 복합체
- 단풍시럽뇨병 – 생물체에 가지사슬 아미노산이 과도하게 축적되는 질환
- 가지사슬 아미노산 탈수소효소 키네이스 결핍증 – 생물체에서 불충분한 가지사슬 아미노산 수준으로 인해 발생하는 증상
각주
[편집]- ↑ Sowers S. “A Primer on Branched Chain Amino Acids” (PDF). Huntington College of Health Sciences. 2017년 8월 28일에 원본 문서 (PDF)에서 보존된 문서. 2011년 3월 22일에 확인함.
- ↑ Shimomura Y, Murakami T, Nakai N, Nagasaki M, Harris RA (June 2004). “Exercise encourages BCAA catabolism: effects of BCAA supplementation on skeletal muscle during exercise”. 《The Journal of Nutrition》 134 (6 Suppl): 1583S–1587S. doi:10.1093/jn/134.6.1583S. PMID 15173434.
- ↑ 가 나 다 라 Singh BK, Shaner DL (July 1995). “Biosynthesis of Branched Chain Amino Acids: From Test Tube to Field”. 《The Plant Cell》 7 (7): 935–944. doi:10.1105/tpc.7.7.935. PMC 160890. PMID 12242394.
- ↑ 가 나 다 라 Monirujjaman M (2014). “Metabolic and Physiological Roles of Branched-Chain Amino Acids”. 《Advances in Molecular Biology》 2014: 1–6. doi:10.1155/2014/364976.
- ↑ Babchia N, Calipel A, Mouriaux F, Faussat AM, Mascarelli F (January 2010). “The PI3K/Akt and mTOR/P70S6K signaling pathways in human uveal melanoma cells: interaction with B-Raf/ERK”. 《Investigative Ophthalmology & Visual Science》 51 (1): 421–9. doi:10.1167/iovs.09-3974. PMID 19661225.
- ↑ Institute of Medicine (2002). 〈Protein and Amino Acids〉. 《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ↑ Chadalavada R, Sappati Biyyani RS, Maxwell J, Mullen K (June 2010). “Nutrition in hepatic encephalopathy”. 《Nutrition in Clinical Practice》 25 (3): 257–64. doi:10.1177/0884533610368712. PMID 20581319.
- ↑ Gluud LL, Dam G, Les I, Marchesini G, Borre M, Aagaard NK, Vilstrup H (May 2017). “Branched-chain amino acids for people with hepatic encephalopathy”. 《The Cochrane Database of Systematic Reviews》 5: CD001939. doi:10.1002/14651858.cd001939.pub4. PMC 6481897. PMID 28518283.
- ↑ 가 나 다 Manuel M, Heckman CJ (March 2011). “Stronger is not always better: could a bodybuilding dietary supplement lead to ALS?”. 《Experimental Neurology》 228 (1): 5–8. doi:10.1016/j.expneurol.2010.12.007. PMC 3049458. PMID 21167830.
- ↑ Lynch CJ, Adams SH (December 2014). “Branched-chain amino acids in metabolic signalling and insulin resistance”. 《Nature Reviews. Endocrinology》 10 (12): 723–36. doi:10.1038/nrendo.2014.171. PMC 4424797. PMID 25287287.
- ↑ Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF, 외. (April 2009). “A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance”. 《Cell Metabolism》 9 (4): 311–26. doi:10.1016/j.cmet.2009.02.002. PMC 3640280. PMID 19356713.
- ↑ Fontana L, Cummings NE, Arriola Apelo SI, Neuman JC, Kasza I, Schmidt BA, 외. (July 2016). “Decreased Consumption of Branched-Chain Amino Acids Improves Metabolic Health”. 《Cell Reports》 16 (2): 520–530. doi:10.1016/j.celrep.2016.05.092. PMC 4947548. PMID 27346343.
- ↑ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, 외. (February 2018). “Restoration of metabolic health by decreased consumption of branched-chain amino acids”. 《The Journal of Physiology》 596 (4): 623–645. doi:10.1113/JP275075. PMC 5813603. PMID 29266268.
- ↑ White PJ, Lapworth AL, An J, Wang L, McGarrah RW, Stevens RD, 외. (July 2016). “Branched-chain amino acid restriction in Zucker-fatty rats improves muscle insulin sensitivity by enhancing efficiency of fatty acid oxidation and acyl-glycine export”. 《Molecular Metabolism》 5 (7): 538–551. doi:10.1016/j.molmet.2016.04.006. PMC 4921791. PMID 27408778.
- ↑ Yu D, Richardson NE, Green CL, Spicer AB, Murphy ME, Flores V, 외. (May 2021). “The adverse metabolic effects of branched-chain amino acids are mediated by isoleucine and valine”. 《Cell Metabolism》 33 (5): 905–922.e6. doi:10.1016/j.cmet.2021.03.025. PMC 8102360. PMID 33887198.
- ↑ Juricic P, Grönke S, Partridge L (January 2020). “Branched-Chain Amino Acids Have Equivalent Effects to Other Essential Amino Acids on Lifespan and Aging-Related Traits in Drosophila”. 《The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences》 75 (1): 24–31. doi:10.1093/gerona/glz080. PMC 6909895. PMID 30891588.
- ↑ Richardson NE, Konon EN, Schuster HS, Mitchell AT, Boyle C, Rodgers AC, 외. (January 2021). “Lifelong restriction of dietary branched-chain amino acids has sex-specific benefits for frailty and lifespan in mice”. 《Nature Aging》 1 (1): 73–86. doi:10.1038/s43587-020-00006-2. PMC 8009080. PMID 33796866.
- ↑ Solon-Biet SM, Cogger VC, Pulpitel T, Wahl D, Clark X, Bagley E, 외. (May 2019). “Branched chain amino acids impact health and lifespan indirectly via amino acid balance and appetite control”. 《Nature Metabolism》 1 (5): 532–545. doi:10.1038/s42255-019-0059-2. PMC 6814438. PMID 31656947.
- ↑ D'Antona G, Ragni M, Cardile A, Tedesco L, Dossena M, Bruttini F, 외. (October 2010). “Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice”. 《Cell Metabolism》 12 (4): 362–372. doi:10.1016/j.cmet.2010.08.016. PMID 20889128.
- ↑ Sears DD, Hsiao G, Hsiao A, Yu JG, Courtney CH, Ofrecio JM, 외. (November 2009). “Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization”. 《Proceedings of the National Academy of Sciences of the United States of America》 106 (44): 18745–50. Bibcode:2009PNAS..10618745S. doi:10.1073/pnas.0903032106. PMC 2763882. PMID 19841271.
- ↑ 가 나 Scaini G, Jeremias IC, Morais MO, Borges GD, Munhoz BP, Leffa DD, Andrade VM, Schuck PF, Ferreira GC, Streck EL. DNA damage in an animal model of maple syrup urine disease. Mol Genet Metab. 2012 Jun;106(2):169-74. doi: 10.1016/j.ymgme.2012.04.009. Epub 2012 Apr 20. PMID: 22560665
- ↑ 가 나 Kimball SR, Jefferson LS (January 2006). “Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis”. 《The Journal of Nutrition》 136 (1 Suppl): 227S–31S. doi:10.1093/jn/136.1.227S. PMID 16365087.
- ↑ 가 나 Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, 외. (November 2001). “Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo”. 《Nature Cell Biology》 3 (11): 1014–9. doi:10.1038/ncb1101-1014. PMID 11715023. S2CID 16284975.
- ↑ 가 나 다 Blomstrand E, Eliasson J, Karlsson HK, Köhnke R (January 2006). “Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise”. 《The Journal of Nutrition》 136 (1 Suppl): 269S–73S. doi:10.1093/jn/136.1.269S. PMID 16365096.
- ↑ 가 나 다 라 Melnik BC (March 2012). “Leucine signaling in the pathogenesis of type 2 diabetes and obesity”. 《World Journal of Diabetes》 3 (3): 38–53. doi:10.4239/WJD.v3.i3.38. PMC 3310004. PMID 22442749.
- ↑ 가 나 Balcazar Morales N, Aguilar de Plata C (July 2012). “Role of AKT/mTORC1 pathway in pancreatic β-cell proliferation”. 《Colombia Medica》 43 (3): 235–43. doi:10.25100/cm.v43i3.783. PMC 4001958. PMID 24893199.
- ↑ Sahlin K (1986). “Muscle fatigue and lactic acid accumulation”. 《Acta Physiologica Scandinavica. Supplementum》 556: 83–91. PMID 3471061.
- ↑ 가 나 다 라 Hormoznejad R, Javid AZ, Mansoori A (August 2019). “Effect of BCAA supplementation on central fatigue, energy metabolism substrate and muscle damage to the exercise: a systematic review with meta-analysis”. 《Sport Sciences for Health》 15 (2): 265–279. doi:10.1007/s11332-019-00542-4. S2CID 78093727.
- ↑ Watson P, Shirreffs SM, Maughan RJ (December 2004). “The effect of acute branched-chain amino acid supplementation on prolonged exercise capacity in a warm environment”. 《European Journal of Applied Physiology》 93 (3): 306–14. doi:10.1007/s00421-004-1206-2. PMID 15349784. S2CID 20597074.
- ↑ 가 나 Choi S, Disilvio B, Fernstrom MH, Fernstrom JD (November 2013). “Oral branched-chain amino acid supplements that reduce brain serotonin during exercise in rats also lower brain catecholamines”. 《Amino Acids》 45 (5): 1133–42. doi:10.1007/s00726-013-1566-1. PMID 23904096. S2CID 1957988.
- ↑ Mutch BJ, Banister EW (1983). “Ammonia metabolism in exercise and fatigue: a review”. 《Medicine and Science in Sports and Exercise》 15 (1): 41–50. doi:10.1249/00005768-198315010-00009. PMID 6341752.
- ↑ Maughan RJ, Gleeson M (2010). 《The biochemical basis of sports performance》 2판. Oxford University Press. 81–82쪽. ISBN 978-0-19-920828-9. 2019년 12월 6일에 확인함.
- ↑ Rahimi MH, Shab-Bidar S, Mollahosseini M, Djafarian K (October 2017). “Branched-chain amino acid supplementation and exercise-induced muscle damage in exercise recovery: A meta-analysis of randomized clinical trials”. 《Nutrition》 42: 30–36. doi:10.1016/j.nut.2017.05.005. PMID 28870476.