간성 뇌증
 | |
|---|---|
| 다른 이름 | 문맥전신성 뇌증(portosystemic encephalopathy), 간성 혼수(hepatic coma)[1] |
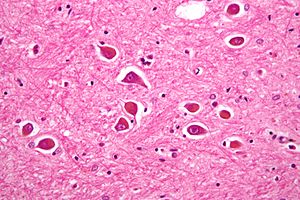 | |
| 간성 뇌증에서 발견되기도 하는 병리 소견인 제2형 알츠하이머 별아교세포의 현미경 사진. | |
| 진료과 | 소화기내과 |
| 증상 | 의식수준 변화, 기분 변화, 인격 장애, 운동 장애,[2] 부정확한 발음, 공격성, 근육 경련, 집중력과 주의력 저하, 자세고정불능증, 인지 장애 (생각, 판단 능력에 혼란이 생김)[3] |
| 유형 | 급성, 재발성, 지속성[4] |
| 병인 | 간부전[2] |
| 위험 인자 | 감염, 위장출혈, 변비, 전해질 불균형, 특정 약물[5] |
| 진단 방식 | 다른 가능한 원인들을 배제 후 증상을 근거로 진단[2][6] |
| 유사 질병 | 베르니케-코르사코프 증후군, 진전섬망, 경막밑혈종, 저나트륨혈증[1] |
| 치료 | 증상 치료, 원인을 찾아 치료, 락툴로오즈, 간이식[1][4] |
| 예후 | 중증 질환이 있는 경우 평균 기대수명 1년 이하[1] |
| 빈도 | 간경화증이 있는 환자의 40% 이상에서 발병[7] |
간성 뇌증(hepatic encephalopathy, HE)은 간부전으로 인해 의식수준이 변화하는 것이다.[2] 점진적으로 나타나거나 갑자기 나타날 수 있다.[2] 다른 증상으로는 운동 장애, 기분 변화, 인격 변화 등이 나타날 수 있다.[2] 후기 간성 뇌증에서는 혼수 상태에 빠질 수도 있다.[4]
간성 뇌증은 급성이나 만성 간질환 환자에게 발생한다.[4] 간성 뇌증 발생을 촉발하는 원인에는 감염, 위장출혈, 변비, 전해질 불균형, 특정 약물 등이 있다.[5] 발생 기전은 정상적으로는 간에 의해 제거되어야 하는 암모니아가 혈액 내에 축적되는 것이라고 생각된다.[2] 진단은 다른 잠재적 원인들을 배제한 후 증상을 근거로 내린다.[2][6] 진단을 도울 수 있는 근거에는 혈중 암모니아 농도, 뇌전도, 뇌의 CT 스캔 등이 있다.[4][6]
치료를 통해 간성 뇌증 상태를 되돌릴 수도 있다.[1] 증상 치료와 간성 뇌증을 촉발한 원인을 치료하여 일반적으로 치료를 시행한다.[4] 암모니아 농도를 낮추기 위해 락툴로오즈가 자주 사용된다.[1] 리팍시민과 같은 특정 항생제나 프로바이오틱도 가능한 치료 선택지이다.[1] 중증 간성 뇌증 환자를 대상으로는 간이식을 시행하여 치료 성과를 개선할 수 있다.[1]
간경화증 환자의 40% 이상에서 간성 뇌증이 발생한다.[7] 간경화증과 중증 간성 뇌증이 생긴 환자 중 절반 이상은 1년 이상 생존하지 못한다.[1] 간이식을 받은 경우 5년 사망률은 30% 이하이다.[1] 적어도 1860년에는 간성 뇌증이 처음 설명된 것으로 알려져 있다.[1]
증상과 징후[편집]
가장 경증의 간성 뇌증은 임상적으로 진단하기 어렵지만 신경심리검사를 통해 진단할 수도 있다. 주된 증상으로 환자는 건망증, 가벼운 혼란, 과민함 등을 보인다. 1기 간성 뇌증은 낮에 자고 밤에 깨어 있는 수면 패턴의 변화로 나타난다. 2기 간성 뇌증에서는 무기력함과 인격의 변화를 보인다. 3기에서는 혼란 증상이 악화되며 4기 간성 뇌증은 혼수 상태로 진행한다.[4]
1기 이후 더 심각한 유형의 간성 뇌증은 무기력, 졸림에서 결국 혼수 상태까지 의식수준을 악화시킨다. 중등도의 간성 뇌증에서는 사지 말단이 갑자기 홱 움직이는 특징적인 소견(자세고정불능증)이 관찰된다. 졸음이 심해지면 이 소견은 사라진다. 지남력의 상실, 기억상실이 나타나거나 행동을 억제하지 못하는 모습을 보이기도 한다. 3기 간성 뇌증에서는 신경학적 검사를 통해 간대성 경련이나 바빈스키 징후 양성 소견을 밝혀낼 수 있다. 혼수 상태나 발작은 가장 후기의 간성 뇌증에서 나타나며 뇌부종이 있는 경우 사망에 이를 수 있다.[4]
간성 뇌증은 간부전의 다른 증상이나 징후와 동반되는 경우가 잦다. 동반될 수 있는 간부전의 다른 소견에는 황달(피부와 눈의 공막이 비정상적으로 노래지는 소견), 복수(복강 내에 액체가 쌓이는 것), 말초 부위의 부종 등이 있다. 중증의 간성 뇌증에서는 힘줄반사가 정상보다 크게 나타나거나, 비정상적인 발바닥반사(바빈스키 징후, 엄지발가락이 발등 쪽으로 펴지는 비정상 소견)가 관찰되기도 한다. 또한 날숨에서 특유의 입냄새인 간성구취를 맡을 수도 있다.[8]
원인[편집]
소수의 경우, 간성 뇌증이 직접 간부전에 의해 발생하기도 하며, 이는 급성 간부전일 때 더 가능성이 높다. 더 흔하게는 (특히 만성 간질환에서) 다른 부수적인 원인에 의해 간성 뇌증이 유발되며, 이런 유발 원인을 알아내는 게 효율적인 치료에 중요할 수 있다.[4]
| 유형 | 원인[4][8][9] |
|---|---|
| 과도한 질소 부하 |
많은 양의 단백질 소비, 식도정맥류 등에서 생긴 위장출혈 (장에서 혈액으로 단백질이 재흡수되므로 혈액에는 단백질이 많음), 신부전 (요소와 같은 질소를 포함한 노폐물을 잘 배설하지 못하게 됨), 변비 |
| 전해질장애 대사장애 |
저나트륨혈증과 저칼륨혈증 (둘 모두 복수 치료를 위해 사용하는 이뇨제 복용 환자에서 흔함), 알칼리증, 저산소혈증, 탈수 |
| 약물 | 벤조디아제핀 등의 진정제 (알코올 금단 증후군이나 불안장애를 억제하기 위해 종종 사용됨), 마약 (진통제나 남용), 항정신병제제, 알코올 중독 |
| 감염 | 폐렴, 요로감염증, 자발성 세균성 복막염, 기타 |
| 그 외 | 수술, 간질환의 진행, 기타 다른 간 손상의 원인 (알코올성 간염, A형 간염 등) |
| 불명 | 20 ~ 30%의 경우에서는 손상의 원인이 뚜렷하지 않다. |
한편 목정맥경유간속문맥전신순환지름술 (TIPS) 이후에 간성 뇌증이 생기기도 한다. TIPS는 재발하는 복수, 식도정맥류로 인한 출혈, 간신증후군을 치료하기 위해 시행하는 수술로,[10][11] 간문맥과 간정맥 사이에 인공적인 연결 통로를 만들어 줘서 혈관의 압력을 낮춘다.[12] TIPS 관련 뇌증은 수술을 받은 환자의 30% 정도에서 나타난다고 알려져 있다. 간성 뇌증의 병력, 고령, 여성, 알코올 이외의 원인에 의한 간질환 등은 위험 간성 뇌증의 위험을 높이는 인자로 작용한다.[9]
발병기전[편집]

어째서 간 기능의 이상이나 문맥전신지름술이 뇌증을 유발하는지에 대해서는 다양한 설명이 있다. 건강한 사람의 경우 장내미생물군이 음식을 소화시켜 생성한 질소를 포함한 물질들은 장에서 흡수되어 간문맥을 통해 간으로 운송된다. 간에서는 요소 회로를 통해 질소를 포함한 물질의 80 ~ 90%가 대사되거나 즉시 배설된다. 모든 유형의 간성 뇌증에서는 간세포가 노폐물 대사를 제대로 하지 못하거나, 간문맥의 혈액이 곁순환이나 인위적으로 만들어진 지름길을 통해 간을 우회하기 때문에 이러한 대사 과정이 잘 일어나지 못한다. 질소 노폐물은 결국 온몸순환에 축적된다. 가장 중요한 노폐물인 암모니아(NH3)로, 이 작은 분자는 뇌혈관장벽을 가로질러 별아교세포에 의해 흡수, 대사된다. 별아교세포는 뇌의 세포로 대뇌겉질의 30%를 이루고 있으며, 글루탐산염으로부터 글루타민을 합성할 때 암모니아를 이용한다. 글루타민 농도가 상승하면 별아교세포의 삼투압이 올라가 세포가 붓게 된다. 이때 뇌를 억제하는 GABA 시스템의 활동은 증가하며 다른 뇌세포로 가는 에너지 공급은 감소한다. 이러한 일련의 과정은 '세포독성'(cytotoxic) 뇌부종의 예시라고 할 수 있다.[13]
여러 연구들에서 암모니아가 중심적인 역할을 한다는 것을 밝혀 냈지만, 암모니아 농도가 뇌증의 중증도와 항상 비례하지는 않는다. 이러한 현상은 심각한 증상을 보이는 환자들에서 이미 많은 암모니아가 뇌로 흡수되어 혈청 농도가 비교적 낮게 보이기 때문이라고 추정된다.[4][8] 간성 뇌증과 관련된 다른 노폐물에는 짧은사슬지방산, 페놀, 싸이올기를 포함하고 있는 머캅탄 등이 있다.[8]
간성 뇌증 환자에서 여러 다른 이상들이 보고되었으나, 이들이 뇌증의 상태에 기여하는 바는 불명확하다. 글루탐산염 수송체 유전자 (특히 EAAT2)의 소실은 급성 간부전에 기인한다.[14] 벤조디아제핀 유사 물질 농도 증가는 GABA 신경전달 시스템의 이상과 함께 나타난다. 방향족 아미노산(페닐알라닌, 트립토판, 타이로신)과 가지사슬 아미노산(류신, 아이소류신, 발린) 간의 불균형에 관해서도 기술되었는데, 이로 인해 거짓신경전달물질(옥토파민, 2-하이드록시페네틸아민)이 만들어질 수 있다. 또한 세로토닌 시스템의 조절 이상도 보고되었다. 아연 결핍과 망가니즈 축적도 간성 뇌증 발생에 기여할 수 있다.[4][8] 몸의 어느 곳에서든 염증이 생기면 별아교세포에 사이토카인과 세균의 지질다당류가 작용하면서 뇌증을 촉발할 수 있다.[9]
진단[편집]
검사[편집]
간성 뇌증은 다른 뇌증과 그 증상이 유사하기 때문에, 진단을 위해서는 간질환 확진 판정을 받았거나(A형이나 C형 간성 뇌증의 경우) 문맥전신지름술을 받은 상태(B형 간성 뇌증)이어야 한다. 감별을 위해서 간질환을 시사하는 간기능검사의 비정상 수치나 초음파 소견을 보여야 하며, 이상적으로는 간 생검으로 확인한다.[4][8] 간성 뇌증의 증상은 뇌출혈이나 발작(둘 모두 만성 간질환에서 더 흔함)에서도 나타날 수 있다. 뇌 CT 스캔은 뇌출혈을 배제하기 위해 필요할 수 있으며, 발작이 의심되는 경우에는 뇌전도(EEG) 검사를 시행하기도 한다.[4] 뇌증의 증상과 유사한 증상을 보이는 보다 드문 경우는 수막염, 뇌염, 베르니케 뇌증, 윌슨병이 있으며 이들은 임상적 근거를 통해 의심한 후 추가적인 검사를 통해 확진해야 한다.[8][15]
간성 뇌증의 진단은 임상적으로 이루어진다. 즉, 다른 혼란이나 혼수의 원인을 배제하여 진단하며 간성 뇌증을 확진하거나 완전히 배제할 수 있는 검사는 없다. 혈청 암모니아 농도는 간성 뇌증 환자의 90%에서 증가하지만, 모든 고암모니아혈증이 뇌증과 관련이 있는 것은 아니다.[4][8] 뇌의 CT 스캔은 뇌부종이 나타나는 4기 간성 뇌증이 아니면 비정상 소견을 보이지 않는다.[8] MRI와 같은 다른 신경영상 기법은 현재 유용하다고 여겨지지는 않지만, 비정상 소견이 검사에서 보일 수도 있다.[15] 뇌전도 검사의 경우 0기에서는 아주 약한 뇌증이 있음에도 명확한 비정상 소견이 보이지 않지만, 1기, 2기, 3기의 경우 전두엽에 5Hz 주변에서 진동하는 3상파(triphasic wave)가 관찰된다. 또한 4기 간성 뇌증에서는 느린 델타파 활성이 나타난다.[4] 그러나 일반적으로 뇌전도 검사에서의 변화는 간성 뇌증과 다른 질환을 감별하는 데에 유용하지는 않다.[15]
뇌증 진단이 내려진 후에는 (위의 원인 문단에서 기술된 것들과 같은) 기저 원인을 배제하기 위한 시도가 계속 이어진다. 여기서는 혈액 검사(요소, 전해질, 일반 혈액 검사, 간기능검사), 흉부 X선, 소변검사 등이 필요하다. 복수가 있다면 자발성 세균성 복막염(SBP)을 확인하기 위해, 바늘로 복수 표본을 얻어 진단에 사용하는 복막천자가 필요할 수 있다.[4]
유형[편집]
간성 뇌증의 분류는 1998년 빈의 세계 위장관학회(world congress of gastroenterology)에서 처음 도입되었다. 이 분류에 따르면 간성 뇌증은 기저 원인에 따라 A형, B형, C형으로 세분화된다.[15]
- A형(급성)은 급성 간부전과 관련된 간성 뇌증으로 대개 뇌부종과 연관되어 있다.
- B형은 본래 관련된 간질환이 없이 문맥전신지름술로 인해 발병한 경우이다.
- C형은 간경변증 환자에서 발생한 간성 뇌증이다. C형은 다시 간헐성(episodic), 지속성(persistent), 최소증상(minimal) 뇌증으로 나누어진다.
최소증상 뇌증(minimal encephalopathy, MHE)은 임상적으로 명백한 인지 기능 장애로 이어지지는 않지만, 신경심리학적 검사를 통해 입증할 수 있는 뇌증으로 정의된다.[15][16] 최소증상 뇌증은 삶의 질을 떨어뜨리고 자동차 사고 관련 위험을 높인다는 것이 밝혀져 있으므로 여전히 중요한 소견으로 여겨진다.[17]
최소증상 간성 뇌증[편집]
최소증상 간성 뇌증은 그 정의상 진단하기 위해서는 신경심리검사가 필요하다. 오래 전 사용했던 검사법에는 무작위로 배열된 1 ~ 20까지의 숫자를 순서대로 연결하는 속도를 재는 '숫자 연결 검사'(numbers connecting test), '블록 디자인 검사'(block design test), 숫자 기호 대체 검사 등이 있다.[15] 2009년 전문가 위원회에서는 인지 기능의 여러 영역을 측정하는 신경심리검사 배터리 (neuropsychological test batteries)가 단일 검사보다 더 신뢰할 만하며, 기능적 상태와 더 강하게 상관관계를 가진다고 결론을 내렸다. 신경심리학적 상태 평가를 위한 반복배터리(RBANS)[18]나 PSE 증후군 검사(PSE-Syndrome-Test)[19] 둘 모두 이러한 목적으로 사용될 수 있다.[16] 독일에서 개발되어 여러 다른 유럽 국가들에서 승인된 PSE-증후군-검사는 숫자 연결 검사와 같은 다른 구식 평가 도구들을 통합하였다.[15][16][17][19]
치료[편집]
3기와 4기의 중증 뇌증 환자는 구역반사와 같은 기도를 보호하는 반사가 줄어들면서 기도가 막힐 위험이 있으며, 이로 인해 호흡정지로 이어질 수 있다. 이때는 환자를 중환자실과 같은 더 고강도의 의료 시설로 옮겨야 하며 흡인이나 호흡정지 같은 생명을 위협하는 합병증을 예방하기 위해 기관내삽관을 시행해야 할 수도 있다.[8][20] 비위관을 삽입해 영양소와 약물을 안전하게 투여할 수 있다.[4]
추정되는 기저 원인(A형, B형, C형)의 유무와 종류에 따라 간성 뇌증의 치료가 달라진다. 뇌증이 급성 간부전으로 인해 발생한 A형이라면, 1기와 2기의 경증이라 할지라도 간 이식이 필요할 수 있으며, 전문 센터로 환자를 이송하는 것이 권장된다.[20] B형 간성 뇌증은 TIPS 시술을 받은 환자에서 발생할 수 있으며 대부분의 경우에서는 자발적으로 낫거나 아래에 기술된 치료들로 해결할 수 있으나, 5% 정도의 적은 환자에서는 증상을 낫게 하기 위해 TIPS를 폐쇄해야 한다.[9]
C형 간성 뇌증의 경우 근본적인 원인을 찾아내고 치료하는 것이 초기 치료의 근간이 된다.[4][8][9][17] 감염을 근본적인 원인으로 가정하고 항생제를 경험적으로, 즉 실제 감염의 원인균을 모르는 상태에서 투여하기도 한다.[4][9] 뇌증의 경력이 효율적으로 치료된다면 간 이식을 준비할지 여부를 결정해야 한다.[17]
식사[편집]
과거에는 단백질을 정상 수준으로 먹는 것조차 간성 뇌증의 위험을 증가시킨다는 견해가 있었으나, 지금은 틀렸다고 여겨진다. 다수의 만성 간질환 환자는 영양부족 상태이며 안정적으로 체중을 유지하기 위해서는 충분한 단백질 섭취가 필요하다. 따라서 충분한 단백질과 열량을 포함한 식사가 권장된다.[4][9]
가지사슬 아미노산의 보충은 뇌증이나 다른 간경변증의 합병증을 개선하는 것으로 나타났다.[4][9]
몇몇 연구에서는 프로바이오틱(건강한 세균)을 복용하는 것이 도움이 된다고 밝혔다.[9]
락툴로오즈/락티톨[편집]
락툴로오즈와 락티톨은 소화계에서 흡수되지 않는 이당류이다. 이들은 암모니아를 암모늄 이온(NH4+)으로 변환시켜 암모니아가 흡수되지 못하게 하여 세균의 암모니아 생산을 줄이고, 장을 통한 장 내용물의 이동을 증가시킨다. 보통 하루 3번 15 ~ 30mL를 투여하는데, 치료 목표는 하루에 3 ~ 5번 부드러운 변을 보거나, 대변의 pH를 6.0보다 낮게 만드는 것으로 잡기도 한다.[4][8][9][17] 특히 뇌증이 심각하다면 락툴로오즈를 관장으로 투여하기도 한다.[17] 인산 나트륨 관장은 더 흔하게 이용되는데, 이를 통해 뇌증의 한 원인인 변비를 완화시키고 장 통과를 증가시킬 수 있다.[4]
락툴로오즈와 락티톨은 간성 뇌증을 치료하는 데에 도움이 되며 1차 치료제로 권장된다.[4][21] 락툴로오즈는 간성 뇌증 환자를 치료하는 데에 락티톨보다 효율적이지는 않은 것으로 보인다.[21] 락툴로오즈와 락티톨의 부작용은 설사, 복부팽만, 방귀, 구역질 등이 있다.[21] 급성 간부전의 경우 락툴로오즈가 도움이 되는지 불명확하다. 복부팽만은 간 이식 수술을 방해하기도 한다.[20]
항생제[편집]
재발성 간성 뇌증 환자에게 항생제인 리팍시민을 락툴로오즈에 추가하여 사용하는 것을 권장하기도 한다.[1] 리팍시민은 리파마이신 계열에 속하며 흡수되지 않는 항생제이다. 네오마이신이나 메트로니다졸 등 다른 항생제와 비슷한 방식으로 작용한다고 생각되지만, 이들이 가진 합병증은 나타내지 않는다. 락툴로오즈가 값이 싸고 오랜 시간 동안 사용되어 왔기 때문에, 락툴로오즈가 효과적이지 않거나 환자가 잘 버티지 못하는 경우에만 리팍시민을 2차 치료제로 사용한다. 리팍시민을 락툴로오즈에 추가하여 사용하면 두 약제를 따로 사용할 때보다 더 효과적일 수 있다.[4] 리팍시민은 락툴로오즈보다 비싸지만, 뇌증으로 인한 입원 횟수가 적어지면서 결과적으로는 비용이 비슷해질 수 있다.[17]
네오마이신과 메트로니다졸은 간성 뇌증 치료에 이용되는 다른 항생제들이다.[22] 이런 항생제들이 사용되는 근거는 장내 세균이 암모니아와 다른 노폐물을 만들고 변환하므로, 이 세균들을 죽여서 노폐물 생성을 줄일 수 있다는 것이다. 네오마이신과 다른 아미노글리코사이드 항생제는 주사로 투여할 시 청각장애나 신부전의 원인이 되기도 하는데, 네오마이신은 장에서 적게 흡수되므로 치료에 이용할 수 있다. 이후 연구들에서 네오마이신을 경구 투여하여도 합병증이 유발될 수 있다는 것이 알려졌다. 비슷하게 메트로니다졸도 비교적 적게 사용되는데, 장기간 사용 시 신경 손상과 위장관계 부작용을 유발할 수 있기 때문이다.[4]
L-오르니틴과 L-아스파르트산[편집]
L-오르니틴과 L-아스파르트산의 조합(LOLA)은 혈중 암모니아 농도를 낮춘다.[23] 임상 연구에서 나온 매우 약한 수준의 근거는 LOLA 치료가 간성 뇌증 환자 치료에 도움이 될 수 있다고 시사한다.[23] LOLA는 암모니아를 중성 물질인 요소로 바꾸는 대사경로인 요소 회로를 통해 요소 생성을 늘리고, 따라서 암모니아 농도를 감소시킨다.[24] 락툴로오즈나 리팍시민이 증상 조절에 효과적이지 못하다면 LOLA를 조합하여 함께 투여할 수도 있다.[4]
역학과 예후[편집]
간경변증 환자에서 간성 뇌증이 발병할 위험은 연간 20%로, 전체 간경변증 환자의 30 ~ 45%가 어느 시점에는 명백한 뇌증의 근거를 보인다. 공식적인 신경심리검사에서 발견 가능한 최소증상 간성 뇌증의 유병률은 60 ~ 80%로, 이들은 후에 명백한 뇌증으로 발전할 가능성이 올라간다.[17] 간성 뇌증이 한번 발병하면 예후는 간에서 생산되는 단백질인 알부민 수치, 혈액응고 검사로서 간에서 생산되는 단백질에 의존하는 프로트롬빈 시간(PT), 복수 유무, 간에서 접합되고 배설되는 헤모글로빈이 파괴되어 만들어지는 산물인 빌리루빈 수치 등을 통해 판정한다. 뇌증의 중증도와 이러한 수치들은 차일드-푸 점수에 반영되어 있다. 차일드-푸 점수를 통해 1년이나 2년 생존율을 예상할 수 있고, 간 이식 여부 결정에도 도움을 받을 수 있다.[15]
급성 간부전에서 중증 뇌증이 발생하면 단기간에 사망에 이를 수 있으며, 예후를 예측하는 데에 있어서 간부전의 기저 원인만큼이나 중요하다. 역사적으로 간 이식 제공에 널리 사용되어 온 기준인 킹스 칼리지 기준과 같은 척도는 현재는 그 사용이 제한적이며, 최근의 가이드라인들은 이러한 척도들에 과도하게 의존하는 것을 추천하지 않는다. 선천적으로 구리가 축적되는 질환인 윌슨병 환자나 독버섯에 중독된 환자에서의 간성 뇌증 발생은 응급 간 이식의 적응증이다.[20]
역사[편집]
황달이 있는 사람이 정신적 장애가 있는 듯한 행동을 보인 기록은 히포크라테스(c. 460 ~ 370 BCE) 시대까지 거슬러 올라간다.[19][25] 켈수스(c. 25 BC ~ c. 50 AD)와 갈레노스(129 ~ c. 216)는 간성 뇌증이라는 질환을 인식하고 있었다. 간질환과 신경정신적 증상 간의 관련성에 대한 많은 현대적 설명은 18세기와 19세기에 이루어졌다. 예를 들어 조반니 바티스타 모르가니(1682 ~ 1771)는 1761년 간성 뇌증이 진행성 질환이라고 기록하였다.[25]
1950년대에는 여러 보고서에서 이전에 보고된 수많은 이상을 열거했으며, 대사 장애와 문맥전신단락이 간성 뇌증의 기본 기전이며 질소가 풍부한 화합물이 장에서 유래한다는 이전에 발표된 이론을 확인했다.[19][26] 셰일라 셜록(1918 ~ 2001) 등은 런던의 왕립의과대학원과 로열 프리 병원에서 이러한 주제의 많은 연구를 수행했다. 이들은 간성 뇌증 환자에서의 단백질 제한[25]과 네오마이신 투여[27]에 대해서도 연구하였다.
해럴드 콘(Harold Conn, 1925 ~ 2011)과 그의 예일 대학교 동료들은 락툴로오즈의 치료 효능에 관하여 조사하던 도중 웨스트헤이븐 분류를 만들어 냈다.[15][28][29]
참고 문헌[편집]
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 Wijdicks, EF (2016년 10월 27일). “Hepatic Encephalopathy.”. 《The New England Journal of Medicine》 375 (17): 1660–1670. doi:10.1056/NEJMra1600561. PMID 27783916.
- ↑ 가 나 다 라 마 바 사 아 “Hepatic encephalopathy”. 《GARD》 (영어). 2016. 2017년 7월 5일에 원본 문서에서 보존된 문서. 2017년 7월 30일에 확인함.
- ↑ “Hepatic encephalopathy”. Clevelandclinic. 2022년 6월 9일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 더 러 머 버 서 어 저 처 커 터 퍼 허 Cash WJ, McConville P, McDermott E, McCormick PA, Callender ME, McDougall NI (January 2010). “Current concepts in the assessment and treatment of hepatic encephalopathy”. 《QJM》 103 (1): 9–16. doi:10.1093/qjmed/hcp152. PMID 19903725.
- ↑ 가 나 Starr, SP; Raines, D (2011년 12월 15일). “Cirrhosis: diagnosis, management, and prevention.”. 《American Family Physician》 84 (12): 1353–9. PMID 22230269.
- ↑ 가 나 다 “Portosystemic Encephalopathy - Hepatic and Biliary Disorders”. 《Merck Manuals Professional Edition》 (캐나다 영어). 2019년 9월 25일에 확인함.
- ↑ 가 나 Ferri, Fred F. (2017). 《Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1》 (영어). Elsevier Health Sciences. 577쪽. ISBN 9780323529570. 2017년 7월 30일에 원본 문서에서 보존된 문서.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 Chung RT, Podolsky DK (2005). 〈Cirrhosis and its complications〉. Kasper DL, Braunwald E, Fauci AS, 외. 《Harrison's Principles of Internal Medicine》 16판. New York, NY: McGraw-Hill. 1858–69쪽. ISBN 978-0-07-139140-5.
- ↑ 가 나 다 라 마 바 사 아 자 차 Sundaram V, Shaikh OS (July 2009). “Hepatic encephalopathy: pathophysiology and emerging therapies”. 《Med. Clin. North Am.》 93 (4): 819–36, vii. doi:10.1016/j.mcna.2009.03.009. PMID 19577116.
- ↑ Khan S, Tudur Smith C, Williamson P, Sutton R (2006). “Portosystemic shunts versus endoscopic therapy for variceal rebleeding in patients with cirrhosis”. 《Cochrane Database Syst Rev》 (4): CD000553. doi:10.1002/14651858.CD000553.pub2. PMC 7045742. PMID 17054131.
- ↑ Saab S, Nieto JM, Lewis SK, Runyon BA (2006). “TIPS versus paracentesis for cirrhotic patients with refractory ascites”. 《Cochrane Database Syst Rev》 2010 (4): CD004889. doi:10.1002/14651858.CD004889.pub2. PMC 8855742. PMID 17054221.
- ↑ “목정맥경유간속문맥전신순환지름술”. 《서울아산병원》. 2022년 9월 17일에 확인함.
- ↑ Ryan JM, Shawcross DL (2011). “Hepatic encephalopathy”. 《Medicine》 39 (10): 617–620. doi:10.1016/j.mpmed.2011.07.008.
- ↑ Thumburu, KK; Dhiman, RK; Vasishta, RK; Chakraborti, A; Butterworth, RF; Beauchesne, E; Desjardins, P; Goyal, S; Sharma, N; Duseja, A; Chawla, Y (Mar 2014). “Expression of astrocytic genes coding for proteins implicated in neural excitation and brain edema is altered after acute liver failure.”. 《Journal of Neurochemistry》 128 (5): 617–27. doi:10.1111/jnc.12511. PMID 24164438. S2CID 21367707.
- ↑ 가 나 다 라 마 바 사 아 자 Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei A (2002). “Hepatic encephalopathy--definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998”. 《Hepatology》 35 (3): 716–21. doi:10.1053/jhep.2002.31250. PMID 11870389. S2CID 7929620. 전체 텍스트 PDF
- ↑ 가 나 다 Randolph C, Hilsabeck R, Kato A, 외. (May 2009). “Neuropsychological assessment of hepatic encephalopathy: ISHEN practice guidelines”. 《Liver Int.》 29 (5): 629–35. doi:10.1111/j.1478-3231.2009.02009.x. PMID 19302444. S2CID 30313260.
- ↑ 가 나 다 라 마 바 사 아 Bajaj JS (March 2010). “Review article: the modern management of hepatic encephalopathy”. 《Aliment. Pharmacol. Ther.》 31 (5): 537–47. doi:10.1111/j.1365-2036.2009.04211.x. PMID 20002027. S2CID 10976362.
- ↑ Randolph C, Tierney MC, Mohr E, Chase TN (June 1998). “The Repeatable Battery for the Assessment of Neuropsychological Status (RBANS): preliminary clinical validity”. 《J Clin Exp Neuropsychol》 20 (3): 310–9. doi:10.1076/jcen.20.3.310.823. PMID 9845158.
- ↑ 가 나 다 라 Weissenborn K, Ennen JC, Schomerus H, Rückert N, Hecker H (May 2001). “Neuropsychological characterization of hepatic encephalopathy”. 《J. Hepatol.》 34 (5): 768–73. doi:10.1016/S0168-8278(01)00026-5. PMID 11434627.
- ↑ 가 나 다 라 Polson J, Lee WM (May 2005). “AASLD position paper: the management of acute liver failure”. 《Hepatology》 41 (5): 1179–97. doi:10.1002/hep.20703. PMID 15841455. S2CID 6216605. 2012년 12월 16일에 원본 문서에서 보존된 문서.
- ↑ 가 나 다 Gluud, Lise Lotte; Vilstrup, Hendrik; Morgan, Marsha Y. (2016년 5월 6일). “Non-absorbable disaccharides versus placebo/no intervention and lactulose versus lactitol for the prevention and treatment of hepatic encephalopathy in people with cirrhosis”. 《The Cochrane Database of Systematic Reviews》 2016 (5): CD003044. doi:10.1002/14651858.CD003044.pub4. ISSN 1469-493X. PMC 7004252. PMID 27153247.
- ↑ Ferenci, P (May 2017). “Hepatic encephalopathy.”. 《Gastroenterology Report》 5 (2): 138–147. doi:10.1093/gastro/gox013. PMC 5421503. PMID 28533911.
- ↑ 가 나 Goh, Ee Teng; Stokes, Caroline S.; Sidhu, Sandeep S.; Vilstrup, Hendrik; Gluud, Lise Lotte; Morgan, Marsha Y. (2018년 5월 15일). “L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis” (PDF). 《The Cochrane Database of Systematic Reviews》 5 (6): CD012410. doi:10.1002/14651858.CD012410.pub2. ISSN 1469-493X. PMC 6494563. PMID 29762873.
- ↑ Kircheiscorresponding, G; Lüth, S (2019). “Pharmacokinetic and Pharmacodynamic Properties of l-Ornithine l-Aspartate (LOLA) in Hepatic Encephalopathy”. 《Drugs》 79 (1): 23–29. doi:10.1007/s40265-018-1023-2. PMC 6416235. PMID 30706424.
- ↑ 가 나 다 Summerskill WH, Davidson EA, Sherlock S, Steiner RE (April 1956). “The neuropsychiatric syndrome associated with hepatic cirrhosis and an extensive portal collateral circulation”. 《Q. J. Med.》 25 (98): 245–66. PMID 13323252.
- ↑ Sherlock S, Summerskill WH, White LP, Phear EA (September 1954). “Portal-systemic encephalopathy; neurological complications of liver disease”. 《Lancet》 264 (6836): 453–7. doi:10.1016/S0140-6736(54)91874-7. PMID 13193045.
- ↑ Last PM, Sherlock S (February 1960). “Systemic absorption of orally administered neomycin in liver disease”. 《N. Engl. J. Med.》 262 (8): 385–9. doi:10.1056/NEJM196002252620803. PMID 14414396.
- ↑ Conn HO, Leevy CM, Vlahcevic ZR, 외. (1977). “Comparison of lactulose and neomycin in the treatment of chronic portal-systemic encephalopathy. A double blind controlled trial”. 《Gastroenterology》 72 (4 Pt 1): 573–83. doi:10.1016/S0016-5085(77)80135-2. PMID 14049.
- ↑ Boyer JL, Garcia-Tsao G, Groszmann RJ (February 2012). “In Memoriam: Harold O. Conn, M.D.”. 《Hepatology》 55 (2): 658–9. doi:10.1002/hep.25550. S2CID 85090164.
