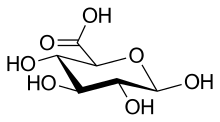
글루쿠론산
| |
| |
| 이름 | |
|---|---|
| IUPAC 이름
(2S,3S,4S,5R,6R)-3,4,5,6-tetrahydroxyoxane-2-carboxylic acid
| |
| 별칭
β-D-glucopyranuronic acid,
GlcA | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.026.807 |
| KEGG | |
| MeSH | Glucuronic+acid |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C6H10O7 | |
| 몰 질량 | 194.139 g·mol−1 |
| 녹는점 | 159–161 °C (318–322 °F; 432–434 K)[1] |
| 관련 화합물 | |
관련 우론산
|
알루론산, 알트루론산, 아라비누론산, 프럭투론산, 갈락투론산, 굴루론산, 이두론산, 릭수론산, 만누론산, 사이쿠론산, 리부론산, 리불루론산, 소르부론산, 타가투론산, 탈루론산, 자일루루론산, 자일루론산 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
글루쿠론산(영어: glucuronic acid)은 오줌에서 처음으로 분리된(고대 그리스어로 "sweet(단 것)"을 의미하는 "γλυκύς"와 "urine(소변)"을 의미하는 "οὖρον"에서 유래, 따라서 이름이 글루쿠론산이 됨) 우론산이다. 글루쿠론산은 아라비아검(약 18%), 잔탄검, 콤부차 차와 같은 많은 검에서 발견되며, 미생물, 식물, 동물의 대사에 중요하다.
특성[편집]

글루쿠론산은 글루코스로부터 유도된 당산으로 여섯 번째 탄소 원자가 카복실산으로 산화되었다. 생명체에서 이러한 1차 산화는 유리당이 아닌 UDP-α-D-글루코스에서 일어난다.
글루쿠론산은 전구체인 글루코스와 마찬가지로 선형(카복소-) 알도헥소스(<1%) 또는 고리형 헤미아세탈(푸라노스 또는 피라노스)로 존재할 수 있다. D-글루코스와 같은 알도헥소스는 두 가지 푸라노스 형태(α 및 β)와 두 가지 피라노스(α 및 β)를 형성할 수 있다. 피셔 투영식에 따라 글루쿠론산은 C-5에서의 입체배치에 따라 D- 및 L-글루쿠론산의 두 가지 입체 이성질체(거울상 이성질체)를 갖는다. 생리적으로 활성인 당은 대부분 D-입체배치를 갖는다. 고리 구조로 인해 고리 형태의 당은 또 다른 비대칭 탄소 원자(C-1)를 가지게 되므로 아노머라 불리는 두 가지 입체 이성질체를 가지게 된다. C-1의 입체배치에 따라 글루쿠론산은 두 가지 아노머인 α형 및 β형을 갖는다. β-D-글루쿠론산에서 C-1 하이드록실기는 카복실기처럼 피라노스 고리의 같은 쪽에 위치한다. 유리 당산에서는 β형태가 우세(약 64%)한 반면, 생물체에서는 α형태의 UDP-α-D-글루쿠론산이 우세하다.
하나의 다른 비대칭 탄소 원자에서만 입체배치가 다른 탄수화물의 입체 이성질체를 에피머라고 한다. 예를 들어 D-만누론산(C-2), D-알루론산(C-3), D-갈락투론산(C-4) 및 L-이두론산(C-5)은 글루쿠론산의 에피머들이다.
비평면 피라노스 고리는 의자형 입체배치(2가지 변형) 또는 보트형 입체배치를 가정할 수 있다. 선호하는 입체배치는 공간적인 간섭 또는 치환기의 다른 상호작용에 따라 달라진다. D-글루코스의 피라노스 형태와 그 유도체인 D-글루쿠론산은 의자형인 4C1을 선호한다.
C-1에서 카복실기 수준으로의 추가적으로 산화되면 다이카복실산인 글루카르산을 생성하게 된다. 글루쿠로노락톤은 글루쿠론산의 자가 에스터(락톤)이다.
알도스의 직접적인 산화는 먼저 알데하이드기에 영향을 미친다. 알도스로부터 우론산의 실험실에서의 합성은 예를 들어 고리형 아세탈(예: 아세토나이드)로의 전환에 의해 산화로부터 알데하이드 및 하이드록실기를 보호해야 한다.
글루쿠론산 나트륨은 녹말을 진한 질산으로 직접 산화시켜 생성할 수 있다. 이러한 제조 과정에서 물의 낮은 가용성은 이산화 질소가 녹말을 산화시키는 것과 거의 같은 방식으로 녹말 중합체가 가수분해되는 것을 막고 유리 하이드록실기만을 산화시킨다. 이 반응이 완료되고 녹말/질산 혼합물이 투명해지면(이산화 질소 가스가 방출된 후) 용액을 희석하고 다른 무기산으로 가수분해할 수 있다. 그런 다음 산화는 수산화 나트륨(또는 중탄산 나트륨)으로 천천히 처리되어 용액에서 결정화될 수 있는 글루쿠론산 나트륨을 형성한다. 전이 금속과 함께 글루쿠론산 철(III), 글루쿠론산 철(II), 글루쿠론산 구리(II)와 같은 착물을 형성한다.
기능[편집]
프로테오글리칸[편집]
글루쿠론산은 프로테오글리칸과 글리코글리세로지질의 일반적인 단위체이다.
- 헤파린은 혈액 응고 저해제이며, 비만 세포, 폐 및 간에서 생성된다.
- 콘드로이틴 황산은 연골, 대동맥, 결합 조직, 뼈 및 피부에서 다량으로 발견된다.
- 데르마탄 황산은 피부, 심장 및 혈관에 있는 프로테오글리칸이다.
- 케라탄 황산은 각막, 연골 및 뼈에서 발견된다.
- 히알루론산은 결합 조직, 피부, 연골 및 활액에서 다량으로 생성된다.
- 글루쿠론산 또는 갈락투론산의 글리코글리세로지질은 세균의 세포벽을 형성한다.
글루쿠론산화[편집]

UDP-α-D-글루쿠론산은 종종 친유성 이종 및 엔도바이오틱스의 2상 대사(접합)에 관여한다. 이러한 연결은 싸이올, 아민 및 하이드록실기와의 글리코사이드 결합 또는 카복실기 및 하이드록실기와의 에스터화를 포함한다. 이러한 연결 과정을 글루쿠론산화(또한 글루쿠로나이드 컨주게이션)이라고 한다. 글루쿠론산화는 주로 간에서 일어나지만, 그 촉매 작용은 담당하는 효소인 UDP-글루쿠로닐트랜스퍼레이스는 장, 콩팥, 뇌, 부신, 지라, 가슴샘과 같은 신체의 주요 기관에서 발견된다.[2][3] 다른 UDP-우론산(예: 갈락투론산)에서도 유사한 반응이 일어난다.
글루쿠론산화로 인한 글리코사이드는 β-D-글루쿠로나이드라고 하고, 그 염과 에스터를 글루쿠로네이트라고 한다. 인체는 글루코론산화를 사용하여 알코올, 페놀, 카복실산, 머캅탄, 1차 및 2차 지방족 아민 및 카밤산염을 보다 더 수용성으로 만들고, 이러한 방식으로 소변이나 대변을 통해(간에서 쓸개즙을 통해) 상당히 증가된 속도로 체내로부터 후속적으로 제거될 수 있다. 카복실기는 생리학적 pH에서 이온화되어 컨주게이트된 화합물을 수용성으로 만든다. 분자량이 60,000 이상인 화합물은 콩팥으로 배설되기에는 너무 커서 쓸개즙과 함께 장으로 배설된다. 신생아는 이 컨주게이트 시스템이 결핍되어 있어서 클로람페니콜과 같은 약물에 특히 취약하다. 클로람페니콜에 글루쿠론산을 첨가하면 비활성화되어 회색 아기 증후군을 유발한다. 빌리루빈은 빌리루빈 다이글루쿠로나이드(80%), 빌리루빈 글루쿠로나이드(20%) 및 비공액 빌리루빈(1% 미만)의 형태로 쓸개즙으로 배설된다. 크리글러-나자르 증후군과 질베르 증후군에서는 돌연변이로 인해 UDP-글루쿠로닐트랜스퍼레이스의 활성이 감소하거나 거의 없어서 황달이 일어난다.
대사와 배설을 주로 또는 전적으로 글루쿠론산화에 의존하는 여러 약물/물질들과 결합하여 신체의 글루쿠론산의 공급을 고갈시킬 수 있다. 대부분의 그러한 물질들은 글루쿠론산의 고갈 후에 두드러지게 되는 2차 대사 경로를 가지고 있지만, 대사 속도는 시스템에서 모든 글루쿠론산 기질의 현저한 축적을 야기할 만큼 충분히 감소하게 된다. 이것은 종종 의학적으로 적절한 양만큼 혈액 내 약물 농도를 증가시킨다. 심한 경우에는 영구적이고 쇠약하게 만드는 장기 손상(특히 간, 콩팥, 심장 및 뇌)과 심지어 사망할 수 있는 것으로 알려져 있다. 에탄올, 모르핀, 파라세타몰(아세트아미노펜), 사이클로옥시제네이스 저해제(NSAID), 내인성 스테로이드 및 특정 벤조디아제핀은 모두 글루쿠론산의 고갈에 기여할 수 있으며, 에탄올과 아세트아미노펜은 글루쿠론산 고갈에 긍정적으로 기여하는 우발적인 과다 복용의 경우에 가장 일반적으로 연루되는 물질이다.
과도한 양의 글루쿠론산은 또한 건강, 담배 연기, 대부분의 바르비투르산염에 해로울 수 있으며, 일부 카밤산염은 실제로 글루쿠론산의 생산을 자극하는 것으로 알려져 있다. 증가된 글루쿠론산 활성은 글루쿠론산 기질의 농도 및 대사 반감기를 감소시켜 글루쿠론산화된 약물의 혈장 수준을 치료 역치 아래로 떨어지게 한다. 기질의 과도한 글루쿠론산화는영향을 받는 약물의 전통적인 용량에 대한 부적절한 반응을 초래할 수 있으며, 약물이 매우 광범위한 치료 지수를 갖지 않는 한, 일반적으로 약물 요법의 급성 실패를 초래하고 하나 이상의 관련 약물을 글루쿠론산이 첨가되지 않는 동등한 요법으로 전환해야 한다. 선택된 수의 항우울제와 광범위한 항정신병제가 글루쿠론산화 리간드이지만 지연된 작용 기전과 약동학적 특성으로 인해 혈장 농도의 감소가 즉각적으로 나타나지 않을 수 있으며 약물 치료를 시작하기 전에 환자가 보이는 행동과 사고 패턴으로 점전적으로 퇴행하는 대신 갑작스럽고 강렬한 재발로 나타나는 경향이 있다.
글루쿠로나이드는 장내 미생물총에 존재하는 베타-글루쿠로니데이스에 의해 각각 아글리콘으로 가수분해될 수 있으며, 이는 장에서 재흡수되어 혈액을 통해 간으로 다시 이동할 수 있다. 이러한 회로를 장간순환이라고 한다. 장간순환을 겪는 화합물은 천천히 배설될 뿐이며 일반적으로 체내에서 더 긴 반감기를 갖는다.
특정 글루쿠로나이드는 친전자성이며 중독 과정에서 기능할 수 있다. 여러 카복실산(에스터) 글루쿠로나이드의 아글리콘 부분의 공유 결합은 예를 들어 트랜스아실화 반응을 통해 혈청 알부민의 친핵성 부위에 일어나는 것으로 알려져 있다.[4]
방향족 탄화수소의 정량적으로 중요한 P450-유래 대사산물인 페놀은 UDP-글루쿠로닐트랜스퍼레이스와 황산기전이효소의 기질이다. 황산염 형성은 고친화도, 저용량 시스템(황산염 고갈로 인한)인 반면 글루쿠론산화는 저친화도, 고용량(고갈될 수 있음) 시스템이기 때문에 글루쿠로나이드는 포유동물에서 페놀 또는 페놀 전구체(벤젠)과 함께 우세하다.[4]
질병에서의 역할[편집]
글루쿠론산과 에탄올의 글루쿠론산화 대사산물인 에틸 글루쿠로나이드는 톨 유사 수용체 4에 작용하여 신체 내 내인성 염증 신호전달 분자의 생성 및 방출을 상향 조절함으로써 급성 및 만성 염증 상태를 악화시킬 뿐만 아니라 만성 통증 상태의 환자의 인지된 통증 정도를 증가시킨다. 톨 유사 수용체 4의 장기간의 작용(예: 글루쿠론산, 에틸 글루쿠로나이드 및 아편류에서 일어나는 작용)은 만성적으로 고통스러운 상태가 이전보다 훨씬 더 심각한 것으로 인식되는 반면, 기존의 견딜 수는 있지만 때때로 고통스러운 활동은 이전보다 더 고통스러울 수 있으며 더 짧고 육체적으로 덜 요구되는 활동에 의해 악화되기 시작한다. 또한 점차적으로 유해한(자극적인) 자극에 대해 똑같이 고통스러운 반응을 일으킬 수 있으며, 결국 대부분의 사람들에게 통증을 유발하지 않는 자극으로 인한 상당한 고통을 초래할 수 있다.[5]
용도[편집]
소변의 스테로이드 및 혈액 내 스테로이드 접합체를 측정하는 데 사용된다. 에틸 글루쿠로나이드 및 에틸 설페이트는 에탄올의 대사산물로 소변으로 배설되며 알코올의 사용 또는 의존을 모니터링하는 데 사용된다.
글루쿠론산은 아스코르브산(비타민 C, 이전에는 L-헥수론산으로 불림)의 전구체이다. 아스코르브산은 고등 식물, 조류, 효모 및 대부분의 동물에 의해 생합성될 수 있다. 염소는 하루에 약 13 g의 비타민 C를 생산한다. 이러한 능력은 일부 포유동물(사람과 기니피그 포함)과 곤충, 무척추동물 및 대부분의 물고기에서 부족하다. 이들 생물종은 생합성 효소인 L-굴로노락톤 산화효소가 결핍되어 있기 때문에 외부로부터 아스코르브산의 공급이 필요하다.[7]
글루쿠로나이드 4-메틸룸벨리페릴-β-D-글루쿠로나이드(MUG)는 대장균의 존재 유무를 테스트하는 데 사용된다. 대장균은 MUG 분자를 자외선 하에서 감지할 수 있는 형광 생성물로 가수분해하는 효소인 β-글루쿠로니데이스를 생성한다.
같이 보기[편집]
각주[편집]
- ↑ D-Glucuronic acid at Sigma-Aldrich
- ↑ Ohno, Shuji; Nakajin, Shizuo (2008년 10월 6일). “Determination of mRNA Expression of Human UDP-Glucuronosyltransferases and Application for Localization in Various Human Tissues by Real-Time Reverse Transcriptase-Polymerase Chain Reaction”. 《Drug Metabolism and Disposition》 (American Society for Pharmacology and Experimental Therapeutics) 37 (1): 32–40. doi:10.1124/dmd.108.023598. PMID 18838504. S2CID 5150289. 2010년 11월 7일에 확인함.
- ↑ Bock K, Köhle C (2005). “UDP-glucuronosyltransferase 1A6: structural, functional, and regulatory aspects”. 《Methods Enzymol.》. Methods in Enzymology 400: 57–75. doi:10.1016/S0076-6879(05)00004-2. ISBN 9780121828059. PMID 16399343.
- ↑ 가 나 Tanya C McCarthy; Christopher J Sinal (2005), 〈Biotransformation〉, 《Encyclopedia of Toxicology》 1 2판, Elsevier, 299–312쪽, ISBN 0-12-745354-7
- ↑ Lewis SS, Hutchinson MR, Zhang Y, Hund DK, Maier SF, Rice KC, Watkins LR (2013). “Glucuronic acid and the ethanol metabolite ethyl-glucuronide cause toll-like receptor 4 activation and enhanced pain.”. 《Brain, Behavior, and Immunity》 30: 24–32. doi:10.1016/j.bbi.2013.01.005. PMC 3641160. PMID 23348028.
- ↑ Blanc, P.J. (February 1996). “Characterization of the tea fungus metabolites”. 《Biotechnology Letters》 18 (2): 139–142. doi:10.1007/BF00128667. S2CID 34822312.
- ↑ Gerhard Michal; Dietmar Schomburg (2012), 《Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology》 2판, Wiley, 145a쪽, ISBN 978-0-470-14684-2
