프랑슘: 두 판 사이의 차이
편집 요약 없음 |
편집 요약 없음 |
||
| 1번째 줄: | 1번째 줄: | ||
{{원소 정보/프랑슘}} |
{{원소 정보/프랑슘}} |
||
[[파일:Pichblende.jpg|220px|섬네일|오른쪽|우라늄 광석의 모습.]] |
[[파일:Pichblende.jpg|220px|섬네일|오른쪽|우라늄 광석의 모습.]] |
||
'''프랑슘'''(francium)은 [[화학 원소]]로 핵반응으로 만드는 방사성 원소의 하나이다. 원소기호는 '''Fr'''이며, 원자번호는 87이다. 다른 말로 에카-세슘 또는 악티늄-K<ref>Actually the least unstable isotope, Fr-223</ref>로 부르기도 한다. [[알칼리 금속]]중에서 가장 무거운 원소이다. [[리튬]], [[나트륨]], [[칼륨]], [[루비듐]], [[세슘]]과 같은 다른 알칼리 금속처럼 프랑슘도 화합물에서 +1가 형태의 [[이온]] 형태를 띠고(Fr<sup>+</sup>), 화학적 성질은 세슘과 매우 비슷하다. 프랑슘의 가장 안정한 동위 원소의 반감기는 22분으로 매우 불안정하기 때문에, 아직 많은 양의 원소를 만들지는 못했다. |
'''프랑슘'''(francium)은 [[화학 원소]]로 핵반응으로 만드는 방사성 원소의 하나이다. 원소기호는 '''Fr'''이며, 원자번호는 87이다. 다른 말로 에카-세슘 또는 악티늄-K<ref>Actually the least unstable isotope, Fr-223</ref>로 부르기도 한다. [[알칼리 금속]]중에서 가장 무거운 원소이다. [[리튬]], [[나트륨]], [[칼륨]], [[루비듐]], [[세슘]]과 같은 다른 알칼리 금속처럼 프랑슘도 화합물에서 +1가 형태의 [[이온]] 형태를 띠고(Fr<sup>+</sup>), 화학적 성질은 세슘과 매우 비슷하다. 프랑슘의 가장 안정한 동위 원소의 반감기는 22분으로 매우 불안정하기 때문에, 아직 많은 양의 원소를 만들지는 못했다.<ref name="CRC2006">{{서적 인용|작성년도 =2006 |제목= CRC Handbook of Chemistry and Physics |volume = 4 |쪽수= 12 |출판사= CRC |id = 0-8493-0474-1 }}</ref> |
||
== 화학적 성질 == |
== 화학적 성질 == |
||
원자번호는 87, 원소기호는 Fr, 질량수는 223.019이다. 프랑슘의 녹는점은 300K, 끓는점은 950K이다. 세슘과 매우 비슷한 화학 성질을 가지기 때문에 모든 성질이 다 세슘과 비교해서 조금밖에 차이가 안 난다. 일부 과학자들은 프랑슘의 끓는점을 935K으로 보는 경우도 있다. 전기 음성도는 0.7로, 세슘이 0.79인 것에 비해 0.09정도 차이가 난다. 이온화 에너지는 1차 380kJ/mol, 2차 2200kJ/mol, 3차 3300kJ/mol(2차, 3차는 세슘에 의한 추정)이다. |
원자번호는 87, 원소기호는 Fr, 질량수는 223.019이다. 프랑슘의 녹는점은 300K, 끓는점은 950K이다. 세슘과 매우 비슷한 화학 성질을 가지기 때문에 모든 성질이 다 세슘과 비교해서 조금밖에 차이가 안 난다. 일부 과학자들은 프랑슘의 끓는점을 935K으로 보는 경우도 있다. 전기 음성도는 0.7로<ref>{{서적 인용| 이름= Pauling| 성= Linus| 제목= The Nature of the Chemical Bond (3rd Edn.)| 저자링크= Linus Pauling| 출판사= Cornell University Press| 작성년도= 1960| 쪽 = 93 }}</ref>, 세슘이 0.79인 것에 비해 0.09정도 차이가 난다. 이온화 에너지는 1차 380kJ/mol, 2차 2200kJ/mol, 3차 3300kJ/mol(2차, 3차는 세슘에 의한 추정)이다. 프랑슘은 붕괴하여 [[라돈]]으로 된다.<ref name="andyscouse">{{웹 인용| 이름= Price| 성= Andy| 제목= Francium| 작성일자= 2004-12-20| url = http://www.andyscouse.com/pages/francium.htm| 확인일자 = 2007-03-25 }}</ref> |
||
== 존재량 == |
== 존재량 == |
||
=== 천연 존재 === |
=== 천연 존재 === |
||
프랑슘은 안정적인 원소 악티늄-227의 알파 붕괴로 미량 생기는 방사성 원소이다. [[우라늄]] 광석에 약간 들어 있으며, 우라늄 광석 1개에 들어 있는 프랑슘의 원자 수는 1×10<sup>18</sup> 개의 우라늄 원자의 1개 정도이다. 지구상에 존재하는 모든 프랑슘의 양은 계산 결과 최대 30 g 정도이다. 이 프랑슘은 붕괴하여 [[아스타틴]]의 동위원소가 된다. |
프랑슘은 안정적인 원소 악티늄-227의 알파 붕괴로 미량 생기는 방사성 원소이다. <ref>{{웹 인용| 이름= Winter| 성= Mark| 제목= Electron Configuration| 내용= Francium| 출판사 = The University of Sheffield| url = http://www.webelements.com/webelements/elements/text/Fr/eneg.html| 확인일자= 2007-04-18 }}</ref> [[우라늄]] 광석에 약간 들어 있으며, 우라늄 광석 1개에 들어 있는 프랑슘의 원자 수는 1×10<sup>18</sup> 개의 우라늄 원자의 1개 정도이다. 지구상에 존재하는 모든 프랑슘의 양은 계산 결과 최대 30 g 정도이다. 이 프랑슘은 붕괴하여 [[아스타틴]]의 동위원소가 된다.<ref name="CRC2006" /> |
||
=== 인공 생성 === |
=== 인공 생성 === |
||
| 18번째 줄: | 18번째 줄: | ||
== 여러 가지 반응 == |
== 여러 가지 반응 == |
||
=== 공기와의 반응 === |
=== 공기와의 반응 === |
||
아직까지 프랑슘의 모양을 확실하게 알 수 있는 정도의 충분한 프랑슘을 한번에 제조한 경우는 없다. 아마도 프랑슘은 매우 연하고, 쉽게 자를 수 있는 금속 고체일 것이거나, 실온에서 액체일지도 모른다. 지금은 금속성을 띠고 있다고 생각된다. 깨끗한 프랑슘 표면은 공기로부터 산소와 습기와 반응하기 때문에 곧바로 변색될 것이다. 프랑슘이 공기 중에 연소된다면, 프란슘은 초산화 프랑슘 (FrO<sub>2</sub>)이 될 것으로 예상된다. |
아직까지 프랑슘의 모양을 확실하게 알 수 있는 정도의 충분한 프랑슘을 한번에 제조한 경우는 없다. 아마도 프랑슘은 매우 연하고, 쉽게 자를 수 있는 금속 고체일 것이거나, 실온에서 액체일지도 모른다.<ref>{{저널 인용| 이름= Kozhitov| 성= L. V.| 공저자= Kol'tsov, V. B.; Kol'tsov, A. V.| 제목= Evaluation of the Surface Tension of Liquid Francium| 저널= Inorganic Materials| volume = 39| issue = 11| 쪽수= 1138–1141| 출판사= Springer Science & Business Media B.V.| 작성일자= 2003-02-21| url = http://search.ebscohost.com/login.aspx?direct=true&db=aqh&AN=16822434&site=ehost-live| 확인일자= 2007-04-14| doi = 10.1023/A:1027389223381 }}</ref> 지금은 금속성을 띠고 있다고 생각된다. 깨끗한 프랑슘 표면은 공기로부터 산소와 습기와 반응하기 때문에 곧바로 변색될 것이다. 프랑슘이 공기 중에 연소된다면, 프란슘은 초산화 프랑슘 (FrO<sub>2</sub>)이 될 것으로 예상된다. |
||
=== 물,할로젠,산염기 반응 === |
=== 물,할로젠,산염기 반응 === |
||
| 36번째 줄: | 36번째 줄: | ||
가장 반감기가 짧은 프랑슘의 동위 원소는 프랑슘-215로, 반감기는 0.2[[마이크로|μ]][[초 (시간)|s]]도 채 안 되는 0.12 μs정도이다. 아스타틴-211로 알파 붕괴하며, 붕괴 에너지는 9.54 MeV정도이다. 가장 긴 [[핵 이성질체]] 동위원소는 프랑슘-215m이며, 가장 안정할 경우의 반감기는 3.5 [[나노|n]][[초 (시간)|s]] 정도이다. |
가장 반감기가 짧은 프랑슘의 동위 원소는 프랑슘-215로, 반감기는 0.2[[마이크로|μ]][[초 (시간)|s]]도 채 안 되는 0.12 μs정도이다. 아스타틴-211로 알파 붕괴하며, 붕괴 에너지는 9.54 MeV정도이다. 가장 긴 [[핵 이성질체]] 동위원소는 프랑슘-215m이며, 가장 안정할 경우의 반감기는 3.5 [[나노|n]][[초 (시간)|s]] 정도이다. |
||
== 외부 링크 == |
|||
*[http://www.webelements.com/webelements/elements/text/Fr/index.html WebElements.com - 프랑슘] |
|||
*[http://periodic.lanl.gov/elements/87.html 주기율표 - 프랑슘] |
|||
*[http://fr.physics.sunysb.edu/francium_news/frconten.htm 스토니 브룩 대학교 물리 보고서 - 프랑슘] |
|||
== 주석 == |
== 주석 == |
||
2009년 3월 9일 (월) 17:12 판
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Francium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 87 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | 1족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 7주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | s-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 알칼리 금속 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [Rn] 7s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
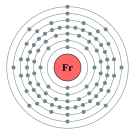
| 준위별 전자 수 | 2, 8, 18, 32, 18, 8, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 금속성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | ? 300 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | ? 950 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 1.87 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 2 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 65 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 1 (강염기성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 0.7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 260 pm (실험값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 판데르발스 반지름 | 348 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 15 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 3 µ Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-73-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

프랑슘(francium)은 화학 원소로 핵반응으로 만드는 방사성 원소의 하나이다. 원소기호는 Fr이며, 원자번호는 87이다. 다른 말로 에카-세슘 또는 악티늄-K[1]로 부르기도 한다. 알칼리 금속중에서 가장 무거운 원소이다. 리튬, 나트륨, 칼륨, 루비듐, 세슘과 같은 다른 알칼리 금속처럼 프랑슘도 화합물에서 +1가 형태의 이온 형태를 띠고(Fr+), 화학적 성질은 세슘과 매우 비슷하다. 프랑슘의 가장 안정한 동위 원소의 반감기는 22분으로 매우 불안정하기 때문에, 아직 많은 양의 원소를 만들지는 못했다.[2]
화학적 성질
원자번호는 87, 원소기호는 Fr, 질량수는 223.019이다. 프랑슘의 녹는점은 300K, 끓는점은 950K이다. 세슘과 매우 비슷한 화학 성질을 가지기 때문에 모든 성질이 다 세슘과 비교해서 조금밖에 차이가 안 난다. 일부 과학자들은 프랑슘의 끓는점을 935K으로 보는 경우도 있다. 전기 음성도는 0.7로[3], 세슘이 0.79인 것에 비해 0.09정도 차이가 난다. 이온화 에너지는 1차 380kJ/mol, 2차 2200kJ/mol, 3차 3300kJ/mol(2차, 3차는 세슘에 의한 추정)이다. 프랑슘은 붕괴하여 라돈으로 된다.[4]
존재량
천연 존재
프랑슘은 안정적인 원소 악티늄-227의 알파 붕괴로 미량 생기는 방사성 원소이다. [5] 우라늄 광석에 약간 들어 있으며, 우라늄 광석 1개에 들어 있는 프랑슘의 원자 수는 1×1018 개의 우라늄 원자의 1개 정도이다. 지구상에 존재하는 모든 프랑슘의 양은 계산 결과 최대 30 g 정도이다. 이 프랑슘은 붕괴하여 아스타틴의 동위원소가 된다.[2]
인공 생성
미국 캘리포니아 버클리 연구소에서 안정적인 금-197에다 불안정한 산소-16, 17, 18을 충돌시켜서 프랑슘-209, 프랑슘-210, 프랑슘-211을 만들었다. 각각 남은 중성자 수는 3개, 4개, 5개였다. 2009년 라듐에 양성자 1개, 중수소 1개, 헬륨 이온을 충돌시켜 생성하려고 하였으나 실패하였다.
역사
1939년 파리 퀴리 연구소에 프랑스인 마그리트 페레에 의해 발견되었으나 [6] , 그러나 프랑슘의 존재는 1870년대에 멘델레예프에 의해 예측되었다. 프랑슘의 성질들이 세슘의 성질들과 매우 유사했기 때문에, 멘델레예프는 프랑슘을 에카-세슘 (eka-cesium; "eka"는 주기율표의 동족란의 빈자리에 밝혀지지 않은 원소를 표현할 때에 사용하는 접두사)으로 명명했다. 마그리트 페레는 오늘날 223Fr 87으로서 알려진, 악티늄로부터의 붕괴 생성물로 알고 있었다. 이는 약 22 분의 반감기를 가진 악티늄의 가장 긴 수명을 가진 동위원소이다. 그녀는 그녀의 조국의 이름으로부터 새로운 원소를 프랑슘으로 명명했다.
여러 가지 반응
공기와의 반응
아직까지 프랑슘의 모양을 확실하게 알 수 있는 정도의 충분한 프랑슘을 한번에 제조한 경우는 없다. 아마도 프랑슘은 매우 연하고, 쉽게 자를 수 있는 금속 고체일 것이거나, 실온에서 액체일지도 모른다.[7] 지금은 금속성을 띠고 있다고 생각된다. 깨끗한 프랑슘 표면은 공기로부터 산소와 습기와 반응하기 때문에 곧바로 변색될 것이다. 프랑슘이 공기 중에 연소된다면, 프란슘은 초산화 프랑슘 (FrO2)이 될 것으로 예상된다.
물,할로젠,산염기 반응
프랑슘은 매우 희귀해서, 가격이 매우 비싸다. 어느 누구도 금속과 물과 반응시킨 바가 없다. 그러나 수산화물의 무색 용액과 수소 기체를 형성하는 1 족 원소의 특성상, 프랑슘과 물과의 반응 결과도 동일할 것이다. 반응은 아마도 세슘보다 위험할 정도로 빠를 것이다. 프랑슘 금속은 모든 할로젠(불소, 염소, 브롬, 요오드, 아스타틴)들과 격렬하게 반응하여 할로젠화 프랑슘을 형성할 것으로 예상할 수 있다. 다른 알칼리 금속들의 산 또는 염기와 반응과 동일할 것으로 추정된다.
산출
우라니나이트(피치블렌드)의 시료는 정류상태 붕괴 사슬로 인해 약간의 프랑슘을 포함한다. 임의 시간에 10-20 g의 프랑슘 (1×1018개의 우라늄 원자당 한 개의 원자)이 존재하는 것으로 추정된다. 프랑슘은 악티늄의 붕괴의 결과로서 발생한다. 프랑슘은 우라늄 광석들 내에서 발견되며, 토륨(Th)에 양성자들을 충돌시켜 인공적으로 제조할 수 있다. 프랑슘은 118 원소들 중에서 가장 불안정한 원소이다. 가장 긴 수명의 동위원소이며, 227Ac의 딸 핵인 223Fr의 반감기는 22 분이다. 이는 자연계 내에서 발생하는 프랑슘의 유일한 동위원소이나, 그러나 임의의 시간에 지구의 지각에 존재하는 원소는 많아야 20-30g 이다. 원소의 무게를 측정할 수 있는 양을 제조하거나 또는 분리되지는 않는다.
34 여종의 동위원소들이 알려져 있다. 프랑슘은 지구에서 매우 희귀하며, 단지 몇몇 우라늄 광석들 내에 매우 작은 미량으로서 발견된다. 프랑슘은 순수한 원소로서 결코 분리되지 않고 있다. 프랑슘이 방사능을 가지고 있기 때문에 형성된 어떠한 양도 다른 원소들로 분해될 것이다. 악티늄은 대부분 β-붕괴에 의해 붕괴되나, 약 1%의 붕괴는 α-붕괴한다. 악티늄-K로 불리는, 이 반응의 딸 원소는 오늘날 악티늄의 가장 긴 수명, 22 분의 반감기를 가진 동위원소인 223Fr 87로서 인식된다.
동위 원소
프랑슘의 동위 원소는 약 34여종이 알려져 있으며 질량은 199에서 232까지 다양하다. 프랑슘은 7개의 핵 이성질체 동위원소가 존재한다.[3] 프랑슘-223과 프랑슘-221 은 자연에서 유일하게 안정적으로 존재하는 원소이며, 나머지 동위원소들은 모두 인공적으로 만든 것이다.
프랑슘-223은 가장 안정적인 동위원소로서 반감기는 약 21.8분이며, 프랑슘의 동위 원소 중에서 가장 반감기가 길고 천연적으로 발견된 동위 원소이다. 프랑슘-223은 악티늄-227의 알파 붕괴 과정에서 생기는 원소로 악티늄-227의 딸핵이다. 프랑슘-223은 베타 붕괴하여 라듐-223으로 되며 붕괴에너지는 1149 keV 정도이고, 적은 비율(0.006%) 로는 알파 붕괴되어 아스타틴-219로 되고, 붕괴 에너지는 5.4 MeV정도이다.
프랑슘-221의 반감기는 4.8 분이다. 이 동위 원소는 악티늄-225가 알파 붕괴하여 생긴 것으로 악티늄-225의 딸핵이다. 프랑슘-221 역시 알파 붕괴하여 아스타틴-217로 되며, 붕괴 에너지는 6.457 MeV정도이다.
가장 반감기가 짧은 프랑슘의 동위 원소는 프랑슘-215로, 반감기는 0.2μs도 채 안 되는 0.12 μs정도이다. 아스타틴-211로 알파 붕괴하며, 붕괴 에너지는 9.54 MeV정도이다. 가장 긴 핵 이성질체 동위원소는 프랑슘-215m이며, 가장 안정할 경우의 반감기는 3.5 ns 정도이다.
외부 링크
주석
- ↑ Actually the least unstable isotope, Fr-223
- ↑ 가 나 《CRC Handbook of Chemistry and Physics》 4. CRC. 0-8493-0474-1.
- ↑ Linus, Pauling. 《The Nature of the Chemical Bond (3rd Edn.)》. Cornell University Press. 93쪽.
- ↑ Andy, Price. “Francium”. 2007년 3월 25일에 확인함.
- ↑ Mark, Winter. “Electron Configuration”. The University of Sheffield. 2007년 4월 18일에 확인함.
- ↑ Some synthetic elements, like technetium, have later been found in nature.
- ↑ L. V., Kozhitov; Kol'tsov, V. B.; Kol'tsov, A. V. “Evaluation of the Surface Tension of Liquid Francium”. 《Inorganic Materials》 (Springer Science & Business Media B.V.) 39 (11). doi:10.1023/A:1027389223381. 2007년 4월 14일에 확인함.
| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |