트라이오스 인산 이성질화효소
| 삼탄당 인산 이성질화효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
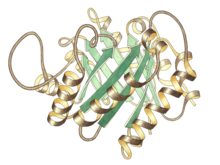 삼탄당 인산 이성질화효소 단량체의 측면도, 상단 중앙에 활성 부위가 있다 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 5.3.1.1 | ||||||||
| CAS 번호 | 9023-78-3 | ||||||||
| 데이터베이스 | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB 구조 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 유전자 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
삼탄당 인산 이성질화효소(영어: triose-phosphate isomerase, TPI) (EC 5.3.1.1)는 삼탄당 인산 이성질체들인 글리세르알데하이드 3-인산과 다이하이드록시아세톤 인산 간의 가역적인 상호전환 반응을 촉매하는 효소이다.
삼탄당 인산 이성질화효소는 해당과정에서 중요한 역할을 하며, 효율적인 에너지 생성 과정에 필수적이다. 삼탄당 인산 이성질화효소는 포유동물 및 곤충과 같은 동물뿐만 아니라 균류, 식물 및 세균을 포함한 거의 모든 생물체에서 발견되었다. 그러나 유레아플라스마와 같이 해당과정을 수행하지 않는 일부 세균에는 삼탄당 인산 이성질화효소가 없다.
사람에서 삼탄당 인산 이성질화효소의 결핍은 삼탄당 인산 이성질화효소 결핍증이라고 하는 진행성의 심각한 신경계 장애와 관련이 있다. 삼탄당 인산 이성질화효소 결핍증은 만성 용혈성 빈혈이 특징이다. 이 질환을 유발하는 다양한 돌연변이가 있지만, 대부분 104번 위치의 글루탐산이 아스파르트산으로 돌연변이가 일어나는 것이 포함된다.[1]
삼탄당 인산 이성질화효소는 효소가 없을 때와 비교했을 때 수십억 배 더 빠르게 반응을 수행하는 매우 효율적인 효소이다. 반응은 매우 효율적이어서 촉매적으로 완벽하다고 평가된다. 삼탄당 인산 이성질화효소가 촉매하는 반응은 기질이 효소의 활성 부위로 확산될 수 있는 속도에 의해서만 제한된다.[2][3]
 |
반응 메커니즘
[편집]삼탄당 인산 이성질화효소의 반응 메커니즘은 "엔올"의 중간생성물 형성을 포함한다. 각 기저 상태와 전이 상태의 상대적인 자유 에너지는 실험적으로 결정되었으며, 아래의 그래프에 표시되어 있다.[2]
 |
삼탄당 인산 이성질화효소의 구조는 다이하이드록시아세톤 인산과 글리세르알데하이드 3-인산 사이의 전환을 촉진한다. 삼탄당 인산 이성질화효소의 친핵성 Glu165 잔기는 기질을 탈양성자화시키고,[4] 친전자성 His95 잔기는 양성자를 공여하여 엔올 중간생성물을 형성한다.[5][6] 탈양성자화되면 엔올 중간생성물은 붕괴되고, 양성자화된 Glu165로부터 양성자를 추출하여 글리세르알데하이드 3-인산 생성물을 형성한다. 역반응의 촉매 작용이 유사하게 진행되어, 동일한 엔올을 형성하지만, C2의 산소로부터 엔올의 붕괴가 일어난다.[7]
삼탄당 인산 이성질화효소의 확산은 제한적이다. 열역학적인 측면에서 다이하이드록시아세톤 인산의 생성은 글리세르알데하이드 3-인산의 생성보다 20:1로 선호된다.[8] 그러나 해당과정에서 글리세르알데하이드 3-인산은 후속 단계에의 반응에 의해 계속해서 소모되기 때문에 이러한 소모는 새로운 글리세르알데하이드 3-인산의 생성 반응을 유발한다. 삼탄당 인산 이성질화효소는 효소의 활성 부위에 결합하는 황산염, 인산염 및 비산염 이온에 의해 저해된다.[9] 다른 저해제로는 전이상태 유사체인 2-포스포글리콜산 및 기질 유사체인 글리세롤- 1-인산이 있다.[10]
구조
[편집]
삼탄당 인산 이성질화효소는 동일한 소단위체의 이량체이며, 각각의 소단위체는 약 250개의 아미노산 잔기들로 구성된다. 소단위체의 3차원 구조는 외부에 8개의 α-나선과 β-시트를 포함하고 있다. 예시된 그림에서 까 소단위체의 리본 골격은 N-말단에서부터 C-말단에 이르기까지 청색에서부터 적색으로 표시되어 있다. 이러한 구조적 모티프를 αβ-배럴 또는 TIM 배럴이라고 하며, 가장 일반적으로 관찰되는 단백질 접힘이다. 이 효소의 활성 부위는 배럴의 중앙에 위치한다. 글루탐산 잔기와 히스티딘 잔기가 촉매 매커니즘에 관여한다. 활성 부위 잔기들 주변의 서열은 알려진 모든 삼탄당 인산 이성질화효소에서 보존되어 있다.
삼탄당 인산 이성질화효소의 구조는 효소의 기능과 밀접하게 관련되어 있다. 정확하게 배치된 글루탐산 및 히스티딘 잔기가 엔올을 형성하는 것 외에도, 삼탄당 인산 이성질화효소의 10개 또는 11개의 아미노산 사슬은 중간생성물을 안정화시키는 루프로서 작용한다. 166번째 잔기부터 176번째 잔기에 의해 형성된 루프는 닫히고, 기질의 인산기와 수소 결합을 형성한다. 이 작용은 반응 경로 상의 엔올 중간생성물 및 다른 전이 상태들을 안정화시킨다.[7]
반응을 동역학적으로 실현가능하게 만드는 것 외에도, 삼탄당 인산 이성질화효소 루프는 반응성 엔올 중간생성물을 격리시켜 메틸글리옥살 및 무기 인산으로의 분해를 방지한다. 효소와 기질의 인산기 사이의 수소 결합은 그러한 분해를 입체전자적으로 불리하게 만든다.[7] 메틸글리옥살은 독소이며, 형성된 경우 글리옥살레이스 시스템을 통해 제거된다.[11] 고에너지 인산 결합의 분해 및 해당과정의 나머지 기질들의 소모는 메틸글리옥살의 형성을 비효율적으로 만든다.
연구에 따르면 활성 부위에 가까운 리신(12번 위치)도 효소의 기능에 중요하다. 생리적 pH에서 양성자화된 리신은 인산기의 음전하를 중화시키는 데 도움이 될 수 있다. 이 리신 잔기가 중성 아미노산으로 치환되는 돌연변이가 일어나면 삼탄당 인산 이성질화효소는 모든 기능을 상실하지만, 양전하를 띠는 다른 아미노산으로 치환된 돌연변이체는 일부 기능을 유지한다.[12]
같이 보기
[편집]각주
[편집]- ↑ Orosz F, Oláh J, Ovádi J (December 2006). “Triosephosphate isomerase deficiency: facts and doubts”. 《IUBMB Life》 58 (12): 703–15. doi:10.1080/15216540601115960. PMID 17424909.
- ↑ 가 나 Albery WJ, Knowles JR (December 1976). “Free-energy profile of the reaction catalyzed by triosephosphate isomerase”. 《Biochemistry》 15 (25): 5627–31. doi:10.1021/bi00670a031. PMID 999838.
- ↑ Rose IA, Fung WJ, Warms JV (May 1990). “Proton diffusion in the active site of triosephosphate isomerase”. 《Biochemistry》 29 (18): 4312–7. doi:10.1021/bi00470a008. PMID 2161683.
- ↑ Alber T, Banner DW, Bloomer AC, Petsko GA, Phillips D, Rivers PS, Wilson IA (June 1981). “On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase”. 《Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences》 293 (1063): 159–71. doi:10.1098/rstb.1981.0069. PMID 6115415.
- ↑ Nickbarg EB, Davenport RC, Petsko GA, Knowles JR (August 1988). “Triosephosphate isomerase: removal of a putatively electrophilic histidine residue results in a subtle change in catalytic mechanism”. 《Biochemistry》 27 (16): 5948–60. doi:10.1021/bi00416a019. PMID 2847777.
- ↑ Komives EA, Chang LC, Lolis E, Tilton RF, Petsko GA, Knowles JR (March 1991). “Electrophilic catalysis in triosephosphate isomerase: the role of histidine-95”. 《Biochemistry》 30 (12): 3011–9. doi:10.1021/bi00226a005. PMID 2007138.
- ↑ 가 나 다 Knowles JR (March 1991). “Enzyme catalysis: not different, just better”. 《Nature》 350 (6314): 121–4. doi:10.1038/350121a0. PMID 2005961.
- ↑ Harris TK, Cole RN, Comer FI, Mildvan AS (November 1998). “Proton transfer in the mechanism of triosephosphate isomerase”. 《Biochemistry》 37 (47): 16828–38. doi:10.1021/bi982089f. PMID 9843453.
- ↑ Lambeir AM, Opperdoes FR, Wierenga RK (October 1987). “Kinetic properties of triose-phosphate isomerase from Trypanosoma brucei brucei. A comparison with the rabbit muscle and yeast enzymes”. 《European Journal of Biochemistry》 168 (1): 69–74. doi:10.1111/j.1432-1033.1987.tb13388.x. PMID 3311744.
- ↑ Lolis E, Petsko GA (July 1990). “Crystallographic analysis of the complex between triosephosphate isomerase and 2-phosphoglycolate at 2.5-A resolution: implications for catalysis”. 《Biochemistry》 29 (28): 6619–25. doi:10.1021/bi00480a010. PMID 2204418.
- ↑ Creighton DJ, Hamilton DS (March 2001). “Brief history of glyoxalase I and what we have learned about metal ion-dependent, enzyme-catalyzed isomerizations”. 《Archives of Biochemistry and Biophysics》 387 (1): 1–10. doi:10.1006/abbi.2000.2253. PMID 11368170.
- ↑ Lodi PJ, Chang LC, Knowles JR, Komives EA (March 1994). “Triosephosphate isomerase requires a positively charged active site: the role of lysine-12”. 《Biochemistry》 33 (10): 2809–14. doi:10.1021/bi00176a009. PMID 8130193.
외부 링크
[편집]- 질병관리본부 삼탄당인산염 이성화효소 결핍 빈혈 Archived 2020년 1월 27일 - 웨이백 머신
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Triosephosphate isomerase
- Triosephosphate isomerase in interactive 3D at Proteopedia
- Triosephosphate isomerase (TIM) family in PROSITE
