퓨란
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Furan[1] | |||
| 체계명
1,4-Epoxybuta-1,3-diene 1-Oxacyclopenta-2,4-diene | |||
| 별칭
Oxole
Oxa[5]annulene 1,4-Epoxy-1,3-butadiene 5-Oxacyclopenta-1,3-diene 5-Oxacyclo-1,3-pentadiene Furfuran Divinylene oxide | |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.390 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C4H4O | |||
| 몰 질량 | 68.075 g·mol−1 | ||
| 겉보기 | Colorless, volatile liquid | ||
| 밀도 | 0.936 g/mL | ||
| 녹는점 | −85.6 °C (−122.1 °F; 187.6 K) | ||
| 끓는점 | 31.3 °C (88.3 °F; 304.4 K) | ||
자화율 (χ)
|
-43.09·10−6 cm3/mol | ||
| 위험 | |||
| 물질 안전 보건 자료 | Pennakem | ||
| R-phrases (outdated) | R26/27/28, R45 | ||
| S-phrases (outdated) | S16, S37, S45, S28 | ||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | −69 °C (−92 °F; 204 K) | ||
| 390 °C (734 °F; 663 K) | |||
| 폭발 한계 | Lower: 2.3% Upper: 14.3% at 20 °C | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose)
|
> 2 g/kg (rat) | ||
| 관련 화합물 | |||
관련 heterocycles
|
Pyrrole Thiophene | ||
관련 화합물
|
Tetrahydrofuran (THF) 2,5-Dimethylfuran Benzofuran Dibenzofuran | ||
| 구조 | |||
| C2v | |||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
퓨란(영어: furan)은 4개의 탄소 원자와 1개의 산소 원자로 구성된 5원자 방향족 고리로 이루어진 헤테로고리 유기 화합물이다. 이러한 고리를 가지고 있는 화합물들을 퓨란이라고 부르기도 한다.
퓨란은 끓는점이 실온에 가까운 무색의 가연성 및 고휘발성의 휘발성 액체이다. 퓨란은 알코올, 에터 및 아세톤을 포함한 일반적인 유기 용매에 용해되어, 물에 약간 용해된다.[2] 퓨란은 에터와 클로로포름과 같은 강한 냄새가 난다.[3] 퓨란은 독성이 있으며 사람에게 발암물질일 수 있다. 퓨란은 다른 특수 화합물들의 합성을 위한 출발 물질로 사용된다.[4]
역사[편집]
"퓨란(furan)"이라는 이름은 "겨(bran)"를 의미하는 라틴어 "furfur"에서 유래하였다.[5] 1780년에 칼 빌헬름 셸레에 의해 설명된 최초의 퓨란 유도체는 2-푸로산이었다. 또 다른 중요한 유도체인 푸르푸랄은 1831년에 요한 볼프강 되베라이너에 의해 보고되었으며, 1840년에 존 스텐하우스에 의해 특징지어졌다. 퓨란 자체는 1870년에 하인리히 림프리히트에 의해 최초로 제조되었지만, 림프리히트는 퓨란을 "테트라페놀"이라고(마치 페놀(C6H6O)의 4탄소 유사체인 것처럼) 불렀다.[6][7]
생성[편집]
산업적으로 퓨란은 푸르푸랄의 팔라듐 촉매 탈카보닐화 또는 1,3-뷰타다이엔의 구리 촉매 산화에 의해 제조된다.[4]
 |
실험실에서 퓨란은 푸르푸랄에서 2-푸로산으로 산화된 후 탈카복실화하여 얻을 수 있다.[8] 또한 퓨란은 오탄당 함유 물질 및 셀룰로스 고체 특히 소나무의 열분해에 의해 직접적으로 제조될 수 있다.
퓨란의 합성[편집]
많은 합성 방법들이 개발되었지만, 페이스트-베나리 합성은 퓨란을 합성하는 고전적인 방법이다.[9] 퓨란 합성을 위한 가장 간단한 합성 방법들 중 하나는 팔-크노르 합성에서 1,4-다이케톤과 오산화 인(P2O5)의 반응이다. 로손 시약과 1,4-다이케톤의 싸이오펜 형성 반응은 부산물로 퓨란을 생성한다. 치환된 퓨란을 합성하기 위한 많은 경로들이 존재한다.[10]
화학[편집]
퓨란은 산소 원자에 있는 고립 전자쌍 중 하나가 고리에서 비편재화되어 벤젠과 유사한 4n + 2 방향족 시스템(휘켈 규칙)을 생성하기 때문에 방향족이다. 방향족성으로 인해 분자는 평면 구조이고, 개별적인 이중 결합은 없다. 산소 원자의 다른 고립 전자쌍은 고리 시스템의 평면에서 연장된다. sp2 혼성화는 산소의 고립 전자쌍 중 하나가 p 오비탈에 상주하도록 하여 π 시스템 내에서 상호작용할 수 있게 한다.
방향족성으로 인해 퓨란의 행동은 테트라하이드로퓨란과 같은 보다 전형적인 헤테로고리 에터의 행동과는 상당히 다르다.
- 산소 헤테로 원자의 전자 공여 효과로 인해 퓨란은 친전자성 치환 반응에서 벤젠보다 반응성이 크다. 공명 구조를 조사하면 고리의 전자 밀도가 증가하여 친전자성 치환 속도가 증가함을 알 수 있다.[11]
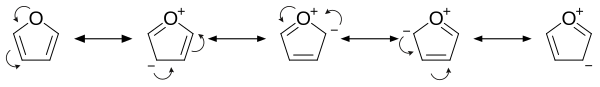 |
- 퓨란은 에틸 (E)-3-나이트로아크릴레이트와 같은 전자가 결핍된 친다이엔체와의 딜스-알더 반응에서 다이엔으로 역할을 한다.[12] 반응 생성물은 엔도 이성질체를 선호하는 이성질체들의 혼합물이다.
 |
- 퓨란과 아린의 딜스-알더 반응은 다른 다환 방향족 화합물의 합성에서 유용한 중간생성물인 다이하이드로나프탈렌의 유도체를 생성한다.[13]
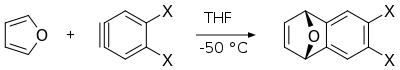 |
- 퓨란의 수소화는 다이하이드로퓨란 및 테트라하이드로퓨란을 순차적으로 생성한다.
- 아크마토비츠 반응에서 퓨란은 다이하이드로피란 화합물로 전환된다.
- 피롤은 SiO2 및 Al2O3와 같은 고체산 촉매의 존재하에 퓨란과 암모니아를 반응시킴으로써 산업적으로 제조될 수 있다.[14]
안전성[편집]
퓨란은 열처리된 상업용 식품에서 발견되며, 천연 식품 성분의 열분해를 통해 생성된다.[15][16] 퓨란은 볶은 커피, 인스턴트 커피 및 가공 영유아식에서 발견된다.[16][17][18] 연구 결과에 따르면 에스프레소 메이커에서 제조된 커피와 캡슐로 제조된 커피는 기존 드립 커피 메이커에서 제조된 커피보다 퓨란이 더 많이 함유되어 있지만 그 수준은 여전히 건강에 대해 안전한 범위 내에 있다.[19]
음식물로부터 사람 노출 예상 수준의 약 2,000배 용량의 퓨란에 노출되면 쥐에서 간세포 종양 및 담관 종양의 위험이 증가한다.[20] 따라서 퓨란은 발암물질로 분류된다.[20]
같이 보기[편집]
각주[편집]
- ↑ 《Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)》. Cambridge: The Royal Society of Chemistry. 2014. 392쪽. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ Jakubke, Hans Dieter; Jeschkeit, Hans (1994). 《Concise Encyclopedia of Chemistry》. Walter de Gruyter. 1–1201쪽. ISBN 0-89925-457-8.
- ↑ DHHS (NIOSH) Publication No. 2016–171, p. 2, Accessed Nov 2019
- ↑ 가 나 Hoydonckx, H. E.; Van Rhijn, W. M.; Van Rhijn, W.; De Vos, D. E.; Jacobs, P. A., 〈Furfural and Derivatives〉, 《울만 공업화학 백과사전(Ullmann's Encyclopedia of Industrial Chemistry)》, Weinheim: Wiley-VCH, doi:10.1002/14356007.a12_119.pub2
- ↑ Senning, Alexander (2006). 《Elsevier's Dictionary of Chemoetymology》. Elsevier. ISBN 0-444-52239-5.
- ↑ Limpricht, H. (1870). “Ueber das Tetraphenol C4H4O”. 《Berichte der Deutschen Chemischen Gesellschaft》 3 (1): 90–91. doi:10.1002/cber.18700030129.
- ↑ Rodd, Ernest Harry (1971). 《Chemistry of Carbon Compounds: A Modern Comprehensive Treatise》. Elsevier.
- ↑ Wilson, W. C. (1941). “Furan”. 《Organic Syntheses》.; 《Collective Volume》 1, 274쪽
- ↑ Hou, X. L.; Cheung, H. Y.; Hon, T. Y.; Kwan, P. L.; Lo, T. H.; Tong, S. Y.; Wong, H. N. (1998). “Regioselective syntheses of substituted furans”. 《Tetrahedron》 54 (10): 1955–2020. doi:10.1016/S0040-4020(97)10303-9.
- ↑ Katritzky, Alan R. (2003). “Synthesis of 2,4-disubstituted furans and 4,6-diaryl-substituted 2,3-benzo-1,3a,6a-triazapentalenes” (PDF). 《Arkivoc》 2004 (2): 109. doi:10.3998/ark.5550190.0005.208.
- ↑ Bruice, Paula Y. (2007). 《Organic Chemistry》 5판. Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ↑ Masesane, I.; Batsanov, A.; Howard, J.; Modal, R.; Steel, P. (2006). “The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid”. 《Beilstein Journal of Organic Chemistry》 2 (9): 9. doi:10.1186/1860-5397-2-9. PMC 1524792. PMID 16674802.
- ↑ Filatov, M. A.; Baluschev, S.; Ilieva, I. Z.; Enkelmann, V.; Miteva, T.; Landfester, K.; Aleshchenkov, S. E.; Cheprakov, A. V. (2012). “Tetraaryltetraanthra[2,3]porphyrins: Synthesis, Structure, and Optical Properties” (PDF). 《J. Org. Chem.》 77 (24): 11119–11131. doi:10.1021/jo302135q. PMID 23205621. 2020년 2월 19일에 원본 문서 (PDF)에서 보존된 문서. 2020년 7월 24일에 확인함.
- ↑ Harreus, Albrecht Ludwig, 〈Pyrrole〉, 《울만 공업화학 백과사전(Ullmann's Encyclopedia of Industrial Chemistry)》, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_453
- ↑ Anese, M.; Manzocco, L.; Calligaris, S.; Nicoli, M. C. (2013). “Industrially Applicable Strategies for Mitigating Acrylamide, Furan and 5-Hydroxymethylfurfural in Food” (PDF). 《Journal of Agricultural and Food Chemistry》 61 (43): 10209–14. doi:10.1021/jf305085r. PMID 23627283. 2017년 8월 8일에 원본 문서 (PDF)에서 보존된 문서. 2020년 7월 24일에 확인함.
- ↑ 가 나 Moro, S.; Chipman, J. K.; Wegener, J. W.; Hamberger, C.; Dekant, W.; Mally, A. (2012). “Furan in heat-treated foods: Formation, exposure, toxicity, and aspects of risk assessment” (PDF). 《Molecular Nutrition & Food Research》 56 (8): 1197–1211. doi:10.1002/mnfr.201200093. hdl:1871/41889. PMID 22641279.
- ↑ European Food Safety Authority (2011). “Update on furan levels in food from monitoring years 2004–2010 and exposure assessment”. 《EFSA Journal》 9 (9): 2347. doi:10.2903/j.efsa.2011.2347.

- ↑ Waizenegger, J.; Winkler, G.; Kuballa, T.; Ruge, W.; Kersting, M.; Alexy, U.; Lachenmeier, D. W. (2012). “Analysis and risk assessment of furan in coffee products targeted to adolescents”. 《Food Additives & Contaminants: Part A》 29 (1): 19–28. doi:10.1080/19440049.2011.617012. PMID 22035212.
- ↑ “Espresso makers: Coffee in capsules contains more furan than the rest”. 《Science Daily》. 2011년 4월 14일.
- ↑ 가 나 Bakhiya, N.; Appel, K. E. (2010). “Toxicity and carcinogenicity of furan in human diet” (PDF). 《Archives of Toxicology》 84 (7): 563–578. doi:10.1007/s00204-010-0531-y. PMID 20237914.