엽록소 a
| |
| 이름 | |
|---|---|
| IUPAC 이름
chlorophyll a
| |
| 체계명
magnesium [methyl (3S,4S,21R)-14-ethyl-4,8,13,18-tetramethyl-20-oxo-3-(3-oxo-3-[(2E,7R,11R)-3,7,11,15-tetramethyl-2-hexadecen-1-yl]oxy}propyl)-9-vinyl-21-phorbinecarboxylatato(2−)-κ2N,N′] | |
| 별칭
α-chlorophyll
| |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.006.852 |
| EC 번호 |
|
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C55H72MgN4O5 | |
| 몰 질량 | 893.509 g·mol−1 |
| 겉보기 | 녹색 |
| 냄새 | 무취 |
| 밀도 | 1.079 g/cm3[1] |
| 녹는점 | ~ 152.3 °C (306.1 °F; 425.4 K)[2] decomposes[1] |
| 불용성 | |
| 용해도 | 에탄올, 에터에 잘 녹음 리그로인,[2] 아세톤, 벤젠, 클로로포름에 녹음[1] |
| 흡광도 | See text |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
엽록소 a(葉綠素 a, 영어: chlorophyll a)는 산소 발생 광합성에 사용되는 특정 형태의 엽록소이다. 엽록소 a는 보라색-파란색 및 주황색-빨간색 빛의 파장에서 대부분의 에너지를 흡수하며 스펙트럼의 녹색 및 녹색에 인접한 부분의 빛을 잘 흡수하지 못한다.[3] 엽록소는 빛을 반사하지 않지만 엽록소를 함유하고 있는 조직은 녹색 빛이 세포벽과 같은 구조에 의해 확산적으로 반사되기 때문에 녹색으로 나타난다.[4] 이 광합성 색소는 전자전달계에서 1차 전자 공여체로서의 역할 때문에 진핵생물, 남세균, 원핵녹조식물에서의 광합성에 필수적이다.[5] 엽록소 a는 또한 특정 엽록소 a인 P680과 P700이 위치한 반응 중심에서 종결되는 안테나 복합체에 공명 에너지를 전달한다.[6]
엽록소 a의 분포
[편집]엽록소 a는 대부분의 광합성 생물이 화학 에너지를 방출하는 데 필수적이지만 광합성에 사용될 수 있는 유일한 색소는 아니다. 모든 산소 발생 광합성 생물은 엽록소 a를 사용하지만 엽록소 b와 같은 보조 색소는 아니다.[5] 엽록소 a는 혐기성 광독립영양생물인 녹색황세균에서도 매우 적은 양이 발견될 수 있다.[7] 녹색황세균은 세균엽록소와 일부 엽록소 a를 사용하지만 산소를 생성하지 않는다.[7] 산소 비발생 광합성은 광합성의 명반응 동안 산소가 생성되는 산소 발생 광합성과 달리 이 과정에 적용되는 용어이다.
분자 구조
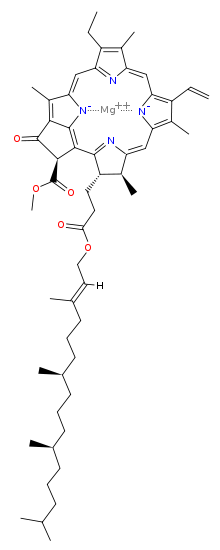
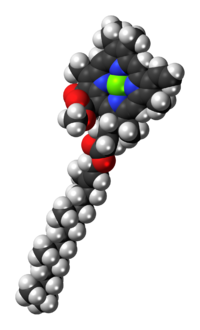
[편집]엽록소 a의 분자 구조는 4개의 질소 원자가 중앙의 마그네슘 원자를 둘러사고 있는 클로린 고리로 구성되며, 여러 개의 다른 곁사슬이 부착되어 있고 피톨 에스터에 의해 형성된 탄화수소 꼬리를 가지고 있다.
 |
|
| 피톨 꼬리를 보여주는 엽록소 a 분자의 구조 | |
클로린 고리
[편집] |
엽록소 a는 클로린이라고 알려진 큰 고리 구조 안에 마그네슘 이온이 들어 있다. 클로린 고리는 피롤로부터 유래된 헤테로고리 화합물이다. 클로린의 4개의 질소 원자가 마그네슘 원자를 둘러싸고 결합한다. 마그네슘 센터는 엽록소 분자의 구조를 고유하게 정의한다.[8] 세균엽록소의 포르피린 고리는 포화되어 있으며 이중 결합과 단일 결합의 교대가 부족하여 빛 흡수에서 변화가 발생한다.[9]
곁사슬
[편집] |
곁사슬은 다양한 엽록소 분자의 클로린 고리에 부착된다. 서로 다른 곁사슬은 각 유형의 엽록소 분자를 특징짓고 빛의 흡수 스펙트럼을 변경한다.[10][11] 예를 들어 엽록소 a와 엽록소 b의 유일한 차이점은 엽록소 b의 7번 탄소(C7) 위치에 메틸기 대신에 카보닐기(알데하이드)가 있다는 것이다.[11]
탄화수소 꼬리
[편집]엽록소 a의 피톨 에스터(그림에서 R)는 엽록체의 틸라코이드 막에 있는 다른 소수성 단백질에 분자를 고정시키는 긴 소수성 꼬리이다.[5] 일단 포르피린 고리로부터 분리되면 피톨은 지구화학 연구와 석유 공급원의 결정에 중요한 두 가지 바이오마커인 프리스테인과 피테인의 전구체가 된다.[12]
생합성
[편집]엽록소 a의 생합성 경로는 다양한 효소들을 활용한다.[13] 대부분의 식물에서 엽록소는 글루탐산으로부터 유도되며 헴 및 시로헴과 공유하는 분지 경로를 따라 합성된다.[14][15][16] 초기 단계에서는 글루탐산을 5-아미노레불린산(ALA)에 통합한다. 2분자의 5-아미노레불린산은 포르포빌리노젠(PBG)으로 환원되고, 4분자의 포르포빌리노젠은 결합하여 프로토포르피린 IX를 생성한다.[8]
엽록소 생성효소 (EC 2.5.1.62)[17]는 다음과 같은 반응을 촉매하여 엽록소 a의 생합성[18][19]을 완료하는 효소이다.
- 클로로필라이드 a + 피틸 이인산 ⇄ 엽록소 a + 이인산
이는 20탄소 화합물인 다이테르펜 알코올 피톨과 함께 클로로필라이드 a의 카복실기의 에스터를 형성한다.
광합성의 반응
[편집]흡광도
[편집]빛의 스펙트럼
[편집] |
엽록소 a는 보라색, 파란색, 빨간색 파장 내의 빛을 흡수한다. 보조 색소는 흡수되는 빛의 스펙트럼을 넓혀 광합성에 사용할 수 있는 빛의 파장 범위를 늘린다.[5] 엽록소 a는 인근에 엽록소 b가 있으면 흡수 스펙트럼의 범위가 확장된다. 빛이 약한 조건에서 식물은 엽록소 a에 대한 엽록소 b의 비율을 더 높여서 광합성 수율을 증가시킨다.[10]
집광
[편집]
광합성 색소에 의한 빛의 흡수는 광자를 화학 에너지로 변환시킨다. 엽록체에 방사되는 빛 에너지는 틸라코이드 막의 색소에 부딪혀 전자를 여기시킨다. 엽록소 a 분자는 특정 파장만 포착하기 때문에 생물체는 보조 색소를 사용하여 더 넓은 범위의 빛 에너지를 포착할 수 있다.[6] 그런 다음 포획된 빛을 한 색소에서 다음 색소로 공명 에너지로 전달하여 반응 중심의 특정 엽록소 분자에 도달할 때까지 한 색소에서 다른 색소로 에너지를 전달한다.[10] 이러한 특별한 엽록소 a 분자는 광계 II와 광계 I 모두에 위치한다. 광계 II의 경우 반응 중심 색소가 P680, 광계 I의 경우 반응 중심 색소가 P700이다.[20] P680과 P700은 전자전달계에 대한 주요 전자 공여체이다. 이 두 가지 광계는 전자 1개를 산화시키기 위한 산화환원전위가 다르다. P700의 산화환원전위는(Em)은 약 500mV인 반면, P680의 산화환원전위는 약 1,100-1,200 mV이다.[20]
1차 전자 공여
[편집]엽록소 a는 광합성의 에너지 단계에서 매우 중요하다. 광합성 과정이 진행되려면 2개의 전자가 전자 수용체로 전달되어야 한다.[5] 두 광계의 반응 중심 내에는 산화환원반응을 통해 전자를 전자전달계로 전달하는 한 쌍의 엽록소 a 분자가 있다.[20]
같이 보기
[편집]각주
[편집]- ↑ 가 나 다 Anatolievich, Kiper Ruslan. “Chlorophyll a”. 《chemister.ru》. 2014년 11월 29일에 원본 문서에서 보존된 문서. 2014년 8월 23일에 확인함.
- ↑ 가 나 Lide, David R., 편집. (2009). 《CRC Handbook of Chemistry and Physics》 90판. Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ↑ “Photosynthesis”. 2009년 11월 28일에 원본 문서에서 보존된 문서.
- ↑ Virtanen O, Constantinidou E, Tyystjärvi E (December 2020). “Chlorophyll does not reflect green light - how to correct a misconception”. 《Journal of Biological Education》 56 (5): 552–559. doi:10.1080/00219266.2020.1858930.
- ↑ 가 나 다 라 마 Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). 〈Photosynthesis, Light, and Life〉. 《Biology of Plants》 7판. W. H. Freeman. 119–127쪽. ISBN 0-7167-9811-5.
- ↑ 가 나 Papageorgiou, G.; Govindjee (2004). 《Chlorophyll a Fluorescence, A Signature of Photosynthesis》. Advances in Photosynthesis and Respiration 19. Springer. 14, 48, 86쪽.
- ↑ 가 나 Eisen JA, Nelson KE, Paulsen IT, Heidelberg JF, Wu M, Dodson RJ, 외. (July 2002). “The complete genome sequence of Chlorobium tepidum TLS, a photosynthetic, anaerobic, green-sulfur bacterium”. 《Proceedings of the National Academy of Sciences of the United States of America》 99 (14): 9509–14. Bibcode:2002PNAS...99.9509E. doi:10.1073/pnas.132181499. PMC 123171. PMID 12093901.
- ↑ 가 나 Zeiger, Eduardo; Taiz, Lincoln (2006). 〈Ch. 7: Topic 7.11: Chlorophyll Biosynthesis〉. 《Plant physiology》 4판. Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7. 2020년 8월 7일에 원본 문서에서 보존된 문서. 2024년 4월 3일에 확인함.
- ↑ Campbell, Mary K.; Farrell, Shawn O. (2007년 11월 20일). 《Biochemistry》 6판. Cengage Learning. 647쪽. ISBN 978-0-495-39041-1.
- ↑ 가 나 다 Lange L, Nobel P, Osmond C, Ziegler H (1981). 《Physiological Plant Ecology I – Responses to the Physical Environment》 12A. Springer-Verlag. 67, 259쪽.
- ↑ 가 나 Niedzwiedzki DM, Blankenship RE (December 2010). “Singlet and triplet excited state properties of natural chlorophylls and bacteriochlorophylls”. 《Photosynthesis Research》 106 (3): 227–38. doi:10.1007/s11120-010-9598-9. PMID 21086044. S2CID 28352285.
- ↑ Eglinton, G.; S. C. Brassell; Simoneit, B. R. T.; Didyk, B. M. (March 1978). “Organic geochemical indicators of palaeoenvironmental conditions of sedimentation”. 《Nature》 (영어) 272 (5650): 216–222. Bibcode:1978Natur.272..216D. doi:10.1038/272216a0. ISSN 1476-4687. S2CID 128737515.
- ↑ Suzuki JY, Bollivar DW, Bauer CE (1997). “Genetic analysis of chlorophyll biosynthesis”. 《Annual Review of Genetics》 31 (1): 61–89. doi:10.1146/annurev.genet.31.1.61. PMID 9442890.
- ↑ Battersby, A. R. (2000). “Tetrapyrroles: the Pigments of Life. A Millennium review”. 《Nat. Prod. Rep.》 17 (6): 507–526. doi:10.1039/B002635M. PMID 11152419.
- ↑ Akhtar, M. (2007). 〈The Modification of Acetate and Propionate Side Chains During the Biosynthesis of Haem and Chlorophylls: Mechanistic and Stereochemical Studies〉. 《Ciba Foundation Symposium 180 - the Biosynthesis of the Tetrapyrrole Pigments》. Novartis Foundation Symposia 180. 131–155쪽. doi:10.1002/9780470514535.ch8. ISBN 9780470514535. PMID 7842850.
- ↑ Willows, Robert D. (2003). “Biosynthesis of chlorophylls from protoporphyrin IX”. 《Natural Product Reports》 20 (6): 327–341. doi:10.1039/B110549N. PMID 12828371.
- ↑ Schmid, H. C.; Rassadina, V.; Oster, U.; Schoch, S.; Rüdiger, W. (2002). “Pre-Loading of Chlorophyll Synthase with Tetraprenyl Diphosphate is an Obligatory Step in Chlorophyll Biosynthesis” (PDF). 《Biological Chemistry》 383 (11): 1769–78. doi:10.1515/BC.2002.198. PMID 12530542. S2CID 3099209.
- ↑ Eckhardt, Ulrich; Grimm, Bernhard; Hortensteiner, Stefan (2004). “Recent advances in chlorophyll biosynthesis and breakdown in higher plants”. 《Plant Molecular Biology》 56 (1): 1–14. doi:10.1007/s11103-004-2331-3. PMID 15604725. S2CID 21174896.
- ↑ Bollivar, David W. (2007). “Recent advances in chlorophyll biosynthesis”. 《Photosynthesis Research》 90 (2): 173–194. doi:10.1007/s11120-006-9076-6. PMID 17370354. S2CID 23808539.
- ↑ 가 나 다 Ishikita H, Saenger W, Biesiadka J, Loll B, Knapp EW (June 2006). “How photosynthetic reaction centers control oxidation power in chlorophyll pairs P680, P700, and P870”. 《Proceedings of the National Academy of Sciences of the United States of America》 103 (26): 9855–60. Bibcode:2006PNAS..103.9855I. doi:10.1073/pnas.0601446103. PMC 1502543. PMID 16788069.
외부 링크
[편집]- Zeiger & Taiz 2006, Topic 7.11: Chlorophyll Biosynthesis
