세포 신호전달

세포 신호전달(細胞信號傳達, 미국 영어: cell signaling, 영국 영어: cell signalling)은 생물학에서 세포가 자신, 다른 세포 및 환경과 상호작용하는 과정이다. 세포 신호전달은 원핵생물과 진핵생물에서 모든 세포 생명현상의 기본적인 특성이다.
일반적으로 세포 신호전달 과정에는 신호, 수용체, 효과기라는 세 가지 구성 요소가 포함된다.
생물학에서 신호는 대부분 본질적으로 화학적 신호이지만 압력, 전압, 온도, 빛과 같은 물리적 신호일 수도 있다. 화학적 신호는 특정 수용체에 결합하고 활성화하는 능력을 가진 분자이다. 리간드라고 하는 이러한 분자는 이온(예: Na+, K+, Ca2+ 등), 지질(예: 스테로이드, 프로스타글란딘), 펩타이드(예: 인슐린, ACTH), 탄수화물, 글리코실화된 단백질(프로테오글리칸), 핵산 등을 포함하며 화학적으로 다양하다. 대부분의 호르몬이 이러한 종류의 화학물질에 속하기 때문에 펩타이드 및 지질 리간드는 특히 중요하다. 펩타이드는 일반적으로 극성의 친수성 분자이다. 따라서 이들은 원형질막의 지질 이중층을 가로질러 자유롭게 확산될 수 없기 때문에 이들의 작용은 세포막 결합 수용체에 의해 매개된다. 반면, 스테로이드 호르몬과 같은 지용성 화합물은 원형질막을 통해 수동적으로 확산되어 세포내 수용체와 상호작용을 할 수 있다. 세포 신호전달은 단거리 또는 장거리에서 일어날 수 있으며 자가분비, 세포내분비, 근접분비, 주변분비, 내분비로 더 분류될 수 있다. 자가분비 신호전달은 신호전달 화학물질을 생성한 동일한 세포에 화학 신호가 작용할 때 일어난다.[1] 세포내분비 신호전달은 세포에서 생성된 화학적 신호가 동일한 세포의 세포질이나 핵에 위치한 수용체에 작용할 때 일어난다.[2] 근접분비 신호전달은 물리적으로 인접한 세포 사이에서 일어난다.[3] 주변분비 신호전달은 인근 세포 사이에서 일어난다. 내분비 신호전달은 일반적으로 혈액에 의해 전달되는 화학적 신호를 통해 거리가 멀리 떨어진 세포들 사이에서 일어난다.[4]
수용체는 원형질막이나 세포질, 세포소기관, 핵과 같은 세포 내부에 위치한 복합체 단백질 또는 단단히 결합된 다량체 단백질이다. 수용체는 특정 화학물질에 결합하거나 물리적 작용제와 상호작용을 할 때 입체구조적 변화를 겪음으로써 신호를 감지하는 능력을 가지고 있다. 특정 세포 반응을 유발하는 능력을 부여하는 것은 주어진 리간드와 수용체 사이의 화학적 상호작용의 특이성이다. 수용체는 크게 세포막 수용체와 세포내 수용체로 분류할 수 있다.
세포막 수용체는 이온 통로 수용체, G 단백질 연결 수용체, 효소 연결 수용체로 더 분류될 수 있다.
이온 통로 수용체는 리간드 활성화 개폐 기능을 갖는 대형 막관통 단백질이다. 이들 수용체가 활성화되면 세포막을 가로지르는 특정 이온의 통과를 허용하거나 차단할 수 있다. 압력이나 온도와 같은 물리적 자극에 의해 활성화되는 대부분의 수용체가 이 범주에 속한다.
G 단백질 연결 수용체는 원형질막 내에 내장된 다량체 단백질이다. 이들 수용체는 세포외 도메인, 막관통 도메인, 세포내 도메인이 있다. 세포외 도메인은 특정 리간드와의 상호작용을 담당한다. 세포내 도메인은 수용체에 의해 조절되는 특정 세포 기능을 궁극적으로 촉발시키는 일련의 화학 반응의 시작을 담당한다.
효소 연결 수용체는 특정 리간드와 결합하는 역할을 하는 세포외 도메인과 촉매 활성을 갖는 세포내 도메인을 가지고 있는 막관통 단백질이다. 활성화되면 효소 부분은 특정 세포 내 화학반응을 촉진하는 역할을 한다.
세포내 수용체는 다른 작용 메커니즘을 가지고 있다. 이들은 일반적으로 스테로이드 호르몬과 같은 원형질막을 통해 수동적으로 확산되는 지용성 리간드와 결합한다. 이러한 리간드는 특정 유전자가 활성화되고 특정 단백질의 합성이 촉진되는 핵 내부에서 호르몬-수송체 복합체를 운반하는 특정 세포질 수송체에 결합한다.
신호전달 경로의 효과기 구성 요소는 신호전달로 시작된다. 이 과정에서 신호는 수용체와 상호작용하여 세포 내에서 일련의 분자 현상을 시작하여 신호전달 과정의 최종 효과를 가져온다. 일반적으로 최종 효과는 이온 통로(리간드 개폐 이온 통로)의 활성화 또는 세포를 통해 신호를 전파하는 2차 전달자 시스템 캐스케이드의 시작으로 구성된다. 2차 전달자 시스템은 신호를 증폭하거나 변조할 수 있으며, 몇 가지 수용체의 활성화로 인해 여러 개의 2차 전달자가 활성화되어 초기 신호(1차 전달자)가 증폭된다. 이러한 신호전달 경로의 하류 효과에는 단백질 분해 절단, 인산화, 메틸화 및 유비퀴틴화와 같은 추가적인 효소 활성이 포함될 수 있다.
신호전달 분자는 다양한 생합성 경로로부터 합성될 수 있으며 수동 수송이나 능동 수송을 통해 또는 심지어 세포 손상을 통해 방출될 수 있다.
각 세포는 특정 세포외 신호 분자에 반응하도록 프로그램되어 있으며 발생, 조직 복구, 면역 및 항상성의 기초가 된다. 신호전달 상호작용의 오류는 암, 자가면역, 당뇨병과 같은 질병을 유발할 수 있다.
분류학적 범위
[편집]세균과 같은 많은 작은 생물에서는 정족수 감지를 통해 개체수가 충분히 클 때만 개체가 활동을 시작할 수 있다. 세포 사이의 이러한 신호전달은 해양 세균인 알리이비브리오 피스케리(Aliivibrio fischeri)에서 처음 관찰되었으며, 이는 개체수가 충분히 조밀할 때 빛을 생성한다.[5] 이 메커니즘에는 신호전달 분자의 생성 및 검출과 이에 대한 반응으로 유전자 전사가 조절되는 과정이 포함된다. 정족수 감지는 그람양성세균과 그람음성세균 모두에서, 그리고 종 내외에서 모두 작동한다.[6]
점균류에서는 개별 세포가 함께 모여 자실체를 형성하고 결국에는 아크라신이라는 화학적 신호의 영향을 받아 포자를 형성한다. 개체는 주화성에 의해 이동한다. 즉, 화학적 기울기에 의해 이끌린다. 일부 종은 cAMP를 신호로 사용한다. 폴리스폰딜리움 비올라케움(Polysphondylium violaceum)과 같은 다른 것들은 글로린으로 알려진 다이펩타이드를 사용한다.[7]
식물과 동물에서 세포 간 신호전달은 주변분비 신호전달(단거리)와 내분비 신호전달(장거리)로 구분되는 세포 외 공간으로의 방출을 통해 일어나거나, 노치 신호전달과 같은 근접분비 신호전달로 알려진 직접적인 접촉에 의해 일어난다.[8] 자가분비 신호전달은 분비 세포가 분비된 신호전달 분자에 반응하는 능력을 갖는 주변분비 신호전달의 특별한 경우이다.[9] 시냅스 신호전달(synaptic signaling)은 뉴런과 표적 세포 사이의 주변분비 신호전달(화학적 시냅스의 경우) 또는 근접분비 신호전달(전기적 시냅스의 경우)의 특별한 경우이다.
세포외 신호
[편집]합성 및 방출
[편집]
많은 세포 신호는 한 세포에서 방출되어 다른 세포와 접촉하기 위해 이동하는 분자에 의해 전달된다. 신호전달 분자는 지질, 인지질, 아미노산, 모노아민, 단백질, 당단백질 또는 기체와 같은 여러 화학적 부류에 속할 수 있다. 표면 수용체에 결합하는 신호전달 분자는 일반적으로 크고 친수성(예: TRH, 바소프레신, 아세틸콜린)인 반면, 세포로 들어가는 신호전달 분자는 일반적으로 작고 소수성(예: 당질 코르티코이드, 갑상샘 호르몬, 콜레칼시페롤, 레티노산)이다. 그러나 두 가지 모두에 대한 중요한 예외가 많으며 동일한 분자가 표면 수용체를 통해 또는 세포내분비 방식으로 작용하여 서로 다른 효과를 나타낼 수 있다.[9] 동물 세포에서는 특수 세포가 이러한 호르몬을 방출하여 순환계를 통해 신체의 다른 부위로 이동한다. 그런 다음 호르몬을 인식하고 반응하여 결과를 생성할 수 있는 표적 세포에 도달한다. 이는 내분비 신호전달이라고 알려져 있다. 식물 성잘 조절인자 또는 식물 호르몬은 세포를 통해 이동하거나 기체 형태로 공기를 통해 확산되어 표적 세포에 도달한다.[10] 황화 수소는 인체의 일부 세포에서 소량으로 생성되며 다양한 생물학적 신호전달 기능을 가지고 있다. 현재 인체에서 신호전달 분자로 작용하는 것으로 알려진 기체는 산화 질소와 일산화 탄소 두 가지 뿐이다.[11]
세포 외 배출
[편집]세포 외 배출은 세포가 신경전달물질 및 단백질과 같은 분자를 세포 밖으로 운반하는 과정이다. 능동 수송 메커니즘으로서 세포 외 배출은 물질을 수송하기 위해 에너지를 사용한다. 세포 외 배출과 이에 반대되는 세포 내 섭취(물질을 세포 안으로 들여오는 과정)은 모든 세포에서 사용된다. 왜냐하면 세포에 중요한 대부분의 화학 물질은 수동 수송에 의해 세포막의 소수성 부분을 통과할 수 없는 크기가 큰 극성 분자이기 때문이다. 세포 외 배출은 다량의 분자가 방출되는 과정이다. 따라서 이는 대량 수송의 한 형태이다. 세포 외 배출은 포로솜이라고 불리는 세포 원형질막의 분비 포털을 통해 일어난다. 포로솜은 세포 원형질막에 있는 영구적인 컵 모양의 지질단백질 구조로, 분비 소낭이 일시적으로 도킹 및 융합되어 세포로부터 소낭 내 내용물을 방출한다.[12]
세포 외 배출에서 막에 결합된 분비 소포는 세포막으로 운반되어 포로솜에 도킹 및 융합되고 그 내용물(즉, 수용성 분자)은 세포 외 환경으로 분비된다. 이러한 분비는 소낭이 원형질막과 일시적으로 융합되기 때문에 가능하다. 신경전달의 맥락에서 신경전달물질은 일반적으로 세포 외 배출을 통해 시냅스 소포로부터 시냅스 틈으로 방출된다. 그러나 신경전달물질은 막 수송 단백질을 통한 역수송을 통해 방출될 수도 있다.
세포 신호전달의 형태
[편집]자가분비
[편집]
자가분비 신호전달은 동일한 세포의 자가분비 수용체에 결합하여 세포 자체의 변화를 일으키는 호르몬 또는 화학적 메신저(자가분비제라고 함)를 분비하는 세포와 관련된다.[13] 이는 주변분비 신호전달, 세포내분비 신호전달 또는 고전적인 내분비 신호전달과 대조될 수 있다.
세포내분비
[편집]세포내분비 신호전달에서 신호전달 화학물질은 세포 내부에서 생성되며 세포에서 분비되지 않고 세포질 수용체 또는 핵 수용체에 결합한다. 세포내분비 신호전달에서는 신호 물질이 세포에서 분비되지 않고 전달된다. 세포 외부로 분비되지 않는 세포내분비 신호는 자가분비 신호전달과 같은 다른 세포 신호전달 메커니즘과 세포내분비 신호전달을 구분짓는다. 자가분비 신호전달 및 세포내분비 신호전달 모두에서 신호는 이를 생성한 세포에 영향을 미친다.[14]
근접분비
[편집]근접분비 신호전달은 긴밀한 접촉이 필요한 다세포 생물에서 세포-세포 신호전달 또는 세포-세포외 기질 신호전달의 한 유형이다. 근접분비 신호전달은 다음과 같은 세 가지 유형이 있다.
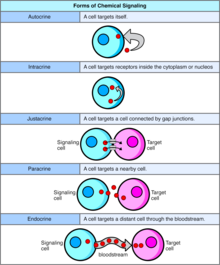
- 막 리간드(단백질, 올리고당류, 지질) 및 인접한 두 세포의 막 단백질이 상호작용한다.
- 통신 접합부는 인접한 두 세포의 세포 내 구획을 연결하여 상대적으로 작은 분자의 이동을 허용한다.
- 세포 외 기질 당단백질과 막 단백질은 상호작용한다.
또한 세균과 같은 단세포 생물에서 근접분비 신호전달은 막 접촉에 의한 상호작용을 의미한다. 근접분비 신호전달은 면역 반응에서 중요한 역할을 하는 일부 성장인자인 사이토카인 및 케모카인 세포 신호에 대해 관찰되었다. 직접적인 막 접촉을 통한 근접분비 신호전달은 발생 과정[15]과 성인의 뇌[16] 모두에서 신경세포체와 미세아교세포의 운동 과정에서도 존재한다.
주변분비
[편집]주변분비 신호전달에서 세포는 인근 세포의 변화를 유도하여 해당 세포의 행동을 변경하는 신호를 생성한다. 주변분비 인자로 알려진 신호전달 분자는 상대적으로 짧은 거리(국소 작용)에 걸쳐 확산된다. 이는 순환계를 통해 훨씬 더 먼 거리를 이동하는 내분비 인자인 호르몬에 의한 세포 신호전달 및 근접분비 신호전달, 자가분비 신호전달과 다른 점이다. 주변분비 인자를 생성하는 세포는 이를 즉각적으로 세포외 환경으로 분비한다. 그런 다음 인자는 수신된 인자의 기울기에 따라 결정되는 인근 세포로 이동한다. 그러나 주변분비 인자가 이동할 수 있는 정확한 거리는 확실하지 않다.
레티노산과 같은 주변분비 신호는 방출 세포 근처에 있는 세포만을 표적으로 삼는다.[17] 신경전달물질은 주변분비 신호의 또 다른 예를 나타낸다.
일부 신호전달 분자는 호르몬과 신경전달물질 둘 다로 기능할 수 있다. 예를 들어 에피네프린과 노르에피네프린은 부신에서 분비되어 혈류를 통해 심장으로 운반될 때 호르몬으로 기능할 수 있다. 노르에피네프린은 또한 뉴런에 의해 생성되어 뇌 내에서 신경전달물질로 기능할 수 있다.[18] 에스트로젠은 난소에서 분비되어 호르몬으로 기능하거나 주변분비 신호전달 또는 자가분비 신호전달을 통해 국소적으로 작용할 수 있다.[19]
주변분비 신호전달은 유도된 세포에서 다양한 배열의 반응을 이끌어내지만, 대부분의 주변분비 인자는 상대적으로 간소화된 수용체 및 경로 세트를 활용한다. 실제로 신체의 다른 기관은(심지어 다른 종 사이에서도) 분화적 발생에 유사한 주변분비 인자 세트를 활용하는 것으로 알려져 있다.[20] 고도로 보존된 수용체 및 경로는 유사한 구조를 기반으로 4가지 주요 패밀리(섬유아세포 성장인자(FGF) 패밀리, 헤지호그 패밀리, Wnt 패밀리, TGF-β 슈퍼패밀리)로 구성될 수 있다. 주변분비 인자가 해당 수용체에 결합하면 신호전달 캐스케이드가 시작되어 다양한 반응이 유도된다.
내분비
[편집]내분비 신호를 호르몬이라고 한다. 호르몬은 내분비 세포에 의해 생성되며 혈액을 통해 신체의 모든 부분으로 이동할 수 있다. 일부 세포만 특정 호르몬에 반응할 수 있는 경우 신호전달의 특이성을 제어할 수 있다. 내분비 신호전달은 생물체의 내분비샘에 의해 호르몬이 순환계로 직접적으로 방출되어 멀리 떨어진 표적 기관을 조절하는 것과 관련된다. 척추동물에서 시상하부는 모든 내분비계의 신경 조절 중추이다. 사람에서 주요 내분비샘은 갑상샘과 부신이다. 내분비계와 그 이상에 대해 연구하는 학문을 내분비학이라고 한다.
수용체
[편집]
세포는 수용체라고 알려진 단백질 부류를 통해 이웃으로부터 정보를 받는다. 수용체는 일부 분자(리간드)와 결합하거나 빛, 온도, 압력과 같은 물리적 요인과 상호작용을 할 수 있다. 수용은 표적 세포(신호 분자에 특이적인 수용체 단백질을 가진 모든 세포)가 세포 표면의 수용체 단백질에 대한 결합을 통해 일반적으로 작은 수용성 분자 형태의 신호를 감지하거나 또는 일단 세포 내부에 들어가면 신호전달 분자가 세포내 수용체, 기타 요소와 결합하거나 세포내분비 신호전달에서와 같이 효소 활성(예: 기체)을 자극할 때 일어난다.
신호전달 분자는 세포 표면 수용체에 대한 리간드로서 표적 세포와 상호작용을 하거나 세포내분비 신호전달을 위해 세포막이나 세포내 섭취를 통해 세포 내로 들어오게 된다. 이는 일반적으로 2차 전달자의 활성화를 초래하여 다양한 생리학적 효과를 초래한다. 많은 포유류에서 초기 배아 세포는 자궁 세포와 신호를 교환한다.[21] 사람의 위장관에서 세균은 서로 간에 그리고 사람의 상피 세포 및 면역계 세포와 신호를 교환한다.[22] 효모인 사카로미케스 케레비시애(Saccharomyces cerevisiae)의 경우 교배하는 동안 일부 세포는 펩타이드 신호(교배인자 페로몬)를 주변 환경으로 내보낸다. 교배인자 펩타이드는 다른 효모 세포의 세포 표면 수용체에 결합하여 교배를 준비하도록 유도할 수 있다.[23]
세포 표면 수용체
[편집]세포 표면 수용체는 단세포 생물 및 다세포 생물의 생물학적 시스템에서 필수적인 역할을 하며 이러한 단백질의 오작동 또는 손상은 암, 심장병 및 천식과 관련이 있다.[24] 이러한 막관통 수용체는 특정 리간드가 결합할 때 입체구조가 바뀌기 때문에 세포 외부에서 세포 내부로 정보를 전달할 수 있다. 세포 표면 수용체에는 이온 통로 연결 수용체, G 단백질 연결 수용체, 효소 연결 수용체라는 세 가지 주요 유형이 있다.
이온 통로 연결 수용체
[편집]
이온 통로 연결 수용체는 신경전달물질과 같은 화학적 전달자(예: 리간드)의 결합에 반응하여 Na+, K+, Ca2+, Cl−과 같은 이온이 막을 통과할 수 있도록 열리는 막관통 이온 통로 단백질 그룹이다.[25][26][27]
시냅스전 뉴런이 흥분되면 소낭에서 시냅스 틈으로 신경전달물질을 방출한다. 그런 다음 신경전달물질은 시냅스후 뉴런에 위치한 수용체에 결합한다. 이러한 수용체가 리간드 개폐 이온 통로인 경우 결과적인 입체구조적 변화로 인해 이온 통로가 열리고 이로 인해 세포막을 가로지르는 이온의 흐름이 발생한다. 이는 차례로 흥분성 수용체 반응의 경우 탈분극, 억제성 수용체 반응의 경우 과분극을 초래한다.
이들 수용체 단백질은 전형적으로 적어도 두 개의 서로 다른 도메인, 즉 이온 구멍을 포함하는 막관통 도메인과 리간드 결합 위치(다른 자리 입체성 결합 부위)를 포함하는 세포외 도메인으로 구성된다. 이러한 모듈성은 단백질의 구조를 찾는 '분할 및 정복(divide and conquer)' 접근 방식(각 도메인을 개별적으로 결정화)을 가능하게 했다. 시냅스에 위치한 이러한 수용체의 기능은 시냅스 이전에 방출된 신경전달물질의 화학적 신호를 직접적이고 매우 빠르게 시냅스 이후의 전기적 신호로 변환하는 것이다. 많은 리간드 개폐 이온 통로는 알로스테릭 리간드 통로 차단제, 이온 또는 막 전위에 의해 추가적으로 조절된다. 리간드 개폐 이온 통로는 진화적인 관계가 결여된 세 가지 슈퍼패밀리, 즉 시스-루프 수용체, 이온성 글루탐산 수용체 및 P2X 수용체로 분류된다.
G 단백질 연결 수용체
[편집]
G 단백질 연결 수용체는 세포 외부의 분자를 감지하고 세포 반응을 활성화하는 세포 표면 수용체로 진화적으로 관련된 단백질의 대규모 그룹이다. G 단백질과 결합하여 세포막을 7번 통과하기 때문에 7-막관통 수용체라고 한다. G 단백질은 활성화된 수용체에서 표적으로 신호를 전달하는 "중간자(middle man)" 역할을 하여 간접적으로 표적 단백질을 조절한다.[28] 리간드는 세포 외 N-말단 및 루프(예: 글루탐산 수용체) 또는 막관통 나선 내의 결합 부위(로돕신 유사 패밀리)에 결합할 수 있다. 빈 수용체의 자발적인 자동 활성화도 관찰될 수 있지만 이들은 모두 작용제에 의해 활성화된다.[28]
G 단백질 연결 수용체는 효모, 동정편모충류 및 동물을 포함한 진핵생물에서만 발견된다.[29] 이러한 수용체와 결합하고 활성화하는 리간드에는 감광성 화합물, 냄새, 페로몬, 호르몬 및 신경전달물질이 포함되며 저분자에서 펩타이드, 큰 단백질에 이르기까지 크기가 다양하다. G 단백질 연결 수용체는 많은 질병에 관여한다.
G 단백질 연결 수용체와 관련된 두 가지 주요 신호전달 경로는 cAMP 신호전달 경로와 포스파티딜이노시톨 신호전달 경로이다.[30] 리간드가 G 단백질 연결 수용체와 결합하면 G 단백질 연결 수용체의 입체구조적 변화가 발생하여 구아닌 뉴클레오타이드 교환인자(GEF)로 역할을 할 수 있다. 그런 다음 G 단백질 연결 수용체는 G 단백질에 결합된 GDP를 GTP로 교환하여 관련 G 단백질을 활성화시킬 수 있다. G 단백질의 α 소단위체는 결합된 GTP와 함께 β 및 γ 소단위체로부터 분리되어 α 소단위체의 유형(Gαs, Gαi/o, Gαq/11, Gα12/13)에 따라 직접적으로 세포 내 신호전달 단백질이나 표적 기능성 단백질에 영향을 미칠 수 있다.[31]
G 단백질 연결 수용체는 중요한 약물 표적이며, 미국 식품의약국(FDA)이 승인한 모든 약물의 약 34%[32]가 이 패밀리의 108개의 구성원을 표적으로 한다. 이들 의약품의 전세계 판매량은 2018년 기준 1,800억 달러로 추산된다.[32] G 단백질 연결 수용체는 현재 시판 중인 약의 약 50%에 대한 표적인 것으로 추정되는데, 이는 주로 정신 질환, 내분비 질환을 포함한 대사 질환, 바이러스 감염을 포함한 면역 질환, 심혈관계 질환, 염증성 질환, 감각 장애 및 암과 같은 많은 질병과 관련된 신호전달 경로에 G 단백질 연결 수용체가 관여하기 때문이다. G 단백질 연결 수용체와 많은 내인성 및 외인성 물질 사이의 연관성은 오래 전에 발견되었는데, 이는 진통제와 같은 역동적으로 발전하는 또 다른 제약 연구 분야와 관련이 있다.[28]
효소 연결 수용체
[편집]
효소 연결 수용체(또는 촉매 수용체)는 세포외 리간드의 결합에 의한 활성화 시 세포 내측에서 효소 활성을 유발하는 막관통 수용체이다.[33] 따라서 효소 연결 수용체는 촉매 기능과 수용체 기능을 모두 가지고 있는 내재성 막 단백질이다.[34]
이들은 두 가지 중요한 도메인, 즉 세포외 리간드 결합 도메인과 촉매 기능을 가지고 있는 세포내 도메인(단일 막횡단 나선)을 가지고 있다. 신호전달 분자는 세포 외부의 수용체에 결합하여 세포 내부의 수용체에 위치한 촉매 기능 부위의 입체구조적 변화를 유발한다. 효소 활성의 예는 다음과 같다.
- 수용체 티로신 키네이스 – 섬유아세포 성장인자 수용체를 예시로 들 수 있다. 대부분의 효소 연결 수용체는 이러한 유형에 해당된다.[35]
- 세린/트레오닌 특이적 단백질 키네이스 – 뼈형성 단백질을 예시로 들 수 있다.
- 구아닐산 고리화효소 – 심방 나트륨이뇨 펩타이드 수용체를 예시로 들 수 있다.
세포내 수용체
[편집]세포내 수용체는 세포질, 핵에 자유롭게 존재하거나 세포소기관이나 막에 결합될 수 있다. 예를 들어, 핵 수용체 및 미토콘드리아 수용체의 존재는 잘 문서화되어 있다.[36] 세포내 수용체에 대한 리간드의 결합은 일반적으로 세포에서 반응을 유도한다. 세포내 수용체는 종종 일정 수준의 특이성을 가지며, 이는 수용체가 해당 리간드에 결합될 때 특정 반응을 시작할 수 있게 한다.[37] 세포내 수용체는 일반적으로 지용성 분자에 작용한다. 수용체는 DNA 결합 단백질 그룹에 결합한다. 결합시 수용체-리간드 복합체는 핵으로 이동하여 유전자 발현 패턴을 변경할 수 있다.[38]
스테로이드 호르몬 수용체
[편집]스테로이드 호르몬 수용체는 핵, 세포질 및 표적 세포의 원형질막에서 발견된다. 이들은 일반적으로 세포내 수용체(일반적으로 세포질 또는 핵)이며 스테로이드 호르몬에 대한 신호전달을 시작하여 몇 시간에서 며칠에 걸쳐 유전자 발현의 변화를 일으킨다. 가장 잘 연구된 스테로이드 호르몬 수용체는 에스트로젠(NR3A 그룹)[39] 및 3-케토스테로이드(NR3C 그룹)[40]에 대한 수용체를 포함하는 핵 수용체 서브패밀리 3(NR3)의 구성원들이다. 핵 수용체 외에도 여러 G 단백질 연결 수용체와 이온 통로가 특정 스테로이드 호르몬에 대한 세포 표면 수용체 역할을 한다.
수용체 하향 조절 메커니즘
[편집]수용체 매개 세포내 섭취는 수용체를 "끄는(off)" 일반적인 방법이다. 세포내 섭취 하향 조절은 수용체 신호전달을 감소시키는 수단으로 간주된다.[41] 이 과정은 수용체에 리간드가 결합하는 과정을 포함하며, 이는 코팅된 구멍의 형성을 촉발하고, 코팅된 구멍은 코팅된 소포로 변형되어 엔도솜으로 운반된다.
수용체 인산화는 수용체 하향 조절의 또 다른 유형이다. 생화학적 변화는 리간드에 대한 수용체 친화성을 감소시킬 수 있다.[42]
수용체의 민감도가 감소하는 것은 수용체가 오랫동안 점유되어 있기 때문이다. 이로 인해 수용체가 더 이상 신호전달 분자에 반응하지 않는 수용체 적응이 발생한다. 많은 수용체는 리간드 농도에 반응하여 변화하는 능력을 가지고 있다.[43]
신호전달 경로
[편집]신호전달 분자에 결합할 때 수용체 단백질은 어떤 방식으로든 변화하고 신호전달 과정을 시작한다. 이는 단일 단계에서 또는 일련의 다른 분자에서 일련의 변화(신호전달 경로라고 함)로 발생할 수 있다. 이러한 경로를 구성하는 분자는 중계 분자(relay molecule)로 알려져 있다. 신호전달의 다단계 과정은 인산기의 추가 또는 제거에 의한 단백질의 활성화 또는 전달자 역할을 할 수 있는 다른 저분자 또는 이온의 방출로 구성되는 경우가 많다. 신호의 증폭은 이러한 다단계 시퀀스의 이점 중 하나이다. 다른 이점으로는 단세포 생물 및 다세포 생물 모두에서 단순한 시스템보다 더 많은 조절 기회와 반응의 미세한 조정이 있다.[10]
어떤 경우에는 리간드가 수용체에 결합함으로써 발생하는 수용체 활성화가 리간드에 대한 세포의 반응과 직접적으로 결합된다. 예를 들어, 신경전달물질인 γ-아미노뷰티르산(GABA)는 이온 통로의 일부인 세포 표면 수용체를 활성화시킬 수 있다. GABA가 뉴런의 GABAA 수용체에 결합하면 수용체의 일부인 염화 이온 선택성 이온 통로가 열린다. GABAA 수용체의 활성화는 음전하를 띤 염화 이온(Cl−)이 뉴런으로 이동하도록 하여 뉴런이 활동 전위를 생성하는 능력을 억제한다. 그러나 많은 세포 표면 수용체의 경우 리간드-수용체 상호작용은 세포 반응과 직접적으로 연결되지 않는다. 활성화된 수용체는 세포 행동에 대한 리간드의 궁극적인 생리학적 효과가 생성되기 전에 먼저 세포 내부의 다른 단백질과 상호작용해야 한다. 종종 상호작용하는 여러 세포 단백질 사슬의 행동은 수용체 활성화에 따라 변경된다. 수용체 활성화에 의해 유발된 세포 변화의 전체 세트를 신호전달 메커니즘 또는 신호전달 경로라고 한다.[44]

보다 복잡한 신호전달 경로로는 외부 신호에 의해 유도되는 세포 내부의 단백질-단백질 상호작용의 변화를 포함하는 MAPK/ERK 경로가 있다. 많은 성장인자가 세포 표면의 수용체에 결합하여 세포가 세포 주기를 통해 진행하고 분열하도록 자극한다. 이러한 수용체 중 일부는 리간드에 결합할 때 자신과 다른 단백질을 인산화하기 시작하는 키네이스이다. 이러한 인산화는 다른 단백질에 대한 결합 부위를 생성하여 단백질-단백질 상호작용을 유도할 수 있다. 이 경우 리간드(예: 상피 성장인자 또는 EGF)가 수용체에(예: 상피 성장인자 수용체 또는 EGFR)에 결합한다. 이는 수용체를 활성화시켜 스스로 인산화되도록 한다. 인산화된 수용체는 어댑터 단백질(GRB2)에 결합하며, 이는 신호를 추가 하류 신호전달 과정에 연결한다. 예를 들어, 활성화되는 신호전달 경로 중 하나로 분열촉진인자 활성화 단백질 키네이스(MAPK) 경로가 있다. 경로에서 "MAPK"로 표시된 신호전달 구성 요소는 원래 "ERK"라고 불렸기 때문에 해당 경로를 MAPK/ERK 경로라고 한다. MAPK 단백질은 전사인자인 MYC와 같은 표적 단백질에 인산기를 부착하여 유전자 전사를 변경하고 궁극적으로 세포 주기의 진행을 변경할 수 있는 효소인 단백질 키네이스이다. 많은 세포 단백질은 이러한 신호전달 경로를 시작하는 성장인자 수용체(예: EGFR)의 하류에서 활성화된다.
일부 신호전달 경로는 세포가 수신하는 신호전달의 양에 따라 다르게 반응한다. 예를 들어, 헤지호그 단백질은 존재하는 헤지호그 단백질의 양에 따라 다양한 유전자를 활성화한다.
복잡한 다중 성분 신호전달 경로는 피드백, 신호 증폭 및 다중 신호와 신호전달 경로 사이의 세포 내부 상호작용을 위한 기회를 제공한다.
특정 세포 반응은 세포 신호전달의 마지막 단계에서 변환된 신호의 결과이다. 이 반응은 본질적으로 신체에 존재하는 모든 세포 활동일 수 있다. 이는 세포골격의 재배열을 촉진하거나 심지어 효소에 의한 촉매작용을 촉진할 수 있다. 세포 신호전달의 이러한 세 단계는 모두 올바른 세포가 지시된 대로, 적적한 시기에, 생물체 내에서 다른 세포 및 자체 기능과 동기화되도록 보장한다. 결국 신호전달 경로의 마지막은 세포 활동의 조절로 이어진다. 이 반응은 세포의 핵이나 세포질에서 일어날 수 있다. 대부분의 신호전달 경로는 핵에서 특정 유전자를 켜고 끄는 방식으로 단백질 합성을 조절한다.[45]
세균과 같은 단세포 생물에서 신호전달은 휴면 상태에서 동료를 '활성화'하고 독성을 강화하며 박테리오파지로부터 방어하는 등에 사용될 수 있다.[46] 사회성 곤충에서도 발견되는 정족수 감지에서는 개별 신호의 다양성이 긍정적인 피드백 루프를 생성하여 조화로운 반응을 생성할 가능성이 있다. 이러한 맥락에서 신호전달 분자를 자가유도물질이라고 한다.[47][48][49] 이러한 신호전달 메커니즘은 단세포 생물에서 다세포 생물로의 진화에 관여했을 수 있다.[47][50] 세균은 특히 생장을 제한하기 위해 접촉 의존적 신호전달을 사용한다.[51]
다세포 생물이 사용하는 신호전달 분자를 종종 페로몬이라고 한다. 이는 위험에 대한 경고, 식략 공급 표시 또는 번식 지원과 같은 목적을 가질 수 있다.[52]
단기 세포 반응
[편집]| 수용체 패밀리 | 리간드/활성화제의 예(괄호: 이에 대한 수용체) | 효과인자의 예 | 추가적인 하류 효과 |
|---|---|---|---|
| 리간드 개폐 이온 통로 | 아세틸콜린 (예: 니코틴성 아세틸콜린 수용체) |
막 투과성의 변화 | 막 전위의 변화 |
| G 단백질 연결 수용체
(7-나선 수용체) |
빛 (로돕신), 도파민 (도파민 수용체), GABA (GABA 수용체), 프로스타글란딘 (프로스타글란딘 수용체) 등 |
삼량체 G 단백질 | 아데닐산 고리화효소, cGMP 포스포다이에스터레이스, G 단백질 개폐 이온 통로 등 |
| 2성분 조절 시스템 | 다양한 활성화제 | 히스티딘 키네이스 | 반응 조절인자 – 편모 운동, 유전자 발현 |
| 막 구아닐산 고리화효소 | 심방 나트륨이뇨 펩타이드, 성게 알 펩타이드 등 |
cGMP | 키네이스 및 통로의 조절 – 다양한 작용 |
| 세포질 구아닐산 고리화효소 | 산화 질소 (산화 질소 수용체) | cGMP | cGMP 개폐 통로, 키네이스의 조절 |
| 인테그린 | 피브로넥틴, 다른 세포외 기질 단백질 | 비수용체 티로신 키네이스 | 다양한 반응 |
유전자 활성의 조절
[편집]| 수용체 패밀리 | 리간드/활성화제의 예(괄호: 이에 대한 수용체) | 효과인자의 예 | 추가적인 하류 효과 |
|---|---|---|---|
| 프리즐드 (7-나선 수용체의 특별한 유형) | Wnt | 디셰블드, 악신 – APC, GSK3-β – β-카테닌 | 유전자 발현 |
| 2성분 조절 시스템 | 다양한 활성화제 | 히스티딘 키네이스 | 반응 조절인자 – 편모 운동, 유전자 발현 |
| 수용체 티로신 키네이스 | 인슐린 (인슐린 수용체), 상피 성장인자 (상피 성장인자 수용체), 섬유아세포 성장인자-α, 섬유아세포 성장인자-β 등 (섬유아세포 성장인자 수용체) |
Ras GTP가수분해효소, 분열촉진인자 활성화 단백질 키네이스, 인지질가수분해효소 C, 포스포이노시타이드 3-키네이스 | 유전자 발현 변화 |
| 사이토카인 수용체 | 에리트로포이에틴, 성장 호르몬 (성장 호르몬 수용체), 인터페론-γ (인터페론-γ 수용체) 등 |
야누스 키네이스 | STAT 단백질 – 유전자 발현 |
| 티로신 키네이스 연결 수용체 | MHC-펩타이드 복합체 – TCR, 항원 – BCR | 세포질 티로신 키네이스 | 유전자 발현 |
| 수용체 단백질 세린/트레오닌 키네이스 | 액티빈 (액티빈 수용체), 인히빈, 뼈형성 단백질 (뼈형성 단백질 수용체), 전환 성장인자-β (TGF-β) |
SMAD 전사인자 | 유전자 발현의 조절 |
| 스핑고미엘리네이스 연결 수용체 | 인터루킨-1 (인터루킨-1 수용체), 종양 괴사인자 (종양 괴사인자 수용체) |
세라마이드 활성화 키네이스 | 유전자 발현 |
| 세포질 스테로이드 수용체 | 스테로이드 호르몬, 갑상샘 호르몬, 레티노산 등 |
전사인자로 작업/상호작용 | 유전자 발현 |
노치 신호전달 경로
[편집]
노치는 수용체 역할을 하는 세포 표면 단백질이다. 동물은 노치 수용체와 특이적으로 상호작용하고 표면에 노치를 발현하는 세포의 반응을 자극하는 신호전달 단백질을 암호화하는 작은 유전자 세트를 가지고 있다. 수용체를 활성화(또는 어떤 경우에는 억제)하는 분자는 일반적으로 수용체 리간드라고 불리는 호르몬, 신경전달물질, 사이토카인 및 성장인자로 분류될 수 있다. 노치 수용체 상호작용과 같은 리간드 수용체 상호작용은 세포 신호전달 메커니즘 및 통신을 담당하는 주요 상호작용으로 알려져 있다.[55] 노치는 인접한 세포에서 발현되는 리간드에 대한 수용체 역할을 한다. 일부 수용체는 세포 표면 단백질인 반면, 다른 수용체는 세포 내부에서 발견된다. 예를 들어, 에스트로젠은 막의 지질 이중층을 통과할 수 있는 소수성 분자이다. 내분비계의 일부로서 다양한 세포 유형에서 세포 내 에스트로젠 수용체가 난소에서 생성된 에스트로젠의 의해 활성화될 수 있다.
노치 매개 신호전달의 경우 신호전달 메커니즘은 비교적 간단할 수 있다. 그림 2에서 볼 수 있듯이 노치의 활성화는 노치 단백질이 프로테에이스에 의해 변경되는 것을 야기할 수 있다. 노치 단백질의 일부는 세포 표면 막에서 방출되어 유전자 발현의 조절에 참여한다. 세포 신호전달 연구에는 두 수용체의 공간적, 시간적 동역학과 다양한 세포 유형의 수용체에 의해 활성화되는 신호전달 경로의 구성 요소를 연구하는 것이 포함된다.[56][57] 단일 세포 질량 분석법을 위한 새로운 방법은 단일 세포 분해능으로 신호전달을 연구할 수 있게 해준다.[58]
노치 신호전달 경로에서는 세포 간의 직접적인 접촉을 통해 배아 발생 과정에서 세포 분화를 정밀하게 제어할 수 있다. 예쁜꼬마선충(Caenorhabditis elegans)의 경우 발생 중인 생식샘의 두 세포는 각각 최종적으로 분화되거나 계속 분열하는 자궁 전구 세포가 될 가능성이 동일하다. 어떤 세포가 계속 분열할지 선택하는 것은 세포 표면 신호의 경쟁에 의해 제어된다. 한 세포는 인접한 세포의 노치 수용체를 활성화하는 세포 표면 단백질을 더 많이 생성하게 된다. 이는 분화할 세포에서 노치 발현을 감소시키고 줄기 세포로 지속되는 세포 표면의 노치를 증가시키는 피드백 루프 또는 시스템을 활성화한다.[59]
같이 보기
[편집]- 스캐폴드 단백질
- 생물기호학
- 분자 세포 인식
- 혼선 (생물학)
- 외막 소포
- 막 소포 트래픽킹
- 숙주-병원체 상호작용
- 레티노산
- JAK-STAT 신호전달 경로
- Imd 경로
- 신호 펩타이드
- 진동 (세포 신호전달)
- 단백질 동역학
- 시스템 생물학
- 지질 신호전달
- 항산화제 및 산화환원 신호전달
- 생화학적 캐스케이드
- 세포 신호전달 테크놀러지 – 항체 개발 및 생산 회사
- 넷패스 – 사람의 신호전달 경로에 대한 엄선된 리소스
- 합성생물학 개방형 언어
- 나노네트워크 – 생물학적 신호전달을 활용하여 임시 생체 내 통신 네트워크 구축
- 신경과학의 솔리톤 모델 – 막의 음파를 통한 물리적 통신
- 일시적인 피드백
각주
[편집]- ↑ Pandit, Nita K. (2007). 《Introduction to the pharmaceutical sciences》 1판. Baltimore, Md.: Lippincott Williams & Wilkins. ISBN 978-0-7817-4478-2.
- ↑ Re, Richard N. (April 2003). “The intracrine hypothesis and intracellular peptide hormone action”. 《BioEssays》 (영어) 25 (4): 401–409. doi:10.1002/bies.10248. ISSN 0265-9247. PMID 12655647.
- ↑ Gilbert, Scott F.; Tyler, Mary S.; Kozlowski, Ronald N. (2000). 《Developmental biology》 6판. Sunderland, Mass: Sinauer Assoc. ISBN 978-0-87893-243-6.
- ↑ “Hormones”. 《medlineplus.gov》. 2023년 11월 28일에 확인함.
- ↑ Nealson, K.H.; Platt, T.; Hastings, J.W. (1970). “Cellular control of the synthesis and activity of the bacterial luminescent system”. 《Journal of Bacteriology》 104 (1): 313–22. doi:10.1128/jb.104.1.313-322.1970. PMC 248216. PMID 5473898.
- ↑ Bassler, Bonnie L. (1999). “How bacteria talk to each other: regulation of gene expression by quorum sensing”. 《Current Opinion in Microbiology》 2 (6): 582–587. doi:10.1016/s1369-5274(99)00025-9. PMID 10607620.
- ↑ Shimomura, O.; Suthers, H. L.; Bonner, J. T. (1982년 12월 1일). “Chemical identity of the acrasin of the cellular slime mold Polysphondylium violaceum”. 《Proceedings of the National Academy of Sciences》 79 (23): 7376–7379. Bibcode:1982PNAS...79.7376S. doi:10.1073/pnas.79.23.7376. ISSN 0027-8424. PMC 347342. PMID 6961416.
- ↑ Gilbert, Scott F. (2000). 〈Juxtacrine Signaling〉. NCBI bookshelf. 《Developmental biology》 6.판. Sunderland, Mass.: Sinauer Assoc. ISBN 978-0878932436.
- ↑ 가 나 Alberts B, Johnson A, Lewis J, 외. (2002). 〈General Principles of Cell Communication〉. NCBI bookshelf. 《Molecular biology of the cell》 4판. New York: Garland Science. ISBN 978-0815332183.
- ↑ 가 나 Reece, Jane B (2010년 9월 27일). 《Campbell Biology》. Benjamin Cummings. 214쪽. ISBN 978-0321558237.
- ↑ Cooper GM, Hausman RE (2000). 〈Signaling Molecules and Their Receptors〉. NCBI bookshelf. 《The cell: a molecular approach》 2판. Washington, D.C.: ASM Press. ISBN 978-0878933006.
- ↑ Jena, Bhanu. “Porosome: the secretory portal in cells”. 《National Library of Medicine》 (영어). ACS Publications. 2024년 1월 27일에 원본 문서에서 보존된 문서. 2024년 1월 27일에 확인함.
- ↑ Pandit, Nikita K. (2007). 《Introduction To The Pharmaceutical Sciences》. Lippincott Williams & Wilkins. 238쪽. ISBN 978-0-7817-4478-2.
- ↑ Rubinow, Katya B. (2018년 3월 8일). “An intracrine view of sex steroids, immunity, and metabolic regulation”. 《Molecular Metabolism》 15: 92–103. doi:10.1016/j.molmet.2018.03.001. ISSN 2212-8778. PMC 6066741. PMID 29551633.
- ↑ Cserép, Csaba; Schwarcz, Anett D.; Pósfai, Balázs; László, Zsófia I.; Kellermayer, Anna; Környei, Zsuzsanna; Kisfali, Máté; Nyerges, Miklós; Lele, Zsolt; Katona, István (September 2022). “Microglial control of neuronal development via somatic purinergic junctions”. 《Cell Reports》 40 (12): 111369. doi:10.1016/j.celrep.2022.111369. PMC 9513806. PMID 36130488.
- ↑ Cserép, Csaba; Pósfai, Balázs; Lénárt, Nikolett; Fekete, Rebeka; László, Zsófia I.; Lele, Zsolt; Orsolits, Barbara; Molnár, Gábor; Heindl, Steffanie; Schwarcz, Anett D.; Ujvári, Katinka; Környei, Zsuzsanna; Tóth, Krisztina; Szabadits, Eszter; Sperlágh, Beáta; Baranyi, Mária; Csiba, László; Hortobágyi, Tibor; Maglóczky, Zsófia; Martinecz, Bernadett; Szabó, Gábor; Erdélyi, Ferenc; Szipőcs, Róbert; Tamkun, Michael M.; Gesierich, Benno; Duering, Marco; Katona, István; Liesz, Arthur; Tamás, Gábor; Dénes, Ádám (2020년 1월 31일). “Microglia monitor and protect neuronal function through specialized somatic purinergic junctions”. 《Science》 367 (6477): 528–537. Bibcode:2020Sci...367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ↑ Duester G (September 2008). “Retinoic acid synthesis and signaling during early organogenesis”. 《Cell》 134 (6): 921–31. doi:10.1016/j.cell.2008.09.002. PMC 2632951. PMID 18805086.
- ↑ Cartford MC, Samec A, Fister M, Bickford PC (2004). “Cerebellar norepinephrine modulates learning of delay classical eyeblink conditioning: evidence for post-synaptic signaling via PKA”. 《Learning & Memory》 11 (6): 732–7. doi:10.1101/lm.83104. PMC 534701. PMID 15537737.
- ↑ Jesmin S, Mowa CN, Sakuma I, Matsuda N, Togashi H, Yoshioka M, Hattori Y, Kitabatake A (October 2004). “Aromatase is abundantly expressed by neonatal rat penis but downregulated in adulthood”. 《Journal of Molecular Endocrinology》 33 (2): 343–59. doi:10.1677/jme.1.01548. PMID 15525594.
- ↑ “Paracrine Factors”. 2018년 7월 27일에 확인함.
- ↑ Mohamed OA, Jonnaert M, Labelle-Dumais C, Kuroda K, Clarke HJ, Dufort D (June 2005). “Uterine Wnt/beta-catenin signaling is required for implantation”. 《Proceedings of the National Academy of Sciences of the United States of America》 102 (24): 8579–84. Bibcode:2005PNAS..102.8579M. doi:10.1073/pnas.0500612102. PMC 1150820. PMID 15930138.
- ↑ Clarke MB, Sperandio V (June 2005). “Events at the host-microbial interface of the gastrointestinal tract III. Cell-to-cell signaling among microbial flora, host, and pathogens: there is a whole lot of talking going on”. 《American Journal of Physiology. Gastrointestinal and Liver Physiology》 288 (6): G1105–9. doi:10.1152/ajpgi.00572.2004. PMID 15890712.
- ↑ Lin JC, Duell K, Konopka JB (March 2004). “A microdomain formed by the extracellular ends of the transmembrane domains promotes activation of the G protein-coupled alpha-factor receptor”. 《Molecular and Cellular Biology》 24 (5): 2041–51. doi:10.1128/MCB.24.5.2041-2051.2004. PMC 350546. PMID 14966283.
- ↑ Han R, Bansal D, Miyake K, Muniz VP, Weiss RM, McNeil PL, Campbell KP (July 2007). “Dysferlin-mediated membrane repair protects the heart from stress-induced left ventricular injury”. 《The Journal of Clinical Investigation》 117 (7): 1805–13. doi:10.1172/JCI30848. PMC 1904311. PMID 17607357.
- “Faulty Cell Membrane Repair Causes Heart Disease”. 《ScienceDaily》 (보도 자료). 2007년 7월 6일.
- ↑ “Gene Family: Ligand gated ion channels”. HUGO Gene Nomenclature Committee. 2017년 11월 14일에 원본 문서에서 보존된 문서. 2024년 4월 14일에 확인함.
- ↑ "ligand-gated channel" - 돌란드 의학사전
- ↑ Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; James O. McNamara; Leonard E. White (2008). 《Neuroscience. 4th ed.》. Sinauer Associates. 156–7쪽. ISBN 978-0-87893-697-7.
- ↑ 가 나 다 Trzaskowski B, Latek D, Yuan S, Ghoshdastider U, Debinski A, Filipek S (2012). “Action of molecular switches in GPCRs--theoretical and experimental studies”. 《Current Medicinal Chemistry》 19 (8): 1090–109. doi:10.2174/092986712799320556. PMC 3343417. PMID 22300046.
 Text was copied from this source, which is available under a Attribution 2.5 Generic (CC BY 2.5) 보관됨 22 2월 2011 - 웨이백 머신 license.
Text was copied from this source, which is available under a Attribution 2.5 Generic (CC BY 2.5) 보관됨 22 2월 2011 - 웨이백 머신 license.
- ↑ King N, Hittinger CT, Carroll SB (July 2003). “Evolution of key cell signaling and adhesion protein families predates animal origins”. 《Science》 301 (5631): 361–3. Bibcode:2003Sci...301..361K. doi:10.1126/science.1083853. PMID 12869759. S2CID 9708224.
- ↑ Gilman AG (1987). “G proteins: transducers of receptor-generated signals”. 《Annual Review of Biochemistry》 56 (1): 615–49. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ↑ Wettschureck N, Offermanns S (October 2005). “Mammalian G proteins and their cell type specific functions”. 《Physiological Reviews》 85 (4): 1159–204. doi:10.1152/physrev.00003.2005. PMID 16183910.
- ↑ 가 나 Hauser AS, Chavali S, Masuho I, Jahn LJ, Martemyanov KA, Gloriam DE, Babu MM (January 2018). “Pharmacogenomics of GPCR Drug Targets”. 《Cell》 172 (1–2): 41–54.e19. doi:10.1016/j.cell.2017.11.033. PMC 5766829. PMID 29249361.
- ↑ Ronald W. Dudek (2006년 11월 1일). 《High-yield cell and molecular biology》. Lippincott Williams & Wilkins. 19–쪽. ISBN 978-0-7817-6887-0. 2010년 12월 16일에 확인함.
- ↑ Alexander SP, Mathie A, Peters JA (February 2007). “Catalytic Receptors”. 《Br. J. Pharmacol.》. 150 Suppl 1 (S1): S122–7. doi:10.1038/sj.bjp.0707205. PMC 2013840.
- ↑ “lecture10”. 2007년 5월 25일에 원본 문서에서 보존된 문서. 2007년 3월 3일에 확인함.
- ↑ Lee, Junghee; Sharma, Swati; Kim, Jinho; Ferrante, Robert J.; Ryu, Hoon (April 2008). “Mitochondrial Nuclear Receptors and Transcription Factors: Who's Minding the Cell?”. 《Journal of Neuroscience Research》 86 (5): 961–971. doi:10.1002/jnr.21564. ISSN 0360-4012. PMC 2670446. PMID 18041090.
- ↑ Clark, James H.; Peck, Ernest J. (1984), Goldberger, Robert F.; Yamamoto, Keith R., 편집., “Intracellular Receptors”, 《Biological Regulation and Development: Hormone Action》 (영어) (Boston, MA: Springer US), 99–127쪽, doi:10.1007/978-1-4757-4619-8_3, ISBN 978-1-4757-4619-8, 2023년 11월 29일에 확인함
- ↑ “Intracellular Receptor - an overview | ScienceDirect Topics”. 《www.sciencedirect.com》. 2023년 11월 29일에 확인함.
- ↑ Dahlman-Wright K, Cavailles V, Fuqua SA, Jordan VC, Katzenellenbogen JA, Korach KS, Maggi A, Muramatsu M, Parker MG, Gustafsson JA (Dec 2006). “International Union of Pharmacology. LXIV. Estrogen receptors”. 《Pharmacological Reviews》 58 (4): 773–81. doi:10.1124/pr.58.4.8. PMID 17132854. S2CID 45996586.
- ↑ Lu NZ, Wardell SE, Burnstein KL, Defranco D, Fuller PJ, Giguere V, Hochberg RB, McKay L, Renoir JM, Weigel NL, Wilson EM, McDonnell DP, Cidlowski JA (Dec 2006). “International Union of Pharmacology. LXV. The pharmacology and classification of the nuclear receptor superfamily: glucocorticoid, mineralocorticoid, progesterone, and androgen receptors” (PDF). 《Pharmacological Reviews》 58 (4): 782–97. doi:10.1124/pr.58.4.9. PMID 17132855. S2CID 28626145. 2019년 2월 28일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Roepstorff, Kirstine; Grøvdal, Lene; Grandal, Michael; Lerdrup, Mads; van Deurs, Bo (May 2008). “Endocytic downregulation of ErbB receptors: mechanisms and relevance in cancer”. 《Histochemistry and Cell Biology》 129 (5): 563–578. doi:10.1007/s00418-008-0401-3. ISSN 0948-6143. PMC 2323030. PMID 18288481.
- ↑ Li, Xin; Huang, Yao; Jiang, Jing; Frank, Stuart J. (2008년 11월 1일). “ERK-dependent threonine phosphorylation of EGF receptor modulates receptor downregulation and signaling”. 《Cellular Signalling》 20 (11): 2145–2155. doi:10.1016/j.cellsig.2008.08.006. ISSN 0898-6568. PMC 2613789. PMID 18762250.
- ↑ Schwartz, Alan L. (December 1995). “Receptor Cell Biology: Receptor-Mediated Endocytosis”. 《Pediatric Research》 (영어) 38 (6): 835–843. doi:10.1203/00006450-199512000-00003. ISSN 1530-0447. PMID 8618782.
- ↑ Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (June 2011). “Signaling gateway molecule pages--a data model perspective”. 《Bioinformatics》 27 (12): 1736–8. doi:10.1093/bioinformatics/btr190. PMC 3106186. PMID 21505029.
- ↑ Reece, Jane B. (2010년 9월 27일). 《Campbell Biology》 9판. Benjamin Cummings. 215쪽. ISBN 978-0-321-55823-7.
- ↑ Mukamolova GV, Kaprelyants AS, Young DI, Young M, Kell DB (July 1998). “A bacterial cytokine”. 《Proceedings of the National Academy of Sciences of the United States of America》 95 (15): 8916–21. Bibcode:1998PNAS...95.8916M. doi:10.1073/pnas.95.15.8916. PMC 21177. PMID 9671779.
- ↑ 가 나 Miller MB, Bassler BL (2001년 10월 1일). “Quorum sensing in bacteria”. 《Annual Review of Microbiology》 55 (1): 165–99. doi:10.1146/annurev.micro.55.1.165. PMID 11544353.
- ↑ Kaper JB, Sperandio V (June 2005). “Bacterial cell-to-cell signaling in the gastrointestinal tract”. 《Infection and Immunity》 73 (6): 3197–209. doi:10.1128/IAI.73.6.3197-3209.2005. PMC 1111840. PMID 15908344.
- ↑ Camilli A, Bassler BL (February 2006). “Bacterial small-molecule signaling pathways”. 《Science》 311 (5764): 1113–6. Bibcode:2006Sci...311.1113C. doi:10.1126/science.1121357. PMC 2776824. PMID 16497924.
- ↑ Stoka AM (June 1999). “Phylogeny and evolution of chemical communication: an endocrine approach”. 《Journal of Molecular Endocrinology》 22 (3): 207–25. doi:10.1677/jme.0.0220207. PMID 10343281.
- ↑ Blango MG, Mulvey MA (April 2009). “Bacterial landlines: contact-dependent signaling in bacterial populations”. 《Current Opinion in Microbiology》 12 (2): 177–81. doi:10.1016/j.mib.2009.01.011. PMC 2668724. PMID 19246237.
- ↑ Tirindelli R, Dibattista M, Pifferi S, Menini A (July 2009). “From pheromones to behavior”. 《Physiological Reviews》 89 (3): 921–56. CiteSeerX 10.1.1.460.5566. doi:10.1152/physrev.00037.2008. PMID 19584317.
- ↑ 가 나 Cell biology/Pollard et al,
- ↑ 가 나 The Cell/ G.M. Cooper
- ↑ Cooper GM (2000). 〈Functions of Cell Surface Receptors.〉. 《The Cell: A Molecular Approach》 2판. Sunderland (MA): Sinauer Associates.
- ↑ Ferrell JE, Machleder EM (May 1998). “The biochemical basis of an all-or-none cell fate switch in Xenopus oocytes”. 《Science》 280 (5365): 895–8. Bibcode:1998Sci...280..895F. doi:10.1126/science.280.5365.895. PMID 9572732.
- ↑ Slavov N, Carey J, Linse S (April 2013). “Calmodulin transduces Ca2+ oscillations into differential regulation of its target proteins”. 《ACS Chemical Neuroscience》 4 (4): 601–12. doi:10.1021/cn300218d. PMC 3629746. PMID 23384199.
- ↑ Slavov N (January 2020). “Unpicking the proteome in single cells”. 《Science》 367 (6477): 512–513. Bibcode:2020Sci...367..512S. doi:10.1126/science.aaz6695. PMC 7029782. PMID 32001644.
- ↑ Greenwald I (June 1998). “LIN-12/Notch signaling: lessons from worms and flies”. 《Genes & Development》 12 (12): 1751–62. doi:10.1101/gad.12.12.1751. PMID 9637676.
더 읽을거리
[편집]- "The Inside Story of Cell Communication". learn.genetics.utah.edu. Retrieved 2018-10-20.
- "When Cell Communication Goes Wrong". learn.genetics.utah.edu. Retrieved 2018-10-24.
외부 링크
[편집]- NCI-Nature Pathway Interaction Database: authoritative information about signaling pathways in human cells.
- 의학주제표목 (MeSH)의 Intercellular+Signaling+Peptides+and+Proteins
- 의학주제표목 (MeSH)의 Cell+Communication
- Signaling Pathways Project: cell signaling hypothesis generation knowledgebase constructed using biocurated archived transcriptomic and ChIP-Seq datasets
