광계 II


광계 II(光系 II, 영어: photosystem II)는 산소 발생 광합성의 광의존적 반응에서 첫 번째 단백질 복합체이다. 물-플라스토퀴논 산화환원효소(영어: water-plastoquinone oxidoreductase)라고도 한다. 광계 II는 식물, 조류, 남세균의 틸라코이드 막에 위치한다. 광계 내에서 효소는 빛의 광자를 포착하여 전자에 에너지를 공급한 다음 다양한 조효소와 보조 인자를 통해 전달되어 플라스토퀴논을 플라스토퀴놀로 환원시킨다. 빛이 있을 때 틸라코이드 내강 쪽의 광계 II에서 물(H2O)이 수소 이온(H+), 전자(e–), 산소(O2)로 분해된다.
광계 II는 손실된 전자를 물이 광분해될 때 획득한 전자로 보충함으로써 광합성이 계속 일어나드록 전자를 공급한다. 물의 산화에 의해 생성된 수소 이온(양성자, H+)은 ATP 생성효소가 ATP를 생성하는 데 사용하는 양성자 기울기를 생성하는 데 도움을 준다. 플라스토퀴논으로 전달된 활성화된 전자는 궁극적으로 NADP+를 NADPH로 환원하는 데 사용되거나 비순환적 전자 흐름에 사용된다.[1] 3-(3,4-다이클로로페닐)-1,1-디아메틸요소(DCMU)는 광합성을 저해하기 위해 실험실에서 자주 사용되는 화합물이다. DCMU가 존재할 경우 광계 II로부터 플라스토퀴논으로의 전자 흐름을 저해한다.
복합체의 구조
[편집]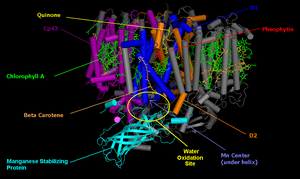

광계 II의 핵심은 두 가지 상동 단백질 D1과 D2의 유사 대칭 이종이량체로 구성된다.[2] 초기 광유도 전하 분리를 겪는 엽록소 이합체에 있는 양전하가 두 단량체에 의해 동일하게 공유되는 다른 모든 광계의 반응 중심과 달리, 온전한 광계 II에서는 전하가 대부분 하나의 엽록소 중심(70~80%)에 국한되어 있다.[3] 이 때문에 P680+는 산화력이 뛰어나고 물 분해에 참여할 수 있다.[2]
광계 II(남세균 및 녹색 식물에서)는 약 20개의 소단위체(생물체에 따라 다름)와 기타 보조 단백질, 광수집 단백질로 구성된다. 각 광계 II에는 35개의 엽록소 a, 12개의 β-카로틴, 2개의 페오피틴, 2개의 플라스토퀴논, 2개의 헴, 1개의 중탄산염, 20개의 지질, Mn
4CaO
5 클러스터(2개의 염화물 이온 포함), 1개의 비헴 Fe2+, 2개의 단량체당 추정 Ca2+ 이온 등 최소한 99개의 보조 인자가 포함되어 있다.[4] 광계 II에는 여러 가지 결정 구조가 있다.[5] 이 단백질에 대한 PDB 접근 코드는 3WU2, 3BZ1, 3BZ2((3BZ1 및 3BZ2는 광계 II 이량체의 단량체 구조임),[4] 2AXT, 1S5L, 1W5C, 1ILX, 1FE1, 1IZL이다.
| 소단위체 | 패밀리 | 기능 |
|---|---|---|
| D1 (PsbA) | 광합성 반응중심 단백질 패밀리 | 반응중심 단백질은 엽록소 P680, 페오피틴, β-카로틴, 퀴논 및 망가니즈 중심과 결합함 |
| D2 (PsbD) | 반응중심 단백질 | |
| CP43 (PsbC) | 광계 II 광수집 단백질 | 망가니즈 중심과 결합함 |
| CP47 (PsbB) | ||
| O | 망가니즈 안정화 단백질 (인터프로: IPR002628) | 망가니즈 안정화 단백질 |
| 관례적으로 유전자 이름은 Psb + 소단위체 문자로 구성된다. 예를 들어 소단위체 O는 PsbO이다. D1(PsbA) 및 D2(PsbD)는 예외이다. | ||
| 보조 인자 | 기능 |
|---|---|
| 엽록소 | 빛 에너지를 흡수하여 화학 에너지로 변환 |
| β-카로틴 | 과도한 광여기 에너지를 해소 |
| 헴 B559 | 2차/보호 전자 운반체로서 사이토크롬 B559(PsbE–PsbF)에 결합 |
| 페오피틴 | 1차 전자 수용체 |
| 플라스토퀴논 | 이동형 틸라코이드 내막 전자 운반체 |
| 망가니즈 중심 | 산소 발생 복합체(OEC)라고도 함 |
산소 발생 복합체
[편집] |
산소 발생 복합체(OEC)는 물이 산화되는 장소이다. 이것은 4개의 망가니즈 이온(+3 ~ +4 범위의 산화 상태)[6]과 2가 칼슘 이온으로 구성된 메탈로-옥소 클러스터이다. 물을 산화시켜 산소와 양성자를 생성할 때 물에서 4개의 전자를 티로신(D1-Y161) 곁사슬로 순차적으로 전달한 다음 P680 자체로 전달한다. 이는 OEE1(PsbO), OEE2(PsbP), OEE3(PsbQ)의 3가지 단백질 소단위체로 구성된다. 네 번째 PsbR 펩타이드가 근처에 연결되어 있다.
산소 발생 복합체의 첫 번째 구조 모델은 2001년 3.8Å 해상도의 냉동 단백질 결정의 X선 결정학을 사용하여 해결되었다.[7] 그 후 몇 년 동안 모델의 해상도는 점차적으로 2.9Å으로 향상되었다.[8][9][10] 이러한 구조를 얻는 것 자체는 대단한 업적이었지만, 산소 발생 복합체를 자세히 보여주지는 못했다. 2011년에 광계 II의 산소 발생 복합체는 1.9Å으로 분석되어 Mn
4CaO
5 클러스터에 결합된 5개의 금속 원자와 4개의 물 분자를 연결하여 옥소 브리지 역할을 하는 5개의 산소 원자가 밝혀졌다. 각 광계 II 단량체에서 1,300개 이상의 물 분자가 발견되었으며, 일부는 양성자, 물 또는 산소 분자에 대해 통로 역할을 할 수 있는 광범위한 수소 결합 네트워크를 형성했다.[11] 이 단계에서는 망가니즈 원자가 사용되는 고강도 X선에 의해 환원되어 관찰된 산소 발생 복합체의 구조가 변경된다는 증거가 있기 때문에 X선 결정학으로 얻은 구조가 편향되어 있다고 제안된다. 이는 연구자들이 미국의 SLAC와 같은 X선 자유 전자 레이저라고 불리는 다른 X선 시설로 결정을 가져가도록 장려했다. 2014년에는 2011년에 관찰된 구조가 확인되었다.[12] 광계 II의 구조를 아는 것만으로는 그것이 정확히 어떻게 작동하는지 밝히기에 충분하지 않다. 이제 기계적 주기의 여러 단계에서 광계 II의 구조를 해결하기 위한 경쟁이 시작되었다(아래에서 설명). 현재 S1 상태와 S3 상태의 구조는 서로 다른 두 그룹에서 거의 동시에 발표되었으며, 이는 Mn1과 Mn4 사이에 O6으로 지정된 산소 분자가 추가되었음을 보여 주며,[13][14] 이는 산소를 생성하는 산소 발생 복합체의 위치일 수 있음을 시사한다.
물 분해
[편집] |
광합성에 의한 물 분해(또는 산소 발생)는 지구 상에서 가장 중요한 반응 중 하나이다. 왜냐하면 이것이 대기 중에 존재하는 거의 모든 산소의 원천이기 때문이다. 더욱이 인공적인 광합성 물 분해는 햇빛을 대체 에너지원으로 효과적으로 사용하는 데 기여할 수 있다.
물의 산화 메커니즘은 상당히 자세하게 이해되고 있다.[15][16][17] 물(H2O)을 산소 분자(O2)로 산화시키려면 2개의 물 분자로부터 4개의 전자와 4개의 양성자를 뽑아내야 한다. 하나의 광계 II 내에서 산소 발생 복합체(OEC)의 순환 반응을 통해 산소가 방출된다는 실험적 증거는 피에르 졸리오 등에 의해 제공되었다.[18] 이들은 어둠에 적응된 광합성 생물(고등 식물, 조류, 남세균)이 일련의 단일 전환 섬광에 노출되면 3번째와 7번째 섬광에서 최대값을 갖고 1번째와 5번째 섬광에서 최소값을 갖는 일반적인 4주기 감쇠 진동으로 산소 발생이 감지된다는 것을 보여주었다.[19] 이 실험을 기반으로 베셀 코크와 동료 연구자들은 산소 발생 복합체(OEC)의 4가지 산화환원 상태를 설명하는 소위 S 상태의 5가지 플래시 유도 전이 주기를 도입했다.[20] 4개의 산화 등가물이 저장되면 (S4 상태에서) 산소 발생 복합체는 S0 상태로 돌아간다. 빛이 없으면 산소 발생 복합체는 S1 상태로 이완된다. S1 상태는 종종 암흑 안정(dark-stable) 상태로 설명된다. S1 상태는 주로 Mn3+, Mn3+, Mn4+, Mn4+의 산화 상태를 갖는 망가니즈 이온으로 구성되는 것으로 간주된다.[21] 마지막으로 자블론스키(Jablonsky)와 라자르(Lazar)는 S 상태와 티로신 Z 사이의 조절 메커니즘과 연결 고리로서 중간생성물 S 상태(intermediate S-state)를 제안했다.[22]
2012년에 렌저(Renger)는 물이 분해되는 동안 물 분자가 다양한 S 상태의 일반적인 산화물로 내부적으로 변화한다는 생각을 밝혔다.[23]
저해제
[편집]광계 II의 저해제는 제초제로 사용된다. 여기에는 트라이아진과 아릴 요소의 두 가지 주요 화합물 부류가 있다. 트라이아진은 아트라진과 시마진이 가장 일반적으로 사용되는 염화 사이아누르로부터 유도되며,[24] 아릴 요소는 클로르톨루론과 다이우론(DCMU)를 포함한다.[25][26]
같이 보기
[편집]각주
[편집]- ↑ Loll B, Kern J, Saenger W, Zouni A, Biesiadka J (December 2005). “Towards complete cofactor arrangement in the 3.0 A resolution structure of photosystem II”. 《Nature》 438 (7070): 1040–4. Bibcode:2005Natur.438.1040L. doi:10.1038/nature04224. PMID 16355230. S2CID 4394735.
- ↑ 가 나 Rutherford AW, Faller P (January 2003). “Photosystem II: evolutionary perspectives”. 《Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences》 358 (1429): 245–53. doi:10.1098/rstb.2002.1186. PMC 1693113. PMID 12594932.
- ↑ Okubo T, Tomo T, Sugiura M, Noguchi T (April 2007). “Perturbation of the structure of P680 and the charge distribution on its radical cation in isolated reaction center complexes of photosystem II as revealed by fourier transform infrared spectroscopy”. 《Biochemistry》 46 (14): 4390–7. doi:10.1021/bi700157n. PMID 17371054.
- ↑ 가 나 Guskov A, Kern J, Gabdulkhakov A, Broser M, Zouni A, Saenger W (March 2009). “Cyanobacterial photosystem II at 2.9-A resolution and the role of quinones, lipids, channels and chloride”. 《Nature Structural & Molecular Biology》 16 (3): 334–42. doi:10.1038/nsmb.1559. PMID 19219048. S2CID 23034289.
- ↑ Junko Y, Kern J, Yachandra VK, Nilsson H, Koroidov S, Messinger J (2015). 〈Chapter 2, Section 3 X-Ray Diffraction and Spectroscopy of Photosystem II at Room Temperature Using Femtosecond X-Ray Pulses〉. Kroneck PM, Sosa Torres ME. 《Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases》. Metal Ions in Life Sciences 15. Springer. 13–43쪽. doi:10.1007/978-3-319-12415-5_2. ISBN 978-3-319-12414-8. PMC 4688042. PMID 25707465.
- ↑ Cox, Nicholas; Pantazis, Dimitrios A.; Lubitz, Wolfgang (2020). “Current Understanding of the Mechanism of Water Oxidation in Photosystem II and Its Relation to XFEL Data”. 《Annual Review of Biochemistry》 89: 795–820. doi:10.1146/annurev-biochem-011520-104801. PMID 32208765. S2CID 214645936.
- ↑ Zouni A, Witt HT, Kern J, Fromme P, Krauss N, Saenger W, Orth P (February 2001). “Crystal structure of photosystem II from Synechococcus elongatus at 3.8 A resolution”. 《Nature》 (영어) 409 (6821): 739–43. doi:10.1038/35055589. PMID 11217865. S2CID 4344756.
- ↑ Kamiya N, Shen JR (January 2003). “Crystal structure of oxygen-evolving photosystem II from Thermosynechococcus vulcanus at 3.7-A resolution”. 《Proceedings of the National Academy of Sciences of the United States of America》 100 (1): 98–103. Bibcode:2003PNAS..100...98K. doi:10.1073/pnas.0135651100. PMC 140893. PMID 12518057.
- ↑ Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (March 2004). “Architecture of the photosynthetic oxygen-evolving center”. 《Science》 303 (5665): 1831–8. Bibcode:2004Sci...303.1831F. doi:10.1126/science.1093087. PMID 14764885. S2CID 31521054.
- ↑ Guskov A, Kern J, Gabdulkhakov A, Broser M, Zouni A, Saenger W (March 2009). “Cyanobacterial photosystem II at 2.9-A resolution and the role of quinones, lipids, channels and chloride”. 《Nature Structural & Molecular Biology》 (영어) 16 (3): 334–42. doi:10.1038/nsmb.1559. PMID 19219048. S2CID 23034289.
- ↑ Umena Y, Kawakami K, Shen JR, Kamiya N (May 2011). “Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å” (PDF). 《Nature》 473 (7345): 55–60. Bibcode:2011Natur.473...55U. doi:10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ↑ Suga M, Akita F, Hirata K, Ueno G, Murakami H, Nakajima Y, Shimizu T, Yamashita K, Yamamoto M, Ago H, Shen JR (January 2015). “Native structure of photosystem II at 1.95 Å resolution viewed by femtosecond X-ray pulses”. 《Nature》 (영어) 517 (7532): 99–103. Bibcode:2015Natur.517...99S. doi:10.1038/nature13991. PMID 25470056. S2CID 205241611.
- ↑ Young ID, Ibrahim M, Chatterjee R, Gul S, Fuller F, Koroidov S, 외. (December 2016). “Structure of photosystem II and substrate binding at room temperature”. 《Nature》 (영어) 540 (7633): 453–457. Bibcode:2016Natur.540..453Y. doi:10.1038/nature20161. PMC 5201176. PMID 27871088.
- ↑ Suga M, Akita F, Sugahara M, Kubo M, Nakajima Y, Nakane T, 외. (March 2017). “Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL”. 《Nature》 (영어) 543 (7643): 131–135. Bibcode:2017Natur.543..131S. doi:10.1038/nature21400. PMID 28219079. S2CID 205254025.
- ↑ Vinyard DJ, Brudvig GW (May 2017). “Progress Toward a Molecular Mechanism of Water Oxidation in Photosystem II”. 《Annual Review of Physical Chemistry》 68 (1): 101–116. doi:10.1146/annurev-physchem-052516-044820. PMID 28226223.
- ↑ Cox N, Pantazis DA, Lubitz W (June 2020). “Current Understanding of the Mechanism of Water Oxidation in Photosystem II and Its Relation to XFEL Data”. 《Annual Review of Biochemistry》 89 (1): 795–820. doi:10.1146/annurev-biochem-011520-104801. PMID 32208765.
- ↑ Ibrahim M, Fransson T, Chatterjee R, Cheah MH, Hussein R, Lassalle L, 외. (June 2020). “Untangling the sequence of events during the S2 → S3 transition in photosystem II and implications for the water oxidation mechanism”. 《Proceedings of the National Academy of Sciences of the United States of America》 117 (23): 12624–12635. doi:10.1073/pnas.2000529117. PMC 7293653. PMID 32434915.
- ↑ Joliot P.; Barbieri G.; Chabaud R. (1969). “Un nouveau modele des centres photochimiques du systeme II”. 《Photochemistry and Photobiology》 10 (5): 309–329. doi:10.1111/j.1751-1097.1969.tb05696.x. S2CID 96744015.
- ↑ Joliot P (2003). “Period-four oscillations of the flash-induced oxygen formation in photosynthesis”. 《Photosynthesis Research》 76 (1–3): 65–72. doi:10.1023/A:1024946610564. PMID 16228566. S2CID 8742213.
- ↑ Kok B, Forbush B, McGloin M (June 1970). “Cooperation of charges in photosynthetic O2 evolution-I. A linear four step mechanism”. 《Photochemistry and Photobiology》 11 (6): 457–75. doi:10.1111/j.1751-1097.1970.tb06017.x. PMID 5456273. S2CID 31914925.
- ↑ Kuntzleman T, Yocum CF (February 2005). “Reduction-induced inhibition and Mn(II) release from the photosystem II oxygen-evolving complex by hydroquinone or NH2OH are consistent with a Mn(III)/Mn(III)/Mn(IV)/Mn(IV) oxidation state for the dark-adapted enzyme”. 《Biochemistry》 44 (6): 2129–42. doi:10.1021/bi048460i. PMID 15697239.
- ↑ Jablonsky J, Lazar D (April 2008). “Evidence for intermediate S-states as initial phase in the process of oxygen-evolving complex oxidation”. 《Biophysical Journal》 94 (7): 2725–36. Bibcode:2008BpJ....94.2725J. doi:10.1529/biophysj.107.122861. PMC 2267143. PMID 18178650.
- ↑ Renger G (August 2012). “Mechanism of light induced water splitting in Photosystem II of oxygen evolving photosynthetic organisms”. 《Biochimica et Biophysica Acta (BBA) - Bioenergetics》 1817 (8): 1164–76. doi:10.1016/j.bbabio.2012.02.005. PMID 22353626.
- ↑ “Chlorotraizine herbicides”. 《alanwood.net》. 2021년 3월 26일에 확인함.
- ↑ “Urea herbicides”. 《alanwood.net》. 2021년 3월 26일에 확인함.
- ↑ Oettmeier W (1992). 〈Herbicides of photosystem II〉. 《The Photosystems》. 349–408쪽. doi:10.1016/B978-0-444-89440-3.50018-7. ISBN 9780444894403.
