페닐알라닌: 두 판 사이의 차이
잔글 봇: 문자열 변경 (에의해 → 에 의해 ) |
영어판 위키(2023년 2월 27일 버전)를 참고하여 기존의 한국어판 문서의 내용을 보충함. |
||
| 1번째 줄: | 1번째 줄: | ||
{{위키데이터 속성 추적}} |
{{위키데이터 속성 추적}} |
||
{{번역 확장 필요|en|PhenylAlanine}} |
|||
{{chembox |
{{chembox |
||
| name = 페닐알라닌 |
|||
| Verifiedfields = changed |
|||
| Watchedfields = changed |
|||
| verifiedrevid = 461742144 |
|||
| pronounce = {{IPAc-en|US|ˌ|f|ɛ|n|əl|ˈ|æ|l|ə|n|iː|n}}, {{IPAc-en|UK|ˌ|f|iː|n|aɪ|l|-}} |
| pronounce = {{IPAc-en|US|ˌ|f|ɛ|n|əl|ˈ|æ|l|ə|n|iː|n}}, {{IPAc-en|UK|ˌ|f|iː|n|aɪ|l|-}} |
||
| ImageFile = L-Phenylalanin - L-Phenylalanine.svg |
| ImageFile = L-Phenylalanin - L-Phenylalanine.svg |
||
| ImageSize = |
| ImageSize = |
||
| ImageName = Skeletal formula |
| ImageName = Skeletal formula |
||
| ImageCaption = |
| ImageCaption = L-페닐알라닌의 [[골격 구조식]] |
||
| ImageFile1 = 1PhenylalanineAtPhysiologicalpH.svg |
| ImageFile1 = 1PhenylalanineAtPhysiologicalpH.svg |
||
| ImageSize1 = 180px |
| ImageSize1 = 180px |
||
| ImageCaption1 = |
| ImageCaption1 = 생리학적 pH에서의 L-페닐알라닌 |
||
| |
| ImageFileL2 = Phenylalanine-from-xtal-3D-bs-17.png |
||
| |
| ImageSizeL2 = 120px |
||
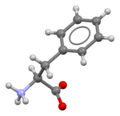
| ImageCaptionL2 = [[공-막대 모형]]<ref name="Ihlefeldt">{{ cite journal | title = The Polymorphs of L‐Phenylalanine | first1 = Franziska Stefanie | last1 = Ihlefeldt | first2 = Fredrik Bjarte | last2 = Pettersen | first3 = Aidan | last3 = von Bonin | first4 = Malgorzata | last4 = Zawadzka | first5 = Prof. Carl Henrik | last5 = Görbitz | journal = [[Angewandte Chemie International Edition|Angew. Chem. Int. Ed.]] | volume = 53 | issue = 49 | pages = 13600–13604 | year = 2014 | doi = 10.1002/anie.201406886 | pmid = 25336255 }}</ref> |
|||
| ImageCaption2 = 3D phenylalanine model |
|||
| ImageFileR2 = Phenylalanine-from-xtal-3D-sf.png |
|||
| IUPACName = (''S'')-2-Amino-3-phenylpropanoic acid |
|||
| ImageSizeR2 = 120px |
|||
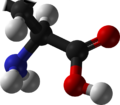
| ImageCaptionR2 = [[공간채움 모형]]<ref name="Ihlefeldt" /> |
|||
| SystematicName = (''S'')-2-amino-3-phenylpropanoic acid |
|||
| IUPACName = phenylalanine |
|||
|Section1={{Chembox Identifiers |
|Section1={{Chembox Identifiers |
||
| index1_label = D/L |
|||
| index2_label = D |
|||
| index_label = L <!-- needs to be L (natural isomer) so drugbank etc. take correct index_label --> |
|||
| IUPHAR_ligand = 3313 |
| IUPHAR_ligand = 3313 |
||
| UNII1_Ref = {{fdacite|correct|FDA}} |
|||
| UNII1 = 8P946UF12S |
|||
| UNII_Ref = {{fdacite|correct|FDA}} |
| UNII_Ref = {{fdacite|correct|FDA}} |
||
| UNII = |
| UNII = 47E5O17Y3R |
||
| UNII2_Ref = {{fdacite|correct|FDA}} |
|||
| UNII2 = 032K16VRCU |
|||
| ChEMBL_Ref = {{ebicite|correct|EBI}} |
| ChEMBL_Ref = {{ebicite|correct|EBI}} |
||
| ChEMBL = 301523 |
| ChEMBL = 301523 |
||
| KEGG_Ref = {{keggcite|correct|kegg}} |
| KEGG_Ref = {{keggcite|correct|kegg}} |
||
| KEGG = D00021 |
| KEGG = D00021 |
||
| InChI = 1/C9H11NO2/c10-8(9(11)12)6-7-4-2-1-3-5-7/h1-5,8H,6,10H2,(H,11,12)/t8-/m0/s1 |
|||
| InChIKey = COLNVLDHVKWLRT-QMMMGPOBBC |
| InChIKey = COLNVLDHVKWLRT-QMMMGPOBBC |
||
| |
| SMILES = c1ccc(cc1)C[C@@H](C(=O)O)N |
||
| |
| SMILES3 = [NH3+][C@@H](CC1=CC=CC=C1)C([O-])=O |
||
| |
| SMILES3_Comment = L Zwitterion |
||
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
||
| StdInChI = 1S/C9H11NO2/c10-8(9(11)12)6-7-4-2-1-3-5-7/h1-5,8H,6,10H2,(H,11,12)/t8-/m0/s1 |
| StdInChI = 1S/C9H11NO2/c10-8(9(11)12)6-7-4-2-1-3-5-7/h1-5,8H,6,10H2,(H,11,12)/t8-/m0/s1 |
||
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
||
| StdInChIKey = COLNVLDHVKWLRT-QMMMGPOBSA-N |
| StdInChIKey = COLNVLDHVKWLRT-QMMMGPOBSA-N |
||
| InChIKey1 = COLNVLDHVKWLRT-UHFFFAOYSA-N |
|||
| CASNo = 150-30-1 |
|||
| InChIKey2 = COLNVLDHVKWLRT-MRVPVSSYSA-N |
|||
| CASNo_Comment = (DL) |
|||
| CASNo1 = 150-30-1 |
|||
| CASNo1_Ref = {{cascite|correct|CAS}} |
|||
| CASNo_Ref = {{cascite|correct|CAS}} |
| CASNo_Ref = {{cascite|correct|CAS}} |
||
| CASNo2_Ref = {{cascite|correct| |
| CASNo = 63-91-2 |
||
| CASNo2_Ref = {{cascite|correct|CAS}} |
|||
| CASNo2 = |
| CASNo2 = 673-06-3 |
||
| PubChem = 6140 |
|||
| CASNo2_Comment = (L) <!-- also CAS verified --> |
|||
| |
| PubChem1 = 994 |
||
| PubChem2 = 71567 |
|||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
||
| ChemSpiderID = 5910 |
| ChemSpiderID = 5910 |
||
| ChemSpiderID1_Ref = {{chemspidercite|correct|chemspider}} |
|||
| DrugBank_Ref = {{drugbankcite|changed|drugbank}} |
|||
| ChemSpiderID1 = 969 |
|||
| ChemSpiderID2_Ref = {{chemspidercite|correct|chemspider}} |
|||
| ChemSpiderID2 = 64639 |
|||
| DrugBank_Ref = {{drugbankcite|correct|drugbank}} |
|||
| DrugBank=DB00120 |
| DrugBank=DB00120 |
||
| ChEBI_Ref = {{ebicite|correct|EBI}} |
| ChEBI_Ref = {{ebicite|correct|EBI}} |
||
| ChEBI = |
| ChEBI = 17295 |
||
| ChEBI2_Ref = {{ebicite|correct|EBI}} |
|||
| ChEBI2 = 16998 |
|||
}} |
}} |
||
|Section2={{Chembox Properties |
|Section2={{Chembox Properties |
||
| 54번째 줄: | 71번째 줄: | ||
| MeltingPt = |
| MeltingPt = |
||
| BoilingPt = |
| BoilingPt = |
||
| pKa=1.83 ( |
| pKa=1.83 (카복실기),</br>9.13 (아미노기)<ref>{{ cite book | vauthors = Dawson RM | title = Data for Biochemical Research | year = 1959 | location = Oxford | publisher = Clarendon Press |display-authors=etal}}</ref> |
||
| Solubility = }} |
| Solubility = }} |
||
|Section3={{Chembox Hazards |
|Section3={{Chembox Hazards |
||
| 64번째 줄: | 81번째 줄: | ||
| AutoignitionPt = }} |
| AutoignitionPt = }} |
||
}} |
}} |
||
'''페닐알라닌'''({{llang|en|phenylalanine}}) (기호: '''Phe''' or '''F''')<ref>{{cite web | url = http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html | title = Nomenclature and Symbolism for Amino Acids and Peptides | publisher = IUPAC-IUB Joint Commission on Biochemical Nomenclature | year = 1983 | access-date = 5 March 2018 | archive-url = https://web.archive.org/web/20081009023202/http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html | archive-date = 9 October 2008 | url-status = dead }}</ref>은 [[단백질의 생합성]]에 사용되는 α-[[아미노산]]이다. 페닐알라닌은 α-[[아미노기]](생물학적 조건에서 [[양성자화]]된 −NH<sub>3</sub><sup>+</sup> 형태), α-[[카복실기]](생물학적 조건에서 [[탈양성자화]]된 −COO<sup>−</sup> 형태) 및 [[곁사슬]]인 [[벤질기]]를 포함하고 있다. 페닐알라닌은 곁사슬인 벤질기의 불활성 및 [[소수성]]으로 인해 중성 및 [[비극성]]으로 분류되는 [[방향족 아미노산]]이다. L-페닐알라닌은 [[DNA]]에 의해 암호화되는 [[단백질]]을 생화학적으로 생성하는 데 사용된다. 페닐알라닌은 [[티로신 (아미노산)|티로신]], [[모노아민 신경전달물질]]인 [[도파민]], [[노르에피네프린]](노르아드레날린), [[에피네프린]](아드레날린) 및 피부 [[생물 색소|색소]]인 [[멜라닌]]의 [[전구체]]이다. 페닐알라닌은 UUU, UUC [[코돈]]에 의해 [[유전 부호|암호화]]되어 있다. |
|||
'''페닐알라닌'''({{llang|en|phenylalanine}})은 [[필수 아미노산]] 중 하나이며, 체내에 이 아미노산을 분해하는 효소(phenylalanine hydroxylase)가 없을 경우엔 [[페닐케톤뇨증]]에 걸리게 된다. [[티로신]]의 전구물질이 될수있다. 한편 감미료 중 [[아스파탐]]의 주 원료이기도 하다. |
|||
페닐알라닌은 [[포유류]]의 [[젖]]에서 자연적으로 발견된다. 페닐알라닌은 식품 및 음료의 제조에 사용되며, [[진통제|진통]] 및 [[항우울제|항우울]] 효과를 위한 영양 보충제로 판매된다. 페닐알라닌은 일반적으로 사용되는 [[식이 보충제]]로 [[신경조절물질]]인 [[펜에틸아민]]의 직접적인 [[전구체]]이다. 필수 아미노산인 페닐알라닌은 페닐알라닌이나 페닐알라닌 함유 [[단백질]]을 섭취해야 하는 사람과 다른 동물들에서 [[신생합성]]되지 않는다. |
|||
== 페닐알라닌 하이드록실레이스 == |
|||
[[하이드록실레이스]](hydroxylase,Hydroxylation)반응에 관여하는 [[페닐알라닌 하이드록실레이스]](phenylalanine hydroxylase)의 결핍은 페닐알라닌의 축적으로 이어질수있다. |
|||
== |
== 역사 == |
||
페닐알라닌에 대한 최초의 설명은 1879년에 [[에른스트 슐츠]]와 바르비에리(Barbieri)가 [[루피누스 루테우스]](''Lupinus luteus'') 묘목에서 [[실험식]]이 C<sub>9</sub>H<sub>11</sub>NO<sub>2</sub>인 화합물을 확인했을 때 이루어졌다. 1882년에 [[에밀 에를렌마이어]]와 리프()는 [[페닐아세트알데하이드]], [[사이안화 수소]] 및 [[암모니아]]로부터 페닐알라닌을 최초로 합성했다.<ref>{{cite book|url=https://archive.org/details/bub_gb_6uVYAAAAYAAJ|title=A Dictionary of Applied Chemistry|author-link=|year=1913|publisher=Longmans, Green, and Co.|pages=[https://archive.org/details/bub_gb_6uVYAAAAYAAJ/page/n202 191]–193|access-date=2012-06-04|vauthors=Thorpe TE}}</ref><ref>{{ cite book | vauthors = Plimmer RH | veditors = Plimmer RH, Hopkins FG | title = The Chemical Composition of the Proteins | url = https://books.google.com/books?id=7JM8AAAAIAAJ&pg=PA93 | access-date = 2012-06-04 | edition = 2nd | series = Monographs on Biochemistry | volume = Part I. Analysis | orig-year = 1908 | year = 1912 | publisher = Longmans, Green and Co. | location = London | pages = 93–97 }}</ref> |
|||
페닐알라닌(phenylalanine)은 [[트랜스아미나아제]](transaminase)에 의해 [[페닐피루브산]](phenylpyruvate)으로 전환될 수 있다. 페닐알라닌의 증가와 페닐알라닌 하이드록실레이스의 결핍은 생물학적 관점에서 서로 병합하여 심각한 신체적 데미지를 줄 수 있다고 알려져있다. |
|||
페닐알라닌의 [[코돈]]은 1961년에 [[요하네스 하인리히 마테이]]와 [[마셜 워런 니런버그]]에 의해 처음으로 발견되었다. 그들은 [[mRNA]]를 사용하여 [[대장균]]의 [[게놈]]에 [[유라실]] 염기를 반복적으로 삽입함으로써 대장균이 반복되는 페닐알라닌으로만 구성된 [[폴리펩타이드]]를 생성하도록 할 수 있음을 보여주었다. 이러한 발견은 게놈에 저장된 정보와 살아 있는 [[세포]]에서의 [[단백질]] [[유전자 발현|발현]]을 연결하는 암호화 관계의 본질을 확립하는 데 도움이 되었다. |
|||
== 섭취 == |
|||
페닐알라닌은 [[콩]]류와 고기류에서 두드러지게 보여지며 몇몇 단백질 제품에서도 함유되어있다. 또한 특히 우리나라에서는 [[페닐케톤뇨증]]에 대한 선택적으로 페닐알라닌을 제거한 조제식으로 PKU-1, 2 분유([[매일유업]])가 제조되어 시판되고 있다. |
|||
== |
== 식이 공급원 == |
||
페닐알라닌의 좋은 식이 공급원으로는 [[계란]], [[닭고기]], [[간]], [[쇠고기]], [[우유]] 및 [[콩]]이 있다.<ref name="RossRoth1991">{{cite book | first1 = Harvey M. | last1 = Ross | first2 = June | last2 = Roth | name-list-style = vanc | title = The Mood Control Diet: 21 Days to Conquering Depression and Fatigue | url = https://books.google.com/books?id=hHWQCZvGUMEC | date = 1 April 1991 | publisher = Simon & Schuster | isbn = 978-0-13-590449-7 | page = 59 }}</ref> 페닐알라닌의 또 다른 일반적인 공급원으로는 [[다이어트 음료]], [[다이어트 식품]], 약물과 같은 인공 감미료인 [[아스파르탐]]으로 [[단맛]]을 낸 모든 것들이 있다. 아스파르탐의 대사로 인해 화합물의 [[대사 산물]] 중 하나인 페닐알라닌이 생성된다.<ref>{{cite web |last1=Zeratsky |first1=Katherine |title=Phenylalanine in diet soda: Is it harmful? |url=https://www.mayoclinic.org/healthy-lifestyle/nutrition-and-healthy-eating/expert-answers/phenylalanine/faq-20058361 |website=Mayo Clinic |access-date=30 April 2019}}</ref> |
|||
페닐알라닌(기호 Phe 또는 F)은 화학식 C9H11NO2의 필수 [[알파아미노산|α-아미노산]]이다.<ref>{{웹 인용| url = http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html | title = Nomenclature and Symbolism for Amino Acids and Peptides | publisher = IUPAC-IUB Joint Commission on Biochemical Nomenclature | year = 1983 | accessdate = 5 March 2018 | archiveurl = https://web.archive.org/web/20081009023202/http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html | archivedate = 9 October 2008 | url-status = dead }}</ref> |
|||
[[알라닌]](Alanine)의 메틸기로 치환된 [[벤질기]](Benzyl group), 또는 알라닌의 말단 수소 대신에서 [[페닐기]]로 볼 수있다. 이 필수 아미노산은 벤질 측쇄의 비활성 및 [[소수성]](hydrophobic) 특성인 비친수성으로 인해 중성 및 비극성으로 분류된다. L- 이성질체는 DNA에 의해 암호화된 단백질을 생화학적으로 형성하는 데 사용된다. 페닐알라닌은 [[티로신]], 모노아민 신경전달 물질인 [[도파민]], [[노르에피네프린]](노르아드레날린), [[에피네프린]](아드레날린) 및 피부 색소 [[멜라닌]]의 [[전구체]]이다. [[코돈]] UUU 및 UUC로 인코딩된다. |
|||
== 식이 권장사항 == |
|||
미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 [[필수 아미노산]]에 대한 권장 식이 허용량(RDA)을 제정했다.19세 이상의 성인의 경우 매일 체중 1 kg당 33 mg의 페닐알라닌 및 티로신이 필요하다.<ref name="DRItext">{{cite book|title=Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids|last1=Institute of Medicine|author1-link=|year=2002|publisher=The National Academies Press|location=Washington, DC|pages=589–768|chapter=Protein and Amino Acids|doi=10.17226/10490|isbn=978-0-309-08525-0|chapter-url=https://www.nap.edu/read/10490/chapter/12}}</ref> |
|||
== 기타 생물학적 역할 == |
|||
L-페닐알라닌은 생물학적으로 DNA에 의해 암호화되는 아미노산 중 하나인 L-[[티로신 (아미노산)|티로신]]으로 전환된다. L-티로신은 차례로 [[L-도파]]로 전환되고, 이는 추가적으로 [[도파민]], [[노르에피네프린]](노르아드레날린) 및 [[에피네프린]](아드레날린)으로 전환된다. 후자의 세 가지 화합물은 [[카테콜아민]]으로 알려져 있다. |
|||
페닐알라닌은 [[트립토판]]과 동일한 능동 수송 운반체를 사용하여 [[혈액뇌장벽]]을 통과한다. 과량의 보충은 관련 [[보조 인자]], [[철]] 또는 [[테트라하이드로비오프테린]]의 남용(결국 제한된 가용성)으로 인해 [[세로토닌]] 및 다른 [[방향족 아미노산]]<ref>{{Cite journal |last1=Eriksson |first1=Johan G |last2=Guzzardi |first2=Maria-Angela |last3=Iozzo |first3=Patricia |last4=Kajantie |first4=Eero |last5=Kautiainen |first5=Hannu |last6=Salonen |first6=Minna K |date=2017-01-01 |title=Higher serum phenylalanine concentration is associated with more rapid telomere shortening in men |url=https://doi.org/10.3945/ajcn.116.130468 |journal=The American Journal of Clinical Nutrition |volume=105 |issue=1 |pages=144–150 |doi=10.3945/ajcn.116.130468 |pmid=27881392 |issn=0002-9165}}</ref> 및 [[산화 질소]]의 생성을 방해할 수 있다. 이들 화합물에 상응하는 효소는 [[방향족 아미노산 하이드록실화효소]] 계열과 [[산화 질소 생성효소]]이다. |
|||
{| |
|||
|[[파일:Catecholamine and trace amine biosynthesis.svg|섬네일|왼쪽|700px|카테콜아민과 미량 아민의 생합성 경로]] |
|||
|} |
|||
=== 식물에서 === |
|||
페닐알라닌은 [[플라보노이드]]의 [[생합성]]에 사용되는 출발 물질이다. [[리그난]]은 페닐알라닌과 [[티로신 (아미노산)|티로신]]으로부터 유도된다. 페닐알라닌은 [[페닐알라닌 암모니아-분해효소]]에 의해 [[신남산]]으로 전환된다.<ref name=Nelson>{{cite book | vauthors = Nelson DL, Cox MM | title = Lehninger, Principles of Biochemistry | edition = 3rd | publisher = Worth Publishing | location = New York | year = 2000 | isbn = 1-57259-153-6 | url-access = registration | url = https://archive.org/details/lehningerprincip01lehn }}</ref> |
|||
== 생합성 == |
|||
페닐알라닌은 [[시킴산 경로]]를 통해 생합성된다. |
|||
== 페닐케톤뇨증 == |
|||
{{main|페닐케톤뇨증}} |
|||
유전 질환인 [[페닐케톤뇨증]](PKU)은 [[페닐알라닌 하이드록실화효소]]의 결핍으로 인해 페닐알라닌을 대사할 수 없는 질환이다. 이러한 증상은 페닐케톤뇨증으로 알려져 있으며, 페닐알라닌의 섭취를 조절해야 한다. 페닐케톤뇨증에 대해서는 보통 혈액 검사를 통해 혈액 내의 페닐알라닌의 양을 모니터링한다. 검사 결과는 mg/dL 및 μmol/L를 사용하여 페닐알라닌의 수치를 보고할 수 있다. 페닐알라닌 1 mg/dL은 대략 60 μmol/L에 해당한다. |
|||
[[고페닐알라닌혈증]]이라고 하는 페닐케톤뇨증의 (희귀한) 변형은 보충될 수 있는 [[테트라하이드로비오프테린]]이라는 [[보조 인자]]를 합성할 수 없기 때문에 발생한다. 고페닐알라닌혈증이 있는 임산부는 장애와 유사한 증상(혈액 내 페닐알라닌의 수치가 높음)을 보일 수 있지만, 이러한 지표는 일반적으로 임신 말기에 사라진다. 페닐케톤뇨증이 있는 임산부는 태아가 질환 유전자에 대해 이형접합성인 경우에도 간의 미성숙으로 인해 태아에 악영향을 미칠 수 있으므로 혈중 페닐알라닌의 수치를 조절해야 한다. |
|||
페닐알라닌의 비식품 공급원으로는 인공 감미료인 [[아스파르탐]]이 있다. 이 화합물은 신체에서 페닐알라닌을 포함한 여러 화학적 부산물로 대체된다. 페닐케톤뇨증에서 체내에 페닐알라닌이 축적될 때 발생하는 문제는 아스파르탐을 섭취시에도 발생하지만 그 정도가 덜하다. [[오스트레일리아]], [[미국]], [[캐나다]]에서 아스파르탐을 함유하고 있는 모든 제품에는 "페닐케톤뇨제: 페닐알라닌 함유"라는 문구가 붙어있어야 한다. 영국에서 아스파르탐을 함유하고 있는 식품은 "아스파르탐 또는 E951"의 존재를 나타내는 성분표를 표시해야 하며<ref>{{cite web | url = http://www.food.gov.uk/safereating/chemsafe/additivesbranch/sweeteners/55174#h_4 | title = Aspartame | publisher = Food Standards Agency | location = UK | access-date = 2007-06-19 | archive-date = 2012-02-21 | archive-url = https://web.archive.org/web/20120221223646/http://www.food.gov.uk/safereating/chemsafe/additivesbranch/sweeteners/55174#h_4 | url-status = dead }}</ref> "페닐알라닌 공급원을 함유함"이라는 경고 문구를 부착해야 한다. 브라질에서는 페닐알라닌이 포함된 제품에 "페닐알라닌 함유"라는 문구가 의무적으로 표시된다. 이러한 경고문은 사람들이 이러한 식품을 피하는 데 도움을 준다. |
|||
== D-페닐알라닌, L-페닐알라닌 및 DL-페닐알라닌 == |
|||
[[입체 이성질체]]인 D-페닐알라닌은 단일 [[거울상 이성질체]] 또는 [[라세미 혼합물]]의 성분으로서 통상적인 [[유기 합성]]에 의해 생성될 수 있다. D-페닐알라닌은 소량의 단백질, 특히 노화된 단백질 및 [[가공식품|가공된 식품]] 단백질에서 발견되지만 [[단백질 생합성]]에서는 참여하지 않는다. D-페닐알라닌이 [[니아신 수용체 2]]에 대해 [[약리학적 활성]]을 가지고 있지만, D-아미노산의 생물학적 기능은 불분명하다.<ref name="IUPHAR/BPS-bio">{{cite web|title=D-phenylalanine: Biological activity |url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=biology&ligandId=5797|website=The IUPHAR/BPS Guide to PHARMACOLOGY|access-date=27 December 2018}}</ref> |
|||
DL-페닐알라닌은 [[진통제|진통]] 및 [[항우울제|항우울]] 활성을 위한 [[식이 보충제]]로 판매된다.<ref name="Wood Reimherr Wender 1985 pp. 21–26">{{cite journal | last=Wood | first=David R. | last2=Reimherr | first2=Fred W. | last3=Wender | first3=Paul H. | title=Treatment of attention deficit disorder with DL-phenylalanine | journal=Psychiatry Research | publisher=Elsevier BV | volume=16 | issue=1 | year=1985 | issn=0165-1781 | doi=10.1016/0165-1781(85)90024-1 | pages=21–26}}</ref><ref name="Beckmann Strauss Ludolph 1977 pp. 123–134">{{cite journal | last=Beckmann | first=H. | last2=Strauss | first2=M. A. | last3=Ludolph | first3=E. | title=Dl-phenylalanine in depressed patients: An open study | journal=Journal of Neural Transmission | publisher=Springer Science and Business Media LLC | volume=41 | issue=2-3 | year=1977 | issn=0300-9564 | doi=10.1007/bf01670277 | pages=123–134}}</ref><ref name="Beckmann Athen Olteanu Zimmer 1979 pp. 49–58">{{cite journal | last=Beckmann | first=Helmut | last2=Athen | first2=Dieter | last3=Olteanu | first3=Margit | last4=Zimmer | first4=Reinhild | title=dl-Phenylalanine versus imipramine: A double-blind controlled study | journal=Archiv für Psychiatrie und Nervenkrankheiten | publisher=Springer Science and Business Media LLC | volume=227 | issue=1 | year=1979 | issn=0003-9373 | doi=10.1007/bf00585677 | pages=49–58}}</ref> DL-페닐알라닌은 D-페닐알라닌과 L-페닐알라닌의 혼합물이다. DL-페닐알라닌의 유명한 진통 활성은 [[카복시펩티데이스 A]]에 의한 D-페닐알라닌의 [[엔케팔린]] [[화학분해|분해]]에 의한 차단 가능성으로 설명될 수 있다.<ref name="IUPHAR/BPS-clinical">{{cite web|title=D-phenylalanine: Clinical data|url=http://www.guidetopharmacology.org/GRAC/LigandDisplayForward?tab=clinical&ligandId=5797|website=The IUPHAR/BPS Guide to PHARMACOLOGY|access-date=27 December 2018}}</ref><ref>{{cite journal | vauthors = Christianson DW, Mangani S, Shoham G, Lipscomb WN | title = Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A | journal = The Journal of Biological Chemistry | volume = 264 | issue = 22 | pages = 12849–53 | date = August 1989 | doi = 10.1016/S0021-9258(18)51564-7 | pmid = 2568989 | url = http://www.jbc.org/content/264/22/12849.full.pdf | doi-access = free }}</ref> DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 신경전달물질인 노르에피네프린과 도파민의 합성에서 L-페닐알라닌의 전구체 역할에 의해 설명될 수 있다. 엔케팔린은 뮤 및 델타 오피오이드 수용체의 작용제로 작용하며, 이러한 수용체의 작용제는 항우울 효과를 나타내는 것으로 알려져 있다.<ref name="Jelen Stone Young Mehta 2022 p=104800">{{cite journal | last=Jelen | first=Luke A. | last2=Stone | first2=James M. | last3=Young | first3=Allan H. | last4=Mehta | first4=Mitul A. | title=The opioid system in depression | journal=Neuroscience & Biobehavioral Reviews | publisher=Elsevier BV | volume=140 | year=2022 | issn=0149-7634 | doi=10.1016/j.neubiorev.2022.104800 | page=104800}}</ref> DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 [[신경전달물질]]인 [[노르에피네프린]]과 [[도파민]]의 합성에서 L-페닐알라닌의 [[전구체]] 역할에 의해 설명될 수 있으나 임상 시험에서 L-페닐알라닌 단독으로는 항우울 효과를 발견하지 못했다.<ref name="Wood Reimherr Wender 1985 pp. 21–26">{{cite journal | last=Wood | first=David R. | last2=Reimherr | first2=Fred W. | last3=Wender | first3=Paul H. | title=Treatment of attention deficit disorder with DL-phenylalanine | journal=Psychiatry Research | publisher=Elsevier BV | volume=16 | issue=1 | year=1985 | issn=0165-1781 | doi=10.1016/0165-1781(85)90024-1 | pages=21–26}}</ref> 뇌에서 노르에피네프린과 도파민의 수치 증가는 항우울 효과를 가지는 것으로 생각된다. D-페닐알라닌은 [[소장 (장기)|소장]]에서 흡수되어 [[문맥 순환]]을 통해 [[간]]으로 운반된다. 소량의 D-페닐알라닌이 L-페닐알라닌으로 전환되는 것으로 보인다. D-페닐알라닌은 [[전신 순환]]을 통해 신체의 다양한 조직에 분포될 수 있다. D-페닐알라닌은 L-페닐알라닌보다 [[혈액뇌장벽]]을 덜 효율적으로 통과하는 것으로 보이며, 섭취한 소량의 D-페닐알라닌은 [[중추신경계]]를 통하지 않고 [[소변]]으로 배설된다.<ref>{{Cite journal|last1=Lehmann|first1=W. D.|last2=Theobald|first2=N.|last3=Fischer|first3=R.|last4=Heinrich|first4=H. C.|date=1983-03-14|title=Stereospecificity of phenylalanine plasma kinetics and hydroxylation in man following oral application of a stable isotope-labelled pseudo-racemic mixture of L- and D-phenylalanine|journal=Clinica Chimica Acta; International Journal of Clinical Chemistry|volume=128|issue=2–3|pages=181–198|issn=0009-8981|pmid=6851137|doi=10.1016/0009-8981(83)90319-4}}</ref> |
|||
L-페닐알라닌은 K<sub>i</sub>가 980 nM인 α2δ Ca<sup>2+</sup> 칼슘 통로에서 길항제이다.<ref name="pmid16380257">{{cite journal | vauthors = Mortell KH, Anderson DJ, Lynch JJ, Nelson SL, Sarris K, McDonald H, Sabet R, Baker S, Honore P, Lee CH, Jarvis MF, Gopalakrishnan M | title = Structure-activity relationships of alpha-amino acid ligands for the alpha2delta subunit of voltage-gated calcium channels | journal = Bioorganic & Medicinal Chemistry Letters | volume = 16 | issue = 5 | pages = 1138–41 | date = March 2006 | pmid = 16380257 | doi = 10.1016/j.bmcl.2005.11.108 }}</ref> |
|||
뇌에서 L-페닐알라닌은 [[NMDA 수용체]]의 [[글리신]] 결합 부위와<ref>{{cite journal | vauthors = Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, Martynyuk AE | title = Specific inhibition of N-methyl-D-aspartate receptor function in rat hippocampal neurons by L-phenylalanine at concentrations observed during phenylketonuria | journal = Molecular Psychiatry | volume = 7 | issue = 4 | pages = 359–67 | year = 2002 | pmid = 11986979 | doi = 10.1038/sj.mp.4000976 | doi-access = free }}</ref> [[AMPA 수용체]]의 [[글루탐산]] 결합 부위에서 [[수용체 길항제|경쟁적 길항제]]이다.<ref name="Glushakov 116–24">{{cite journal | vauthors = Glushakov AV, Dennis DM, Sumners C, Seubert CN, Martynyuk AE | title = L-phenylalanine selectively depresses currents at glutamatergic excitatory synapses | journal = Journal of Neuroscience Research | volume = 72 | issue = 1 | pages = 116–24 | date = April 2003 | pmid = 12645085 | doi = 10.1002/jnr.10569 | s2cid = 42087834 }}</ref> NMDA 수용체의 글리신 결합 부위에서 L-페닐알라닌은 [[실트 회귀]]에 의해 추정된 573 μM의 겉보기 평형 해리 상수(K<sub>B</sub>)를 가지며,<ref>{{cite journal | vauthors = Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, Embury JE, Baker SP, Otero DH, Dennis DM, Seubert CN, Martynyuk AE | title = Long-term changes in glutamatergic synaptic transmission in phenylketonuria | journal = Brain | volume = 128 | issue = Pt 2 | pages = 300–7 | date = February 2005 | pmid = 15634735 | doi = 10.1093/brain/awh354 | doi-access = free }}</ref> 이는 치료되지 않은 사람의 [[페닐케톤뇨증]]에서 관찰된 뇌의 L-페닐알라닌의 농도보다 상당히 낮다.<ref>{{cite journal | vauthors = Möller HE, Weglage J, Bick U, Wiedermann D, Feldmann R, Ullrich K | title = Brain imaging and proton magnetic resonance spectroscopy in patients with phenylketonuria | journal = Pediatrics | volume = 112 | issue = 6 Pt 2 | pages = 1580–3 | date = December 2003 | doi = 10.1542/peds.112.S4.1580 | pmid = 14654669 | hdl = 11858/00-001M-0000-0010-A24A-C | s2cid = 2198040 }}</ref> L-페닐알라닌은 또한 고전적인 [[페닐케톤뇨증]]에서 볼 수 있는 뇌에서의 농도인 980 μM의 [[IC50|IC<sub>50</sub>]]으로 [[해마 (뇌)|해마]]와 [[대뇌 피질]]의 [[글루탐산작동성]] [[시냅스]]에서 [[신경전달물질]]의 방출을 억제하는 반면, D-페닐알라닌은 이에 대한 효과가 훨씬 더 작다.<ref name="Glushakov 116–24"/> |
|||
== 상업적 합성 == |
|||
L-페닐알라닌은 페닐알라닌과 같은 [[방향족 아미노산]]을 자연적으로 생성하는 [[대장균]]을 이용하여 의료용, 사료용 및 [[아스파르탐]]과 같은 영양학적 용도로 대량 생산된다. 상업적으로 생산되는 L-페닐알라닌의 양은 조절 [[프로모터 (생물학)|프로모터]]를 변경하거나 아미노산 합성을 담당하는 [[효소]]를 조절하는 [[유전자]]의 수를 증폭하는 것과 같이 대장균을 유전적으로 조작함으로써 증가될 수 있다.<ref>{{ cite book | last = Sprenger | first = G. A. | name-list-style = vanc | title = Amino Acid Biosynthesis: Pathways, Regulation and Metabolic Engineering | publisher = Springer | year = 2007 | edition = 1st | chapter = Aromatic Amino Acids | pages = 106–113 | isbn = 978-3-540-48595-7 }}</ref> |
|||
== 유도체 == |
|||
보로노페닐알라닌(BPA)은 [[중성자 포획요법]]에서 사용되는 페닐알라닌의 다이하이드록시보릴 유도체이다. |
|||
4-아지도-L-페닐알라닌은 [[화학생물학]]에서 [[생체접합]]을 위한 도구로 사용되는 단백질을 구성하는 비천연 아미노산이다. |
|||
== 같이 보기 == |
== 같이 보기 == |
||
* [[ |
* [[티로신]] |
||
* [[트립토판]] |
* [[트립토판]] |
||
* [[ |
* [[방향족 아미노산]] |
||
== 각주 == |
== 각주 == |
||
{{각주 |
{{각주|30em|refs = |
||
<!--unused<ref name = "Gibbs_2007">{{cite journal | vauthors = Gibbs RA, Rogers J, Katze MG, Bumgarner R, Weinstock GM, Mardis ER, Remington KA, Strausberg RL, Venter JC, Wilson RK, Batzer MA, Bustamante CD, Eichler EE, Hahn MW, Hardison RC, Makova KD, Miller W, Milosavljevic A, Palermo RE, Siepel A, Sikela JM, Attaway T, Bell S, Bernard KE, Buhay CJ, Chandrabose MN, Dao M, Davis C, Delehaunty KD, Ding Y, Dinh HH, Dugan-Rocha S, Fulton LA, Gabisi RA, Garner TT, Godfrey J, Hawes AC, Hernandez J, Hines S, Holder M, Hume J, Jhangiani SN, Joshi V, Khan ZM, Kirkness EF, Cree A, Fowler RG, Lee S, Lewis LR, Li Z, Liu YS, Moore SM, Muzny D, Nazareth LV, Ngo DN, Okwuonu GO, Pai G, Parker D, Paul HA, Pfannkoch C, Pohl CS, Rogers YH, Ruiz SJ, Sabo A, Santibanez J, Schneider BW, Smith SM, Sodergren E, Svatek AF, Utterback TR, Vattathil S, Warren W, White CS, Chinwalla AT, Feng Y, Halpern AL, Hillier LW, Huang X, Minx P, Nelson JO, Pepin KH, Qin X, Sutton GG, Venter E, Walenz BP, Wallis JW, Worley KC, Yang SP, Jones SM, Marra MA, Rocchi M, Schein JE, Baertsch R, Clarke L, Csürös M, Glasscock J, Harris RA, Havlak P, Jackson AR, Jiang H, Liu Y, Messina DN, Shen Y, Song HX, Wylie T, Zhang L, Birney E, Han K, Konkel MK, Lee J, Smit AF, Ullmer B, Wang H, Xing J, Burhans R, Cheng Z, Karro JE, Ma J, Raney B, She X, Cox MJ, Demuth JP, Dumas LJ, Han SG, Hopkins J, Karimpour-Fard A, Kim YH, Pollack JR, Vinar T, Addo-Quaye C, Degenhardt J, Denby A, Hubisz MJ, Indap A, Kosiol C, Lahn BT, Lawson HA, Marklein A, Nielsen R, Vallender EJ, Clark AG, Ferguson B, Hernandez RD, Hirani K, Kehrer-Sawatzki H, Kolb J, Patil S, Pu LL, Ren Y, Smith DG, Wheeler DA, Schenck I, Ball EV, Chen R, Cooper DN, Giardine B, Hsu F, Kent WJ, Lesk A, Nelson DL, O'brien WE, Prüfer K, Stenson PD, Wallace JC, Ke H, Liu XM, Wang P, Xiang AP, Yang F, Barber GP, Haussler D, Karolchik D, Kern AD, Kuhn RM, Smith KE, Zweig AS | display-authors = 6 | title = Evolutionary and biomedical insights from the rhesus macaque genome | journal = Science | volume = 316 | issue = 5822 | pages = 222–34 | date = April 2007 | pmid = 17431167 | doi = 10.1126/science.1139247 | bibcode = 2007Sci...316..222. | doi-access = free }}</ref>--> |
|||
}} |
|||
== 외부 링크 == |
== 외부 링크 == |
||
{{Commons category|L-Phenylalanine}} |
|||
{{위키공용분류}} |
|||
* [http://gmd.mpimp-golm.mpg.de/Spectrums/53729aa2-297a-4bc7-818b-be4515403113.aspx Phenylalanine mass spectrum] |
* [http://gmd.mpimp-golm.mpg.de/Spectrums/53729aa2-297a-4bc7-818b-be4515403113.aspx Phenylalanine mass spectrum] |
||
* [http://www.chemsynthesis.com/base/chemical-structure-453.html Phenylalanine at ChemSynthesis] |
* [http://www.chemsynthesis.com/base/chemical-structure-453.html Phenylalanine at ChemSynthesis] |
||
{{아미노산}} |
{{아미노산}} |
||
{{아미노산 대사 중간생성물들}} |
|||
{{방향족산}} |
|||
{{전거 통제}} |
|||
{{토막글|화학}} |
|||
[[분류:아미노산]] |
|||
[[분류:방향족 화합물]] |
|||
[[분류:필수 아미노산]] |
|||
[[분류:단백질성 아미노산]] |
[[분류:단백질성 아미노산]] |
||
[[분류:글루코스 생성성 아미노산]] |
[[분류:글루코스 생성성 아미노산]] |
||
[[분류:케톤체 생성성 아미노산]] |
[[분류:케톤체 생성성 아미노산]] |
||
[[분류:방향족 아미노산]] |
[[분류:방향족 아미노산]] |
||
[[분류:필수 아미노산]] |
|||
[[분류:엔케팔리네이스 저해제]] |
|||
[[분류:페닐 화합물]] |
[[분류:페닐 화합물]] |
||
[[분류:벤질 화합물]] |
|||
[[분류:도파민 수용체 작용제]] |
|||
[[분류:탄산무수화효소 활성화제]] |
|||
[[분류:모노아민 전구체]] |
|||
[[분류:축산물]] |
|||
2023년 4월 7일 (금) 09:43 판
 L-페닐알라닌의 골격 구조식
| |||
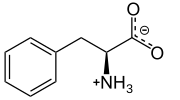 생리학적 pH에서의 L-페닐알라닌
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 발음 | US: /ˌfɛnəlˈæləniːn/, UK: /ˌfiːnaɪl-/ | ||
| IUPAC 이름
phenylalanine
| |||
| 체계명
(S)-2-amino-3-phenylpropanoic acid | |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider | |||
| DrugBank |
| ||
| ECHA InfoCard | 100.000.517 | ||
| |||
| KEGG |
| ||
PubChem CID
|
|||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C9H11NO2 | |||
| 몰 질량 | 165.192 g·mol−1 | ||
| 산성도 (pKa) | 1.83 (카복실기), 9.13 (아미노기)[2] | ||
| 위험 | |||
| NFPA 704 (파이어 다이아몬드) | |||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
페닐알라닌(영어: phenylalanine) (기호: Phe or F)[3]은 단백질의 생합성에 사용되는 α-아미노산이다. 페닐알라닌은 α-아미노기(생물학적 조건에서 양성자화된 −NH3+ 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 곁사슬인 벤질기를 포함하고 있다. 페닐알라닌은 곁사슬인 벤질기의 불활성 및 소수성으로 인해 중성 및 비극성으로 분류되는 방향족 아미노산이다. L-페닐알라닌은 DNA에 의해 암호화되는 단백질을 생화학적으로 생성하는 데 사용된다. 페닐알라닌은 티로신, 모노아민 신경전달물질인 도파민, 노르에피네프린(노르아드레날린), 에피네프린(아드레날린) 및 피부 색소인 멜라닌의 전구체이다. 페닐알라닌은 UUU, UUC 코돈에 의해 암호화되어 있다.
페닐알라닌은 포유류의 젖에서 자연적으로 발견된다. 페닐알라닌은 식품 및 음료의 제조에 사용되며, 진통 및 항우울 효과를 위한 영양 보충제로 판매된다. 페닐알라닌은 일반적으로 사용되는 식이 보충제로 신경조절물질인 펜에틸아민의 직접적인 전구체이다. 필수 아미노산인 페닐알라닌은 페닐알라닌이나 페닐알라닌 함유 단백질을 섭취해야 하는 사람과 다른 동물들에서 신생합성되지 않는다.
역사
페닐알라닌에 대한 최초의 설명은 1879년에 에른스트 슐츠와 바르비에리(Barbieri)가 루피누스 루테우스(Lupinus luteus) 묘목에서 실험식이 C9H11NO2인 화합물을 확인했을 때 이루어졌다. 1882년에 에밀 에를렌마이어와 리프()는 페닐아세트알데하이드, 사이안화 수소 및 암모니아로부터 페닐알라닌을 최초로 합성했다.[4][5]
페닐알라닌의 코돈은 1961년에 요하네스 하인리히 마테이와 마셜 워런 니런버그에 의해 처음으로 발견되었다. 그들은 mRNA를 사용하여 대장균의 게놈에 유라실 염기를 반복적으로 삽입함으로써 대장균이 반복되는 페닐알라닌으로만 구성된 폴리펩타이드를 생성하도록 할 수 있음을 보여주었다. 이러한 발견은 게놈에 저장된 정보와 살아 있는 세포에서의 단백질 발현을 연결하는 암호화 관계의 본질을 확립하는 데 도움이 되었다.
식이 공급원
페닐알라닌의 좋은 식이 공급원으로는 계란, 닭고기, 간, 쇠고기, 우유 및 콩이 있다.[6] 페닐알라닌의 또 다른 일반적인 공급원으로는 다이어트 음료, 다이어트 식품, 약물과 같은 인공 감미료인 아스파르탐으로 단맛을 낸 모든 것들이 있다. 아스파르탐의 대사로 인해 화합물의 대사 산물 중 하나인 페닐알라닌이 생성된다.[7]
식이 권장사항
미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다.19세 이상의 성인의 경우 매일 체중 1 kg당 33 mg의 페닐알라닌 및 티로신이 필요하다.[8]
기타 생물학적 역할
L-페닐알라닌은 생물학적으로 DNA에 의해 암호화되는 아미노산 중 하나인 L-티로신으로 전환된다. L-티로신은 차례로 L-도파로 전환되고, 이는 추가적으로 도파민, 노르에피네프린(노르아드레날린) 및 에피네프린(아드레날린)으로 전환된다. 후자의 세 가지 화합물은 카테콜아민으로 알려져 있다.
페닐알라닌은 트립토판과 동일한 능동 수송 운반체를 사용하여 혈액뇌장벽을 통과한다. 과량의 보충은 관련 보조 인자, 철 또는 테트라하이드로비오프테린의 남용(결국 제한된 가용성)으로 인해 세로토닌 및 다른 방향족 아미노산[9] 및 산화 질소의 생성을 방해할 수 있다. 이들 화합물에 상응하는 효소는 방향족 아미노산 하이드록실화효소 계열과 산화 질소 생성효소이다.
 |
식물에서
페닐알라닌은 플라보노이드의 생합성에 사용되는 출발 물질이다. 리그난은 페닐알라닌과 티로신으로부터 유도된다. 페닐알라닌은 페닐알라닌 암모니아-분해효소에 의해 신남산으로 전환된다.[10]
생합성
페닐알라닌은 시킴산 경로를 통해 생합성된다.
페닐케톤뇨증
유전 질환인 페닐케톤뇨증(PKU)은 페닐알라닌 하이드록실화효소의 결핍으로 인해 페닐알라닌을 대사할 수 없는 질환이다. 이러한 증상은 페닐케톤뇨증으로 알려져 있으며, 페닐알라닌의 섭취를 조절해야 한다. 페닐케톤뇨증에 대해서는 보통 혈액 검사를 통해 혈액 내의 페닐알라닌의 양을 모니터링한다. 검사 결과는 mg/dL 및 μmol/L를 사용하여 페닐알라닌의 수치를 보고할 수 있다. 페닐알라닌 1 mg/dL은 대략 60 μmol/L에 해당한다.
고페닐알라닌혈증이라고 하는 페닐케톤뇨증의 (희귀한) 변형은 보충될 수 있는 테트라하이드로비오프테린이라는 보조 인자를 합성할 수 없기 때문에 발생한다. 고페닐알라닌혈증이 있는 임산부는 장애와 유사한 증상(혈액 내 페닐알라닌의 수치가 높음)을 보일 수 있지만, 이러한 지표는 일반적으로 임신 말기에 사라진다. 페닐케톤뇨증이 있는 임산부는 태아가 질환 유전자에 대해 이형접합성인 경우에도 간의 미성숙으로 인해 태아에 악영향을 미칠 수 있으므로 혈중 페닐알라닌의 수치를 조절해야 한다.
페닐알라닌의 비식품 공급원으로는 인공 감미료인 아스파르탐이 있다. 이 화합물은 신체에서 페닐알라닌을 포함한 여러 화학적 부산물로 대체된다. 페닐케톤뇨증에서 체내에 페닐알라닌이 축적될 때 발생하는 문제는 아스파르탐을 섭취시에도 발생하지만 그 정도가 덜하다. 오스트레일리아, 미국, 캐나다에서 아스파르탐을 함유하고 있는 모든 제품에는 "페닐케톤뇨제: 페닐알라닌 함유"라는 문구가 붙어있어야 한다. 영국에서 아스파르탐을 함유하고 있는 식품은 "아스파르탐 또는 E951"의 존재를 나타내는 성분표를 표시해야 하며[11] "페닐알라닌 공급원을 함유함"이라는 경고 문구를 부착해야 한다. 브라질에서는 페닐알라닌이 포함된 제품에 "페닐알라닌 함유"라는 문구가 의무적으로 표시된다. 이러한 경고문은 사람들이 이러한 식품을 피하는 데 도움을 준다.
D-페닐알라닌, L-페닐알라닌 및 DL-페닐알라닌
입체 이성질체인 D-페닐알라닌은 단일 거울상 이성질체 또는 라세미 혼합물의 성분으로서 통상적인 유기 합성에 의해 생성될 수 있다. D-페닐알라닌은 소량의 단백질, 특히 노화된 단백질 및 가공된 식품 단백질에서 발견되지만 단백질 생합성에서는 참여하지 않는다. D-페닐알라닌이 니아신 수용체 2에 대해 약리학적 활성을 가지고 있지만, D-아미노산의 생물학적 기능은 불분명하다.[12]
DL-페닐알라닌은 진통 및 항우울 활성을 위한 식이 보충제로 판매된다.[13][14][15] DL-페닐알라닌은 D-페닐알라닌과 L-페닐알라닌의 혼합물이다. DL-페닐알라닌의 유명한 진통 활성은 카복시펩티데이스 A에 의한 D-페닐알라닌의 엔케팔린 분해에 의한 차단 가능성으로 설명될 수 있다.[16][17] DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 신경전달물질인 노르에피네프린과 도파민의 합성에서 L-페닐알라닌의 전구체 역할에 의해 설명될 수 있다. 엔케팔린은 뮤 및 델타 오피오이드 수용체의 작용제로 작용하며, 이러한 수용체의 작용제는 항우울 효과를 나타내는 것으로 알려져 있다.[18] DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 신경전달물질인 노르에피네프린과 도파민의 합성에서 L-페닐알라닌의 전구체 역할에 의해 설명될 수 있으나 임상 시험에서 L-페닐알라닌 단독으로는 항우울 효과를 발견하지 못했다.[13] 뇌에서 노르에피네프린과 도파민의 수치 증가는 항우울 효과를 가지는 것으로 생각된다. D-페닐알라닌은 소장에서 흡수되어 문맥 순환을 통해 간으로 운반된다. 소량의 D-페닐알라닌이 L-페닐알라닌으로 전환되는 것으로 보인다. D-페닐알라닌은 전신 순환을 통해 신체의 다양한 조직에 분포될 수 있다. D-페닐알라닌은 L-페닐알라닌보다 혈액뇌장벽을 덜 효율적으로 통과하는 것으로 보이며, 섭취한 소량의 D-페닐알라닌은 중추신경계를 통하지 않고 소변으로 배설된다.[19]
L-페닐알라닌은 Ki가 980 nM인 α2δ Ca2+ 칼슘 통로에서 길항제이다.[20]
뇌에서 L-페닐알라닌은 NMDA 수용체의 글리신 결합 부위와[21] AMPA 수용체의 글루탐산 결합 부위에서 경쟁적 길항제이다.[22] NMDA 수용체의 글리신 결합 부위에서 L-페닐알라닌은 실트 회귀에 의해 추정된 573 μM의 겉보기 평형 해리 상수(KB)를 가지며,[23] 이는 치료되지 않은 사람의 페닐케톤뇨증에서 관찰된 뇌의 L-페닐알라닌의 농도보다 상당히 낮다.[24] L-페닐알라닌은 또한 고전적인 페닐케톤뇨증에서 볼 수 있는 뇌에서의 농도인 980 μM의 IC50으로 해마와 대뇌 피질의 글루탐산작동성 시냅스에서 신경전달물질의 방출을 억제하는 반면, D-페닐알라닌은 이에 대한 효과가 훨씬 더 작다.[22]
상업적 합성
L-페닐알라닌은 페닐알라닌과 같은 방향족 아미노산을 자연적으로 생성하는 대장균을 이용하여 의료용, 사료용 및 아스파르탐과 같은 영양학적 용도로 대량 생산된다. 상업적으로 생산되는 L-페닐알라닌의 양은 조절 프로모터를 변경하거나 아미노산 합성을 담당하는 효소를 조절하는 유전자의 수를 증폭하는 것과 같이 대장균을 유전적으로 조작함으로써 증가될 수 있다.[25]
유도체
보로노페닐알라닌(BPA)은 중성자 포획요법에서 사용되는 페닐알라닌의 다이하이드록시보릴 유도체이다.
4-아지도-L-페닐알라닌은 화학생물학에서 생체접합을 위한 도구로 사용되는 단백질을 구성하는 비천연 아미노산이다.
같이 보기
각주
- ↑ 가 나 Ihlefeldt, Franziska Stefanie; Pettersen, Fredrik Bjarte; von Bonin, Aidan; Zawadzka, Malgorzata; Görbitz, Prof. Carl Henrik (2014). “The Polymorphs of L‐Phenylalanine”. 《Angew. Chem. Int. Ed.》 53 (49): 13600–13604. doi:10.1002/anie.201406886. PMID 25336255.
- ↑ Dawson RM, 외. (1959). 《Data for Biochemical Research》. Oxford: Clarendon Press.
- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ Thorpe TE (1913). 《A Dictionary of Applied Chemistry》. Longmans, Green, and Co. 191–193쪽. 2012년 6월 4일에 확인함.
- ↑ Plimmer RH (1912) [1908]. Plimmer RH, Hopkins FG, 편집. 《The Chemical Composition of the Proteins》. Monographs on Biochemistry. Part I. Analysis 2판. London: Longmans, Green and Co. 93–97쪽. 2012년 6월 4일에 확인함.
- ↑ Ross, Harvey M.; Roth, June (1991년 4월 1일). 《The Mood Control Diet: 21 Days to Conquering Depression and Fatigue》. Simon & Schuster. 59쪽. ISBN 978-0-13-590449-7.
- ↑ Zeratsky, Katherine. “Phenylalanine in diet soda: Is it harmful?”. 《Mayo Clinic》. 2019년 4월 30일에 확인함.
- ↑ Institute of Medicine (2002). 〈Protein and Amino Acids〉. 《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ↑ Eriksson, Johan G; Guzzardi, Maria-Angela; Iozzo, Patricia; Kajantie, Eero; Kautiainen, Hannu; Salonen, Minna K (2017년 1월 1일). “Higher serum phenylalanine concentration is associated with more rapid telomere shortening in men”. 《The American Journal of Clinical Nutrition》 105 (1): 144–150. doi:10.3945/ajcn.116.130468. ISSN 0002-9165. PMID 27881392.
- ↑ Nelson DL, Cox MM (2000). 《Lehninger, Principles of Biochemistry》 3판. New York: Worth Publishing. ISBN 1-57259-153-6.
- ↑ “Aspartame”. UK: Food Standards Agency. 2012년 2월 21일에 원본 문서에서 보존된 문서. 2007년 6월 19일에 확인함.
- ↑ “D-phenylalanine: Biological activity”. 《The IUPHAR/BPS Guide to PHARMACOLOGY》. 2018년 12월 27일에 확인함.
- ↑ 가 나 Wood, David R.; Reimherr, Fred W.; Wender, Paul H. (1985). “Treatment of attention deficit disorder with DL-phenylalanine”. 《Psychiatry Research》 (Elsevier BV) 16 (1): 21–26. doi:10.1016/0165-1781(85)90024-1. ISSN 0165-1781.
- ↑ Beckmann, H.; Strauss, M. A.; Ludolph, E. (1977). “Dl-phenylalanine in depressed patients: An open study”. 《Journal of Neural Transmission》 (Springer Science and Business Media LLC) 41 (2-3): 123–134. doi:10.1007/bf01670277. ISSN 0300-9564.
- ↑ Beckmann, Helmut; Athen, Dieter; Olteanu, Margit; Zimmer, Reinhild (1979). “dl-Phenylalanine versus imipramine: A double-blind controlled study”. 《Archiv für Psychiatrie und Nervenkrankheiten》 (Springer Science and Business Media LLC) 227 (1): 49–58. doi:10.1007/bf00585677. ISSN 0003-9373.
- ↑ “D-phenylalanine: Clinical data”. 《The IUPHAR/BPS Guide to PHARMACOLOGY》. 2018년 12월 27일에 확인함.
- ↑ Christianson DW, Mangani S, Shoham G, Lipscomb WN (August 1989). “Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A” (PDF). 《The Journal of Biological Chemistry》 264 (22): 12849–53. doi:10.1016/S0021-9258(18)51564-7. PMID 2568989.
- ↑ Jelen, Luke A.; Stone, James M.; Young, Allan H.; Mehta, Mitul A. (2022). “The opioid system in depression”. 《Neuroscience & Biobehavioral Reviews》 (Elsevier BV) 140: 104800. doi:10.1016/j.neubiorev.2022.104800. ISSN 0149-7634.
- ↑ Lehmann, W. D.; Theobald, N.; Fischer, R.; Heinrich, H. C. (1983년 3월 14일). “Stereospecificity of phenylalanine plasma kinetics and hydroxylation in man following oral application of a stable isotope-labelled pseudo-racemic mixture of L- and D-phenylalanine”. 《Clinica Chimica Acta; International Journal of Clinical Chemistry》 128 (2–3): 181–198. doi:10.1016/0009-8981(83)90319-4. ISSN 0009-8981. PMID 6851137.
- ↑ Mortell KH, Anderson DJ, Lynch JJ, Nelson SL, Sarris K, McDonald H, Sabet R, Baker S, Honore P, Lee CH, Jarvis MF, Gopalakrishnan M (March 2006). “Structure-activity relationships of alpha-amino acid ligands for the alpha2delta subunit of voltage-gated calcium channels”. 《Bioorganic & Medicinal Chemistry Letters》 16 (5): 1138–41. doi:10.1016/j.bmcl.2005.11.108. PMID 16380257.
- ↑ Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, Martynyuk AE (2002). “Specific inhibition of N-methyl-D-aspartate receptor function in rat hippocampal neurons by L-phenylalanine at concentrations observed during phenylketonuria”. 《Molecular Psychiatry》 7 (4): 359–67. doi:10.1038/sj.mp.4000976. PMID 11986979.
- ↑ 가 나 Glushakov AV, Dennis DM, Sumners C, Seubert CN, Martynyuk AE (April 2003). “L-phenylalanine selectively depresses currents at glutamatergic excitatory synapses”. 《Journal of Neuroscience Research》 72 (1): 116–24. doi:10.1002/jnr.10569. PMID 12645085. S2CID 42087834.
- ↑ Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, Embury JE, Baker SP, Otero DH, Dennis DM, Seubert CN, Martynyuk AE (February 2005). “Long-term changes in glutamatergic synaptic transmission in phenylketonuria”. 《Brain》 128 (Pt 2): 300–7. doi:10.1093/brain/awh354. PMID 15634735.
- ↑ Möller HE, Weglage J, Bick U, Wiedermann D, Feldmann R, Ullrich K (December 2003). “Brain imaging and proton magnetic resonance spectroscopy in patients with phenylketonuria”. 《Pediatrics》 112 (6 Pt 2): 1580–3. doi:10.1542/peds.112.S4.1580. hdl:11858/00-001M-0000-0010-A24A-C. PMID 14654669. S2CID 2198040.
- ↑ Sprenger, G. A. (2007). 〈Aromatic Amino Acids〉. 《Amino Acid Biosynthesis: Pathways, Regulation and Metabolic Engineering》 1판. Springer. 106–113쪽. ISBN 978-3-540-48595-7.