수산화 나트륨

| |

| |
| 이름 | |
|---|---|
| 우선명 (PIN)
Sodium hydroxide[3] | |
| 체계명
Sodium oxidanide[4] | |
| 별칭 | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.013.805 |
| EC 번호 |
|
| E 번호 | E524 (산도 조절제, ...) |
| 68430 | |
| KEGG | |
| MeSH | Sodium+Hydroxide |
PubChem CID
|
|
| RTECS 번호 |
|
| UNII | |
| UN 번호 | 1824, 1823 |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| NaOH | |
| 몰 질량 | 39.9971 g mol−1 |
| 겉보기 | White, waxy, opaque crystals |
| 냄새 | odorless |
| 밀도 | 2.13 g/cm3[5] |
| 녹는점 | 323 °C (613 °F; 596 K)[5] |
| 끓는점 | 1,388 °C (2,530 °F; 1,661 K)[5] |
| 418 g/L (0 °C) 1000 g/L (25 °C)[5] 3370 g/L (100 °C) | |
| 용해도 | soluble in glycerol negligible in ammonia insoluble in ether slowly soluble in propylene glycol |
| methanol에서의 용해도 | 238 g/L |
| ethanol에서의 용해도 | <<139 g/L |
| 증기 압력 | <2.4 kPa (at 20 °C) |
| 염기도 (pKb) | -0.56 (NaOH(aq) = Na+ + OH–)[6] |
자화율 (χ)
|
−15.8·10−6 cm3/mol (aq.)[7] |
굴절률 (nD)
|
1.3576 |
| 구조[8] | |
| Orthorhombic, oS8 | |
| Cmcm, No. 63 | |
a = 0.34013 nm, b = 1.1378 nm, c = 0.33984 nm
| |
단위 세포 화학식 (Z)
|
4 |
| 열화학[9] | |
열용량 (C)
|
59.5 J/mol K |
표준 몰 엔트로피 (S
|
64.4 J·mol−1·K−1 |
표준 생성 엔탈피 (ΔfH⦵298)
|
−425.8 kJ·mol−1 |
기브스 자유 에너지 (ΔfG˚)
|
-379.7 kJ/mol |
| 위험 | |
| 물질 안전 보건 자료 | External SDS |
| GHS 그림문자 | 
|
| 신호어 | 위험 |
| H290, H314 | |
| P280, P305+351+338, P310 | |
| NFPA 704 (파이어 다이아몬드) | |
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |
LD50 (median dose)
|
40 mg/kg (mouse, intraperitoneal)[11] |
LDLo (lowest published)
|
500 mg/kg (rabbit, oral)[12] |
| NIOSH (미국 건강 노출 한계): | |
PEL (허용)
|
TWA 2 mg/m3[10] |
REL (권장)
|
C 2 mg/m3[10] |
IDLH (직접적 위험)
|
10 mg/m3[10] |
| 관련 화합물 | |
다른 음이온
|
Sodium hydrosulfide |
다른 양이온
|
Caesium hydroxide Lithium hydroxide |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
수산화 나트륨(水酸化─ , 화학식 : NaOH)은 물에 녹아 강염기성 수용액을 만든다. 식음료, 치약, 비누 등의 산업에서 널리 사용된다. 1998년에 세계적으로 4500만톤이 생산되었다. 화학 실험에서 가장 널리 사용되는 염기이며, 산업계에서는 흔히 가성소다라고 일컫는다.
순수한 수산화 나트륨은 대기 중에서 수증기와 이산화 탄소를 잘 흡수한다. 온도에 무관하게 물에 잘 녹으며 이 때 많은 열이 발생한다. 수산화 칼륨은 잘 녹지 않는 에탄올과 메탄올에도 녹는다. 에테르나 다른 무극성 용매에는 녹일 수 없다. 수산화 나트륨 수용액은 섬유와 종이에 노란색 얼룩을 남긴다.
제조
[편집]- 2Na+ + 2H2O + 2e− → H2 + 2NaOH
용도
[편집]바이오디젤
[편집]바이오디젤을 생산할 때 수산화 나트륨은 교환반응의 촉매로 사용된다. 물과 지방은 비누화반응을 일으키기 때문에 무수수산화나트륨만 이용할 수 있다. 더 싸고 적은 양이 필요하기 때문에 수산화 칼륨에 비해 자주 쓰인다.
마약 제조
[편집]수산화 나트륨은 메스암페타민이나 다른 마약을 제조하는 데 필수적인 물질이다. 언론에 널리 알려진 것과 다르게 이것은 제조 원료로서 들어가는 것은 아니며 단지 화학 반응상 pH를 조절하기 위한 강염기로 사용되는 것이다.
산분해간장 제조
[편집]탈지대두에 염산을 섞어 고온에서 가수분해하여 아미노산을 생성시킨 뒤 수산화 나트륨으로 중화시키고 여과 및 정제를 거쳐 간장을 제조한다.
안전성
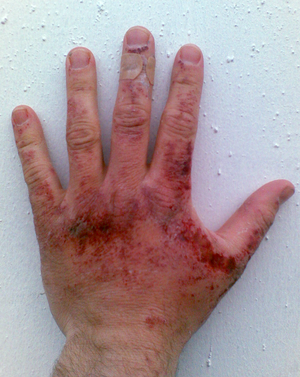
[편집]수산화나트륨은 일상생활에서 중요한 계면활성제인 비누의 주요한 성분이다.[13] 그러나 고체 수산화 나트륨이나 고농도의 수산화 나트륨 수용액은 피부에 심각한 수준의 화학적 화상을 유발할 수 있으며 영구적인 상흔이나 실명 등 인체에 부정적인 영향을 끼칠 수 있다.
알루미늄과 수산화 나트륨은 많은 수소 기체를 발생시킨다.
밀폐된 공간에서 수소 기체를 대량으로 발생시킬 경우 위험하다.
|
| 예시 |
전기분해
[편집]소금물의 전기분해(electrolysis)
염화나트륨 수용액을 전기분해하면 음극에서 수소 기체, 양극에서 염소 기체가 나온다. 그리고 남은 용액을 증발시키면 수산화나트륨을 얻게 된다.
같이 보기
[편집]각주
[편집]- ↑ “Material Safety Datasheet” (PDF). 《certified-lye.com》.
- ↑ “Material Safety Datasheet 2” (PDF). 《hillbrothers.com》. 2012년 8월 3일에 원본 문서 (PDF)에서 보존된 문서. 2012년 5월 20일에 확인함.
- ↑ 가 나 “Sodium Hydroxide – Compound Summary”. 2012년 6월 12일에 확인함.
- ↑ "1310-73-2|Sodium hydroxide solution|Sigma Aldrich|sodium oxidanide" Archived 2018년 1월 27일 - 웨이백 머신. chembase.cn.
- ↑ 가 나 다 라 Haynes, p. 4.90
- ↑ “Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. – Das Periodensystem online”.
- ↑ Haynes, p. 4.135
- ↑ Jacobs, H.; Kockelkorn, J. and Tacke, Th. (1985). “Hydroxide des Natriums, Kaliums und Rubidiums: Einkristallzüchtung und röntgenographische Strukturbestimmung an der bei Raumtemperatur stabilen Modifikation”. 《Z. Anorg. Allg. Chem.》 531: 119–124. doi:10.1002/zaac.19855311217.
- ↑ Haynes, p. 5.13
- ↑ 가 나 다 NIOSH Pocket Guide to Chemical Hazards. “#0565”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ Michael Chambers. "ChemIDplus – 1310-73-2 – HEMHJVSKTPXQMS-UHFFFAOYSA-M – Sodium hydroxide [NF] – Similar structures search, synonyms, formulas, resource links, and other chemical information.". nih.gov.
- ↑ “Sodium hydroxide”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ [참고](북한과학기술네트워크-북, 비누 원료 조달 위해 수산화나트륨 제조 신공법 개발)http://www.nktech.net/inform/nkt_briefing/nkt_briefing_v.jsp?record_no=331
- [참고](한화솔루션-케미칼_테크/캐스트-소금으로 PVC 파이프를 만든다?)https://www.chemidream.com/2653
- [참고](화학공학소재연구정보센터- 저에너지형 염수 전기분해 공정 (Chlor-alkali process) 연계 CO2 자원화 기술: 기술·경제성·환경성 분석 및 Biz. 모델 제안 -이지현1, 이동욱2 한전 전력연구원 기후환경연구소)https://www.cheric.org/PDF/NICE/NI37/NI37-1-0074.pdf
외부 링크
[편집]| 이 글은 화학에 관한 토막글입니다. 여러분의 지식으로 알차게 문서를 완성해 갑시다. |

