급성 림프모구 백혈병
 | |
|---|---|
| 다른 이름 | 급성 림프구성 백혈병, 급성 림프성 백혈병 |
 | |
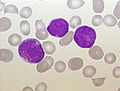
| B세포 전구세포 ALL 환자의 골수 흡인 도말 표본. 큰 보라색 세포는 림프모세포이다. | |
| 진료과 | 혈액학, 종양학 |
| 증상 | 피곤함, 창백한 피부, 발열, 쉽게 출혈 또는 멍이 들거나 뼈 통증, 림프절 비대[1] |
| 합병증 | 감염, 종양 용해 증후군[2][3] |
| 통상적 발병 시기 | 2~5세에서 호발[4] |
| 유형 | B세포, T세포[2] |
| 병인 | 알 수 없음[5] |
| 위험 인자 | ALL이 발병한 일란성 쌍둥이, 다운 증후군, 판코니 빈혈, 운동 실조증, 클라인펠터 증후군, 고체중아, 심각한 방사선 노출[5][6][1] |
| 진단 방식 | 혈액검사와 골수검사[3] |
| 유사 질병 | 전염성 단핵구증, 급성 골수성 백혈병, 림프모구성 림프종, 재생불량성 빈혈[3] |
| 치료 | 화학요법, 조혈모세포 이식, 방사선 요법, 표적 치료[7][1] |
| 예후 | 아동: 90% (5년 생존율)[2] 성인: 35% (5년 생존율)[8] |
| 빈도 | 1,750명 중 1명 (아동)[4][9] |
| 사망 | 111,000 (2015)[10] |
급성 림프모구 백혈병(acute lymphoblastic leukemia, ALL)은 백혈병의 한 형태로, 미성숙한 림프구가 과도하게 발생하는 혈액암이다.[1] 증상으로는 피로, 창백한 피부색, 발열, 쉽게 출혈하거나 멍이 들거나 림프절 비대, 뼈 통증 등이 있다.[1] 급성 림프모구 백혈병은 급속하게 진행되며 치료하지 않으면 일반적으로 수주 또는 수개월 내에 사망에 이를 수 있다.[11]
대부분의 경우 원인을 알 수 없다.[2] 유전적 위험 요인으로는 다운증후군, 리-프라우메니 증후군, 신경섬유종증 1형 등이 있을 수 있다.[1] 환경적 위험 요인으로는 심각한 방사선 노출이나 이전 화학 요법이 포함될 수 있다.[1] 전자기장이나 살충제에 관한 증거는 불분명하다.[4][5] 일부에서는 일반적인 감염에 대한 비정상적인 면역 반응이 유발 요인일 수 있다는 가설을 제시하기도 한다.[4] 근본적인 메커니즘은 여러 유전자 돌연변이가 초래하는 과도한 세포 분열과 관련되어 있다.[2] 골수에서 과도하게 생성된 미성숙한 림프구가 정상적인 적혈구, 백혈구 그리고 혈소판의 생성을 방해한다.[1] 진단은 보통 혈액 검사와 골수 검사를 바탕으로 급성 림프모구 백혈병인 것으로 판단한다.[3]
급성 림프모구 백혈병은 일반적으로 관해를 목표로 하는 화학 요법으로 초기에 치료한다.[2] 그 후 일반적으로 수년에 걸쳐 추가 화학 요법이 이어진다.[2] 전신 화학 요법은 중추 신경계로의 침투가 제한될 수 있고 중추 신경계는 급성 림프모구 백혈병이 재발하는 흔한 부위이므로 치료에는 일반적으로 척수강 내 화학 요법도 포함된다.[12][13]
뇌로 전이된 경우 방사선 요법도 치료에 포함될 수 있다.[2] 표준 치료 후 질병이 재발하는 경우 줄기세포 이식이 사용될 수 있다. 키메라 항원 수용체 T세포 면역 요법과 같은 추가 치료법이 사용되고 있으며, 추가 연구가 진행 중이다.[2]
급성 림프모구 백혈병은 2015년에 전 세계적으로 약 876,000명이 걸렸고 약 111,000명이 사망했다.[14][10] 특히 2세에서 5세 사이의 어린이에게 가장 흔하게 발생한다.[15][4] 미국에서는 어린이 암 발병 및 암으로 인한 사망의 가장 흔한 원인이다.[2] 급성 림프모구 백혈병은 최초로 완치된 파종성 암으로 유명한다.[16] 1960년대 10% 미만이었던 어린이 생존율은 2015년 90%까지 증가했다.[2] 영아(50%)[17] 및 성인(35%)[8]의 생존율은 여전히 낮다.
징후 및 증상[편집]
초기 증상은 특히 어린이의 경우 비특이적일 수 있다. 백혈병에 걸린 소아의 50% 이상이 간 만져짐(64%), 비장 만져짐(61%), 창백한 안색(54%), 발열(53%), 멍(52%) 등 5가지 특징 중 하나 이상을 경험한다.[18] 또한 반복되는 감염, 피로감, 팔 또는 다리 통증, 림프절 비대가 두드러진 특징으로 나타난다. 발열, 식은땀, 체중 감소와 같은 B형 증상도 종종 나타난다.[19]
뇌수막 침윤으로 인한 뇌신경병증과 같은 중추신경계(CNS) 증상은 성인의 10% 미만, 소아의 5% 미만에서 확인되며, 특히 발견 시점에 성숙한 B세포 급성 림프모구 백혈병(버킷 백혈병)이 확인된다.[20]
급성 림프모구 백혈병의 징후와 증상은 다양하며 다음과 같다[21]
- 전신 쇠약 및 피로감
- 빈혈
- 현기증
- 두통, 구토, 무기력, 목 경직[22] 또는 뇌신경 마비[23](CNS 관련)
- 잦거나 설명할 수 없는 발열 및 감염
- 체중 감소 혹은 식욕 부진
- 과도하고 설명할 수 없는 멍이 있다.
- 뼈 통증, 관절 통증(골수강에서 뼈 표면이나 관절로 모세포가 퍼져서 발생)
- 숨가쁨
- 림프절, 간 혹은 비장 비대
- 하지 또는 복부의 움푹 패인 부종(부기)
- 낮은 혈소판 수치로 인해 피부에 작은 붉은 반점이나 선이 생기는 점상 출혈
- 고환 확대
- 종격동 종괴
원인[편집]

급성 림프모구 백혈병에서는 림프구 세포의 발달이 림프모세포(화살표)에서 멈추며, 이 림프모세포도 과잉 생산된다. 급성 림프모구 백혈병 의 암세포는 림프모세포이다. 정상적인 림프 모세포는 감염과 싸우는 성숙한 B세포 또는 T세포로 발전한다. 림프구가 너무 적거나 많지 않도록 체내 신호가 림프구 수를 조절한다. 급성 림프모구 백혈병 에서는 일부 림프구의 정상적인 발달과 림프구 수 조절에 모두 결함이 생긴다.[4][24]
급성 림프모구 백혈병은 하나의 림프모세포가 혈액 세포 발달과 증식에 영향을 미치는 유전자에 많은 돌연변이를 일으킬 때 발생한다. 소아 급성 골수성 백혈병의 경우, 이 과정은 임신과 함께 이러한 유전자 중 일부의 유전으로 시작된다. 이러한 유전자는 림프구 세포가 발달할 때 더 많은 돌연변이가 발생할 위험을 증가시킨다. 다운 증후군과 같은 특정 유전 증후군도 같은 영향을 미친다. 질병을 유발할 수 있는 충분한 유전적 돌연변이를 생성하려면 환경적 위험 요인도 필요하다. 환경의 역할에 대한 증거는 유전적으로 동일한 일란성 쌍둥이 중 10~15%만이 급성 림프모구 백혈병에 걸리는 예시에서 볼 수 있다. 쌍둥이는 동일한 유전자를 가지고 있기 때문에, 서로 다른 환경 노출에 의해 한 쌍둥이는 급성 림프모구 백혈병에 걸리고 다른 한 쌍둥이는 걸리지 않는 이유를 설명할 수 있다.[4]
영아 급성 림프모구 백혈병은 1세 미만의 아기에게 발생하는 희귀한 변종이다. 원인으로는 KMT2A(이전의 MLL) 유전자 재배열이 가장 흔하며 출생 전 배아 또는 태아에서 발생한다.[4] 이러한 재배열은 유전자 전사를 촉진하고 후성유전학적 변화를 통해 혈액 세포 발달 유전자의 발현을 증가시킨다.[25][26] 소아기 급성 림프모구 백혈병과는 달리 환경적 요인이 중요한 역할을 하는 것으로 생각되지 않는다. KMT2A 재배열을 제외하고는 일반적으로 단 하나의 추가 돌연변이만 발견된다.[4] 환경 노출이 추가적인 돌연변이를 일으키는 것은 아니다.
위험 요소[편집]
유전적[편집]
흔한 유전적 위험 요인으로는 ARID5B, CDKN2A/2B, CEBPE, IKZF1, GATA3, PIP4K2A, 그리고 드물게 TP53의 돌연변이가 있다. 이러한 유전자는 세포 발달, 증식 및 분화에 중요한 역할을 한다.[5][4][2] 개별적으로 이러한 돌연변이의 대부분은 급성 림프모구 백혈병의 위험이 낮다. 이러한 돌연변이 중 여러 개를 함께 물려받으면 질병의 위험이 크게 높아진다.[4]
유전적 위험 요인의 고르지 않은 분포는 인종 그룹 간 질병 발생률의 차이를 설명하는 데 도움이 될 수 있다. 예를 들어, ARID5B 돌연변이는 아프리카 민족 집단에서 덜 흔하다.[4]
몇몇 유전적 증후군도 급성 림프모구 백혈병의 위험을 증가시킨다. 여기에는 다운 증후군, 판코니 빈혈, 블룸 증후군, X-연관 무감마글로불린혈증, 중증 복합 면역 결핍증, 슈와크만-다이아몬드 증후군, 코스트만 증후군, 신경섬유종증 1형, 운동 실조증-모세혈관확장증, 발작성 야간 혈색소뇨증, 리-프라우메니 증후군 등이 이에 해당한다. 5% 미만의 사례만이 알려진 유전적 증후군과 관련이 있다.[8]
ETV6 와 PAX5의 희귀 돌연변이는 상염색체 우성 유전 패턴을 가진 가족성 형태의 급성 림프모구 백혈병과 관련이 있다.[2]
환경[편집]
급성 림프모구 백혈병의 출현에 기여하는 환경 노출은 논쟁의 여지가 있으며, 지속적으로 논의되고 있는 대상이다.[5][4]
핵 낙진으로 인한 높은 수준의 방사선 노출은 백혈병 발병의 위험 요인으로 알려져 있다. 임신 중 엑스레이 촬영과 같이 적은 양의 방사선이 질병의 위험을 증가시키는지에 대한 증거는 아직 확실하지 않다.[5] 임신 중 엑스레이 촬영과 급성 림프모구 백혈병 사이의 연관성을 확인한 연구에서는 위험이 매우 작게 증가하는 것으로 나타났다.[4] 송전선에서 나오는 강한 전자기 방사선에 노출되는 것도 급성 림프모구 백혈병의 위험을 아주 약간 증가시킬 수 있다. 이 결과는 전자기 방사선과 암을 연결하는 인과 메커니즘이 알려지지 않았기 때문에 결과에 의문이 제기되고 있다.[5][4]
고체중아(4,000g 또는 8.8파운드 이상)도 위험 증가와 약간 관련이 있다. 저체중 출생과 급성 림프모구 백혈병을 연결하는 메커니즘은 아직 밝혀지지 않았다.[5]
에피포도필로톡신 및 사이클로포스파미드와 같은 특정 유형의 화학 요법으로 치료받은 사람에게서 이차성 백혈병이 발생할 수 있다는 증거가 있다.[5][27]
감염[편집]
인플루엔자와 같은 일반적인 감염이 급성 림프모구 백혈병의 출현을 간접적으로 촉진할 수 있다는 증거가 일부 존재한다.[5][4] 감염 지연 가설에 따르면 급성 림프모구 백혈병은 유전적 위험 요인을 가진 사람의 감염에 대한 비정상적인 면역 반응으로 인해 발생한다고 한다. 제한된 질병 노출로 인해 면역 체계의 발달이 지연되면 질병이 발생하는 동안 림프구가 과도하게 생성되고 돌연변이 발생률이 높아질 수 있다. 여러 연구에 따르면 어릴 때 질병에 더 많이 노출된 어린이에게서 급성 림프모구 백혈병의 발병률이 더 낮은 것으로 나타났다. 탁아소에 다니는 아주 어린 아이들은 급성 림프모구 백혈병의 발병률이 더 낮다.[5] 질병 노출과 급성 림프모구 백혈병을 조사한 다른 많은 연구에서 나온 증거는 결정적이지 않다. 일부 연구자들은 위생 가설(hygiene hypothesis)을 제기하기도 했다.[28]
기전[편집]
몇 가지 특징적인 유전적 변화가 백혈병 림프 모세포의 생성으로 이어진다. 이러한 변화에는 염색체 전위, 염색체 내 재배열, 백혈병 세포의 염색체 수 변화, 개별 유전자의 추가 돌연변이 등이 포함된다.[29] 염색체 전위는 한 염색체에서 다른 염색체로 DNA의 넓은 영역을 이동하는 것을 포함한다. 이러한 이동은 세포 분열을 촉진하는 유전자를 한 염색체에서 다른 염색체의 더 활발하게 전사되는 영역으로 옮기는 결과를 일으킬 수 있다. 그 결과 세포가 더 자주 분열하게 된다. 예를 들어 면역글로불린의 중쇄(Heavy chain) 또는 경쇄(Light chain) 유전자 증폭자(Enhancer) 옆에 세포 분열을 증가시키는 전사인자를 암호화하는 유전자 C-MYC가 전위되어 C-MYC 발현이 증가하고 세포 분열이 증가하는 경우가 이에 해당한다.[29] 염색체 구조의 다른 큰 변화로 인해 두 유전자가 서로 바로 옆에 배치될 수도 있다. 그 결과 일반적으로 분리되어 있던 두 개의 단백질이 새로운 융합 단백질로 결합된다. 이 단백질은 암 발생을 촉진하는 새로운 기능을 가질 수 있다. 예를 들어, 혈액 세포 발달을 촉진하는 두 가지 인자를 결합하는 ETV6–RUNX1 융합 유전자와 필라델피아 염색체의 BCR-ABL1융합 유전자가 이에 해당한다. BCR-ABL1은 항상 활성화된 티로신 키나아제를 암호화하여 세포 분열을 빈번하게 일으킨다. 이러한 돌연변이는 성장 인자가 없는 경우에도 더 자주 분열하는 세포를 생성한다.[29][30]
B세포 급성 림프모구 백혈병의 다른 유전적 변화로는 백혈병 세포 내 염색체 수의 변화가 있다. 염색체가 5개 이상 추가되는 경우(고이배체라고 함)가 더 흔하게 발생한다. 드물게는 염색체가 손실되는 저이배체성이 발생하는데, 이는 예후가 좋지 않다. B세포 급성 림프모구 백혈병의 또 다른 일반적인 유전적 변화로는 PAX5와 IKZF1에 대한 비유전성 돌연변이가 있다.[29] T세포 급성 림프모구 백혈병에서는 LYL1, TAL1, TLX1, TLX3 재배열이 발생할 수 있다.[30]
급성 림프모구 백혈병은 이러한 유전적 변화가 단일 림프모세포에 충분히 존재할 때 발생한다. 예를 들어, 소아 급성 림프모구 백혈병에서는 하나의 융합 유전자 전좌와 함께 6~8개의 다른 급성 림프모구 백혈병 관련 유전적 변화가 발견되는 경우가 많다.[30] 초기 백혈병 림프 모세포는 과도한 수의 새로운 림프 모세포로 자신을 복제하며, 이 중 어느 것도 정상적으로 기능하는 림프구로 분화할 수 없다. 이러한 림프모세포는 골수에 축적되어 림프절, 종격동, 비장, 고환, 뇌 등 신체의 다른 부위로 퍼져 질병의 일반적인 증상을 유발할 수 있다.[29]
진단[편집]
급성 림프모구 백혈병의 진단은 철저한 병력, 신체 검사, 전체 혈구 수 및 혈액 도말 검사로 시작된다. 급성 림프모구 백혈병의 많은 증상이 일반적인 질병에서 발견될 수 있지만, 지속적이거나 설명할 수 없는 증상이 나타나면 암을 의심해야 한다. 병력 및 검사의 많은 특징이 급성 림프모구 백혈병에만 국한되지 않기 때문에 추가 검사가 필요한 경우가 많다. 순환 혈액에 백혈구와 림프 모세포가 많으면 골수에서 림프 세포가 빠르게 생성되고 있음을 나타내므로 급성 림프모구 백혈병을 의심할 수 있다. 이 수치가 높을수록 일반적으로 예후가 나빠진다. 초기 증상의 백혈구 수는 크게 다를 수 있지만, 대부분의 경우 말초 혈액 도말 검사에서 순환하는 림프모세포가 관찰된다.[6]
골수 생검은 일반적으로 전체 세포의 20% 이상이 백혈병 림프모세포인 급성 림프모구 백혈병의 결정적인 증거를 제공한다. 요추 천자(척수 천자라고도 함)를 통해 척추와 뇌의 침범 여부를 확인할 수 있다. 뇌와 척추 침범은 요추천자에서 백혈병 세포를 확인하거나 위에서 설명한 중추신경계 백혈병의 임상 징후를 통해 진단할 수 있다. 실험실 검사 중 혈구 수, 신장 기능, 전해질 및 간 효소 검사에서 이상이 나타날 수 있다.[31]
병리학적 검사, 세포 유전학(특히 필라델피아 염색체의 존재 여부), 면역 표현형 검사를 통해 백혈병 세포가 골수 모세포(호중구, 호산구 또는 호염구)인지 림프 모세포(B 림프구 또는 T 림프구)인지 확인한다. 골수 샘플에 대한 세포 유전학적 검사는 질병을 분류하고 질병의 진행 정도를 예측하는 데 도움이 될 수 있다. 다양한 돌연변이가 생존 기간의 단축 또는 연장과 관련이 있다. 면역 조직 화학 검사를 통해 백혈병 세포 표면의 TdT 또는 CALLA 항원을 확인할 수 있다. TdT 는 T 전구세포 및 B 전구세포의 발달 초기에 발현되는 단백질인 반면, CALLA 는 모든 사례의 80%에서 발견되는 항원이며 만성 골수성 백혈병의 "모세포 위기"에서도 발견된다.
초음파 또는 CT 스캔을 통해 폐, 간, 비장, 림프절, 뇌, 신장, 생식 기관 등 다른 장기로의 침범을 발견할 수도 있다.[32]
-
급성 림프모구 백혈병(ALL), 소아 말초혈액, 파펜하임 염색, 배율 x100
-
급성 림프모구 백혈병 환자의 골수 도말 검사, 고배율
-
급성 림프모구 백혈병 환자의 골수 도말 검사
면역 표현형 분석[편집]
세포 형태 및 세포 유전학 외에도 세포 표면에 발현되는 단백질을 식별하는 데 사용되는 실험실 기술인 면역 표현형 분석은 급성 림프모구 백혈병 진단의 핵심 요소이다. 면역표현형 분석에 가장 선호되는 방법은 유세포 분석법이다. 급성 림프모구 백혈병의 악성 림프모세포에서 세포 표면에 말단 디옥시뉴클레오타이딜 전이효소(TdT)가 발현되면 악성 림프구 세포와 체내 감염에 정상적으로 반응하는 백혈구인 반응성 림프구를 구분하는 데 도움이 될 수 있다. 반면에 골수 계통의 표지자인 마이엘로퍼옥시데이스(MPO)는 일반적으로 발현되지 않다. 전구 B세포와 전구 T세포는 동일하게 보이기 때문에 면역 표현형 분석은 급성 림프모구 백혈병의 아형과 악성 백혈구의 성숙도를 구별하는 데 도움이 될 수 있다.[6]
면역 표현형과 성숙 단계에 따라 결정되는 급성 림프모구 백혈병의 하위 유형
| B세포 계통 | T세포 계통 |
|---|---|
| pre-pre-B ALL (pro-B-ALL) | 전구성 T세포 ALL |
| common ALL | 성숙 T세포 ALL |
| pre-B ALL | |
| mature B-cell ALL (버킷 백혈병 – FAB L3) |
세포 표면 표지자, 특히 CD 클러스터 또는 분화 표지자 클러스터에 대한 광범위한 단일 클론 항체 패널은 계통별로 세포를 분류하는 데 사용된다.
아래는 B세포 및 T세포 급성 림프모구 백혈병과 관련된 면역학적 표지자이다.[33]
| 면역학적 표지자 | B세포 계통 | T세포 계통 |
|---|---|---|
| B세포 계통 | ||
| CD19, CD22, CD79a | + | − |
| CD10 | − 또는 + (common ALL) | |
| 세포질 항체 | − 또는 + (pre-B ALL) | |
| 표면 항체 | − 또는 + (mature B-cell ALL) | |
| TdT | + | + |
| T세포 계통 | ||
| CD2, CD3, CD4, CD5, CD7, CD8 | − | + |
| TdT | + | + |
세포유전학[편집]
세포유전학적 분석에 따르면 연령대에 따라 급성 림프모구 백혈병 환자의 유전자 이상 비율과 빈도가 다른 것으로 나타났다. 이 정보는 특히 질병 분류에 유용하며 이러한 그룹의 서로 다른 예후를 설명하는 데 도움이 될 수 있다. 유전자 분석과 관련하여, 세포의 염색체 수인 배수체와 전좌와 같은 특정 유전적 이상에 따라 사례를 계층화할 수 있다. 고이배체 세포는 50개 이상의 염색체를 가진 세포로 정의되며, 저이배체 세포는 44개 미만의 염색체를 가진 세포로 정의된다. 고이배체성의 경우 예후가 좋은 반면, 저이배체성의 경우 예후가 좋지 않은 경향이 있다. 예를 들어, 소아 B-급성 림프모구 백혈병에서 가장 흔한 특이적인 이상은 조혈의 전사 조절에 관여하는 단백질을 코딩하는 RUNX1 유전자가 전위되어 ETV6-RUNX1 융합 단백질에 의해 억제되는 t(12;21) ETV6-RUNX1 전위이다.[34]
아래는 급성 림프모구 백혈병에서 일부 세포유전학적 전좌 및 분자유전학적 이상 빈도가 표시된 표이다.
| 세포유전학적 전위 | 분자유전학적 이상 | % |
|---|---|---|
| cryptic t(12;21) | TEL–AML1 융합[35] | 25.4%[36] |
| t(1;19)(q23;p13) | E2A–PBX (PBX1) 융합[37] | 4.8%[36] |
| t(9;22)(q34;q11) | BCR-ABL 융합(P185)[38] | 1.6%[36] |
| t(4;11)(q21;q23) | MLL–AF4 융합[39] | 1.6%[36] |
| t(8;14)(q24;q32) | IGH–MYC 융합[40] | |
| t(11;14)(p13;q11) | TCR–RBTN2 융합[41] |
분류[편집]
프랑스-미국-영국(FAB) 시스템
2008년 이전에는 형태학적 평가에 크게 의존하는 프랑스-미국-영국(FAB) 시스템을 사용하여 급성 림프모구 백혈병을 형태학적으로 분류했다. FAB 시스템은 크기, 세포질, 세포핵, 염기성(세포질의 색깔), 공포성(기포와 같은 특성)에 대한 정보를 고려한다.[42][43]
| FAB 하위군 | 세포 유형 | 특징 | 기타 |
|---|---|---|---|
| ALL - L1 | T세포 또는 pre-B세포 | 작고 균질한(균일한) 세포 | |
| ALL - L2 | T세포 또는 pre-B세포 | 크고 이질적인(다양한) 세포 | |
| ALL - L3 | B세포 | 크고 다양한 공포성이 있는 세포 | 성숙 B세포 ALL은 버킷 백혈병이라고도 불리며, 일반적으로 표준 요법으로는 예후가 좋지 않다. |
임상에서는 종양 세포의 외관을 설명하기 위해 FAB 체계를 일부 사용하지만, 이 분류는 치료법 선택과 예후에 미치는 영향이 제한적이기 때문에 거의 쓰이지 않게 되었다.[44]:491
세계 보건 기구 시스템
2008년, 세계보건기구는 보다 임상적으로 관련성이 높고 의미 있는 예후 및 치료 결정을 내릴 수 있는 분류 체계를 만들기 위해 급성 림프모구성 백혈병의 분류를 개발했다. 이 시스템에서는 세포 유전학적 및 분자 진단 검사를 통해 발견된 유전적, 면역 표현형, 분자적, 형태학적 특징의 차이를 통해 분류했다.[45]:1531–1535[33] 이러한 아형 분류는 급성 림프모구 백혈병의 각 특정 사례에 대한 예후와 가장 적절한 치료법을 결정하는 데 사용된다.
급성 림프모구 백혈병과 관련된 WHO 하위 유형은 다음과 같다.[46]
- B 림프모구 백혈병/림프종
- 달리 명시되지 않음(NOS)
- 반복되는 유전적 이상이 있는 경우
- with t(9;22)(q34.1;q11.2);BCR-ABL1
- with t(v;11q23.3);KMT2A 재배열
- with t(12;21)(p13.2;q22.1); ETV6-RUNX1
- with t(5;14)(q31.1;q32.3) IL3-IGH
- with t(1;19)(q23;p13.3);TCF3-PBX1
- 고배체성
- 저배체성
- T-림프모구 백혈병/림프종
- 모호한 급성 백혈병
- 급성 미분화 백혈병
- 혼합 표현형 급성 백혈병(MPAL), with t(9;22)(q34.1;q11.2); BCR–ABL1
- MPAL with t(v;11q23.3); KMT2A 재배열
- MPAL, B/myeloid, NOS
- MPAL, T/myeloid, NOS
치료[편집]

치료의 목표는 체내에서 암세포가 검출되지 않는 상태(일반적으로 골수 내 모세포가 5% 미만인 상태)로 정의되는 지속적인 관해 상태를 유도하는 것이다.
지난 수십 년 동안 치료 요법의 효능을 높이기 위한 시도들이 있었으며, 그 결과 생존율이 증가했다. 급성 백혈병의 가능한 치료법에는 화학 요법, 스테로이드, 방사선 요법, 집중 복합 치료(골수 이식 및 줄기세포 이식 포함), 표적 치료 및 성장 인자 치료 등이 있다.[7][47]
화학 요법[편집]
화학 요법이 초기 치료법으로 선택되며, 대부분의 급성 림프모구 백혈병 환자는 여러 가지 약물을 복합적으로 투여받는다. 악성 세포가 몸 전체에 분포되어 있기 때문에 수술적 접근은 하지 않는다. 일반적으로 급성 림프모구 백혈병에 대한 세포 독성 화학 요법은 각 환자에게 맞는 여러 가지 항백혈병 약물을 조합하여 사용한다. 급성 림프모구 백혈병에 대한 화학 요법은 관해 유도, 강화 및 유지 요법의 세 단계로 구성된다.
| 단계 | 설명[48][49] | 약물[48][49] |
|---|---|---|
| 관해 유도 | 관해 유도는 다음을 목표로 한다.
치료 시작 후 종양 용해 증후군을 면밀히 모니터링해야 한다. 치료 후 첫 2주 이내에 혈액 또는 골수 세포가 제거되지 않으면 재발 위험이 높아지므로 치료에 대한 초기 반응을 모니터링하는 것이 중요하다. 관해가 유도되지 않는 경우 치료를 강화해야 할 수 있다. 중추신경계 예방화학요법을 시작하고 오마야 리저브(Ommaya reservoir) 또는 다중 요추 천자를 통해 척수강 내 화학 요법을 투여한다. |
다음 약물들을 조합하여 사용한다.
중추신경계 예방 화학 요법으로는 다음 약물들을 통해 달성한다.[50]
필라델피아 염색체 양성 급성 림프모구 백혈병의 경우, 초기 유도 치료의 강도를 기존보다 낮출 수 있다.[51][52] |
| 강화 요법 및 집중 치료 | 고용량 화학 요법을 사용하여 남은 종양을 제거한다. | 일반적인 프로토콜은 다음과 같은 다양한 다중 약물 조합을 사용한다. 개인의 위험 범주에 따라 1~3개를 병용한다.
중추신경계 재발은 하이드로코르티손, 메토트렉세이트 및 사이타라빈의 척수강 내 투여로 치료한다. |
| 유지 요법 | 관해 유도 및 강화 요법으로 죽지 않은 잔류 세포를 죽인다.
|
일반적인 프로토콜에는 다음이 포함된다.
|
성인 화학 요법은 소아 급성 림프모구 백혈병과 유사하지만, 화학 요법만으로는 질병 재발 위험이 더 높다. 성인 급성 림프모구 백혈병의 두 가지 아형(B세포 급성 림프모구 백혈병과 T세포 급성 림프모구 백혈병)은 성인 급성 림프모구 백혈병 환자에게 적절한 치료 요법을 선택할 때 특별한 고려가 필요하다. B세포 급성 림프모구 백혈병은 종종 세포유전학적 이상(특히, t(8;14), t(2;8), t(8;22))과 연관되어 있으며, 단기간의 고강도 요법으로 구성된 공격적인 치료가 필요하다. T세포 급성 림프모구 백혈병은 사이클로포스파미드 함유 약제에 가장 잘 반응한다.[49]
방사선 치료[편집]
방사선 치료는 통증이 있는 뼈 부위, 질병 부담이 큰 부위 또는 골수 이식(전신 방사선 조사)을 위한 준비 과정의 일부로 사용된다. 과거에는 의사들이 뇌에서의 백혈병의 발생 및 재발을 예방하기 위해 중추 신경계 예방을 위해 전신 방사선 형태의 방사선을 일반적으로 사용했다. 최근 연구에 따르면 중추신경계 화학요법은 치료 효과는 좋지만, 드물게 발달 부작용이 생기는 것으로 나타났다. 그 결과 전뇌 방사선의 사용이 더욱 제한되었다. 대부분의 성인 백혈병 전문가는 중추신경계 예방화학요법을 위한 방사선 요법 사용을 포기하고 대신 척수강 내 화학요법을 사용하고 있다.[53][8]
생물학적 치료[편집]
백혈병 림프 모세포에 대한 조합 효과를 기반으로 생물학적 표적을 선택할 수 있다면, 급성 림프모구 백혈병의 치료 효과를 개선하기 위해 사용될 수 있다.[54] 이매티닙과 같은 티로신 키나아제 억제제(TKI)는 종종 Bcr-Abl1+(Ph+) 급성 림프모구 백혈병 환자의 치료 계획에 포함된다. 그러나 급성 림프모구 백혈병의 아형은 화학 요법과 TKI 의 병용에 내성을 보이는 경우가 많으며 재발 시 동종 줄기세포 이식이 권장되는 경우가 많다.[53]
면역 요법[편집]
키메라 항원 수용체(CAR)는 급성 림프모구 백혈병에 대한 유망한 면역 요법으로 개발되었다. 이 기술은 급성 림프모구 백혈병을 치료하는 방법으로 세포 표면 표지자인 CD19를 인식하도록 설계된 단일 사슬 가변 단편(scFv)을 사용한다.
CD19는 모든 B세포에서 발견되는 분자로, 잠재적으로 악성일 수 있는 B세포 집단을 구별하는 수단으로 사용될 수 있다. 이 치료법에서는 생쥐에게 CD19 항원을 접종하여 항-CD19 항체를 생성한다. 골수종 세포주에 융합된 마우스의 비장 세포에서 개발된 하이브리드종(Hybridomas)을 CD19 특이 항체를 코딩하는 cDNA 의 공급원으로 사용할 수 있다.[55] 이 항체의 가변 중쇄와 가변 경쇄를 코딩하는 서열을 시퀀싱하고 작은 펩타이드 링커를 사용하여 이 서열을 함께 복제한다. 그 결과 서열은 scFv를 암호화한다. 이것은 CAR의 엔도도메인(Endo-domain)이 될 것을 코딩하는 트랜스진(transgene)으로 복제될 수 있는데, 이를 통해 만들어진 서브유닛의 배열은 다양하지만 일반적으로 scFv 에 부착되는 힌지 영역, 막 통과 영역, CD28과 같은 자극 분자의 세포 내 영역, ITAM 반복을 포함하는 CD3-zeta의 세포 내 도메인으로 구성된다. 이 때 4-1bb 및 OX40 서열이 포함되기도 한다.[56] 그런 다음 scFv 및 엔도도메인 서열을 포함하는 최종 트랜스진 서열을 환자로부터 얻은 면역 효과 세포에 삽입하여 실험실에서 증폭시킨다. 임상시험에서 이 세포는 세포독성이 있는 T세포의 한 유형으로 만들어졌다.[57]
효과기 세포(effector cell)에 DNA를 삽입하는 방법은 여러가지가 있다. 가장 일반적으로는 트랜스진을 암호화하는 렌티바이러스를 사용한다. 거짓형으로 자가 비활성화된(Pseudotyped, self-inactivating) 렌티바이러스는 원하는 트랜스진을 표적 세포에 안정적으로 삽입할 수 있다. 다른 방법으로는 전기 천공(electroporation) 및 형질 전환이 있지만 시간이 지남에 따라 트랜스진의 발현이 감소하기 때문에 그 효능이 제한적이다.
그런 다음 유전자 변형 이펙터 세포를 다시 환자에게 이식한다. 일반적으로 이 과정은 사이클로포스파마이드와 같은 화학 요법과 함께 이루어지며, 이는 주입된 T세포의 효과를 강화하는 것으로 나타났다. 이러한 효과는 세포가 증식할 수 있는 면역학적 공간을 만드는 데 기인한다.[58] 이 과정은 전체적으로 주조직 적합성 복합체와 독립적인 방식으로 종양 세포 항원을 인식하고 세포 독성 반응을 시작할 수 있는 이펙터 세포(일반적으로 T세포)를 생성한다.
2017년, 티사겐레클루셀(tisagenlecleucel)은 다른 치료에 적절히 반응하지 않거나 재발한 급성 B세포 림프모구 백혈병 환자를 위한 CAR-T 치료제로 FDA의 승인을 받았다.[59] 22일 동안의 과정을 통해 약물은 각 개인에게 맞춤화된다. 각 환자로부터 정제된 T세포는 백혈병 세포를 인식하는 키메라 항원 수용체를 암호화하는 유전자를 DNA에 삽입하는 바이러스에 의해 조정된다.[60]
재발한 급성 림프모구 백혈병[편집]
일반적으로 초기 치료 후 급성 림프모구 백혈병이 재발한 환자는 유도 요법 후 완전 관해 상태를 유지하는 환자보다 예후가 더 나쁘다. 재발성 백혈병은 처음에 시행한 표준 화학 요법에 좋은 반응을 보이지 않을 가능성이 높으므로, 이러한 환자는 재유도 화학 요법을 시도한 후 동종 골수 이식을 받아야 한다. 블리나투모맙(blinatumomab)은 독성 효과 증가 없이 관해율과 전체 생존율을 증가시키는 것으로 나타났기 때문에 이러한 재발 환자도 블리나투모맙 치료를 받을 수 있다.[61]
저선량 방사선은 중추 신경계 내부 또는 외부의 종양 부담을 줄이고 일부 증상을 완화하는 데 도움이 될 수 있다.
티로신 키나제 억제제인 다사티닙에 대한 증거와 사용 승인도 있었다. 다사티닙은 Ph1양성 및 이매티닙 내성 급성 림프모구 백혈병 환자에서 효능이 입증되었지만 장기 생존율과 재발까지의 시간에 대해서는 더 많은 연구가 필요하다.[49]
부작용[편집]
화학 요법이나 줄기세포 이식을 받으면 출혈을 예방하기 위해 혈소판 수혈이 필요할 수 있다.[62][63] 또한 줄기세포 이식을 받은 환자는 이식편대숙주질환(GvHD)이 발생할 수 있다. 이에 중간엽 간질세포가 이식편대숙주질환을 예방하는 데 사용될 수 있는지 여부가 평가하는 연구가 진행되었다. 그 결과 줄기세포 이식 후 모든 원인에 의한 사망률과 만성 급성 이식편대숙주질환의 완전 소멸에 대한 중간엽 줄기세포의 치료 효과에 대한 증거는 매우 불확실했다. 간엽줄기세포를 예방적 목적으로 사용할 경우 모든 원인에 의한 사망률, 악성 질환의 재발, 급성 및 만성 이식편대숙주질환의 발생률에 차이가 아주 작거나 거의 없었다.[64]
지지 요법[편집]
급성 림프모구 백혈병과 같은 혈액암 성인 환자의 표준 치료에 신체 운동을 추가하는 것은 사망률, 삶의 질, 신체 기능 향상에 거의 차이가 없었다. 이러한 운동은 우울증을 약간 감소시킬 수 있다. 또한 유산소 운동은 피로를 줄일 수 있다. 불안과 심각한 부작용에 미치는 영향에 대한 증거는 매우 불확실했다.[65]
유전자 치료[편집]
브렉수캅타진 오토루셀(테카투스, Brexucabtagene autoleucel)은 2021년 10월 재발성 또는 불응성인 B세포 전구체 급성 림프모구 백혈병의 성인 치료제로 승인되었다.[66][67]
브렉수캅타겐 오토루셀 투여법은 림프종과 싸우는 데 도움이 되도록 수혜자 자신의 면역 체계를 사용하여 만들어진 맞춤형 치료법이다.[68] 이는 백혈구의 일종인 수혜자의 T세포를 채취하여 림프종 세포를 표적으로 삼아 죽이는 데 도움이 되는 새로운 유전자를 포함하도록 유전적으로 변형한다.[68] 이렇게 변형된 T세포는 다시 환자에게 주입된다.[68]
예후[편집]
화학 요법과 조혈모세포 이식이 개발되기 전에는 주로 감염이나 출혈로 인해 어린이들이 평균 3개월 정도 생존했다. 화학 요법의 등장 이후 소아 백혈병의 예후는 크게 개선되었으며, 급성 림프모구 백혈병에 걸린 소아는 치료 시작 4주 후 성공적인 관해에 도달할 확률이 95%에 달하는 것으로 추정된다. 선진국에서 소아 백혈병 치료를 받는 소아 환자의 5년 생존율은 80% 이상이다. 유도 화학 요법을 받는 성인의 60~80%는 4주 후 완전 관해에 도달하고, 70세 이상은 5%의 완치율을 보이는 것으로 추정된다.[48][69]

그러나 다양한 요인에 따라 개인마다 모든 예후가 다를 수 있다.
- 성별: 여성이 남성보다 더 나은 성과를 거두는 경향이 있다.
- 인종: 백인은 아프리카계 미국인, 아시아계 또는 히스패닉계보다 급성 백혈병에 걸릴 확률이 더 높다. 그러나 백인은 비백인보다 예후가 더 좋은 경향이 있다.
- 진단 당시 연령: 1~10세 어린이가 급성 림프모구 백혈병에 걸리고 완치될 가능성이 가장 높다. 노인의 경우 염색체 이상(예: 필라델피아 염색체)으로 인해 치료가 더 어려워지고 예후가 나빠질 가능성이 더 높다. 또한 고령자는 모든 치료를 더욱 어렵게 만드는 동반 질환을 앓고 있을 가능성이 높다.
- 진단 시 백혈구 수가 30,000(B-ALL) 또는 100,000(T-ALL)을 초과하면 예후가 나빠지는 것과 관련이 있다.
- 중추신경계(뇌 또는 척수)로 전이된 암은 예후가 더 나쁘다.
- 형태학적, 면역학적, 유전적 하위 유형
- 초기 치료에 대한 환자의 반응과 완전 관해에 도달하는 데 필요한 기간(4주 이상)이 길어지는 경우
- 급성 림프모구 백혈병의 조기 재발
- 미세 암세포 잔류
- 다운 증후군 및 기타 염색체 이상(이수성 및 전위)과 같은 유전적 장애[70]
| 요인 | 예후 불량 | 예후 좋음 |
|---|---|---|
| 나이 | 2세 이하 또는 10세 이상 | 3~5세 |
| 성별 | 남성 | 여성 |
| 인종 | 흑인 | 코카시안 |
| 장기 비대 | 존재 | 부재 |
| 종격동 종괴 | 존재 | 부재 |
| 중추신경계 침범 | 존재 | 부재 |
| 백혈구 수 | B-ALL >30,000mm3 T-ALL >100,000mm3 | 낮음 |
| 헤모글로빈 농도 | >10g/dl | <10g/dl |
| 세포 종류 | 비림프성 | 림프성 |
| 세포 계통 | Pre-B세포 + T-ALL (어린이) | 조기 pre-B세포 |
| 핵형 | 전좌 | 이배체성 |
| 치료에 대한 반응 | 느림
모세포 제거에 1주일 이상 소요 |
즉각적임
1주 이내 모세포 제거 |
| 관해 소요 시간 | 4주 이상 | 4주 이하 |
| 미세 암세포 잔류 | 3~6개월 이상 양성 | 1개월 이내(어린이) 또는 3개월 이내(성인) 음성 |
암세포 염색체의 특징적인 큰 변화를 연구하는 세포 유전학은 예후를 예측하는 중요한 지표이다.[74] 일부 세포 유전학적 아형은 다른 아형보다 예후가 더 나쁘다. 여기에는 다음이 포함된다.[21]
- t(9,22) 양성-ALL(성인 급성 림프모구 백혈병 환자의 30%) 및 기타 Bcr-abl 재배열 백혈병 환자는 예후가 좋지 않을 가능성이 높지만, 화학 요법과 Bcr-abl 티로신 키나제 억제제로 구성된 치료를 받으면 생존율이 높아질 수 있다.[49]
- 염색체 4번과 11번 사이의 전좌는 약 4%에서 발생하며 12개월 미만의 영아에서 가장 흔하다.
| 세포유전학적 변화 | 위험 범주 |
|---|---|
| 필라델피아 염색체 | 예후 불량 |
| t(4;11)(q21;q23) | 예후 불량 |
| t(8;14)(q24.1;q32) | 예후 불량 |
| 4개 이상 비정상인 복잡한 핵형 | 예후 불량 |
| 저배수체 혹은 삼배수체 | 예후 불량 |
| 7번 염색체 삭제 | 예후 불량 |
| 8번 염색체 삼염색체증 | 예후 불량 |
| 4, 10 17번 염색체 삼염색체증 혹은 고배수성 | 예후 좋음 |
| 9번 단완 결실 | 예후 좋음 |
- 고배수성(50개 이상의 염색체)과 t(12;21)은 좋은 예후 인자이며 소아 급성 림프모구 백혈병 사례의 50%를 차지한다.
| 예후 | 세포유전학적 소견 |
|---|---|
| 좋음 | 이배체수 > 50 ; t (12;21) |
| 중간 | 이배체수 47–50; 정상(이배체); 6번 장완 결실; 8q24 재배열 |
| 나쁨 | 저배수 단배체성; 사배체성; 17번 단완 결실; t (9;22); t (11q23) |
분류되지 않은 급성 림프모구 백혈병은 좋은 위험 범주와 나쁜 위험 범주의 중간에 해당하는 중간 정도의 예후로 간주된다.[75]
역학[편집]
급성 림프모구 백혈병은 2015년에 전 세계적으로 약 87만 6,000명이 걸렸고 11만 1,000명이 사망했다.[14][10] 급성 림프구성 백혈병은 어린이와 성인 모두에게 발생하며 3세에서 7세 사이에 가장 높은 발병률을 보인다. 발병의 약 75%는 6세 이전에 발생하며 40세 이후에 2차적으로 증가한다.[48] 어린이 1,500명 중 1명꼴로 발병하는 것으로 추정된다.[9]
급성 림프구성 백혈병에 걸린 사람들의 광범위한 연령 프로필을 고려할 때, 급성 림프모구 백혈병 은 매년 10만 명당 약 1.7명이 새로 발생한다.[6] 급성 림프모구성 백혈병은 성인의 약 20%, 소아 백혈병의 80%를 차지하며 가장 흔한 소아암이다.[6] 80~90%의 소아는 치료를 받으면 장기적으로 완치 반응을 보이지만[45]:1527 여전히 소아 암 관련 사망의 주요 원인이다.[76] 발병의 85%는 B세포 계통이며 남성과 여성 모두에서 동일한 수의 사례가 발생한다. 나머지 15%의 T세포 계통은 남성이 우세한다.
전 세계적으로 급성 림프모구 백혈병 은 일반적으로 아프리카계보다 백인, 히스패닉, 라틴계에서 더 자주 발생한다.[77]:1617[78] 미국에서는 백인(36건/백만 명)과 히스패닉(41건/백만 명) 혈통의 어린이가 아프리카(15건/백만 명) 혈통의 어린이에 비해 급성 림프모구 백혈병 이 더 흔하다.[79]
임신[편집]
백혈병은 임신과 거의 관련이 없으며 임산부 10,000명 중 1명 정도만 발병한다.[80] 임산부의 백혈병 관리는 주로 백혈병의 유형에 따라 달라진다. 급성 백혈병은 일반적으로 유산과 선천성 장애의 위험이 크지만, 특히 발달에 민감한 임신 초기에 화학 요법을 시행하는 경우라도 신속하고 적극적인 치료가 필요하다.[80]
참고 문헌[편집]
- ↑ 가 나 다 라 마 바 사 아 “Childhood Acute Lymphoblastic Leukemia Treatment”. 《National Cancer Institute》. 2017년 12월 8일. 2017년 12월 20일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 Hunger SP, Mullighan CG (October 2015). “Acute Lymphoblastic Leukemia in Children”. 《The New England Journal of Medicine》 (영어) 373 (16): 1541–52. doi:10.1056/nejmra1400972. PMID 26465987. S2CID 609394.
- ↑ 가 나 다 라 Ferri, Fred F. (2017). 《Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1》. Elsevier Health Sciences. 743쪽. ISBN 9780323529570.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 타 파 하 거 너 Inaba H, Greaves M, Mullighan CG (June 2013). “Acute lymphoblastic leukaemia”. 《Lancet》 381 (9881): 1943–55. doi:10.1016/S0140-6736(12)62187-4. PMC 3816716. PMID 23523389.
- ↑ 가 나 다 라 마 바 사 아 자 차 카 《Childhood acute lymphoblastic leukemia》. Vora, Ajay (editor). Cham, Switzerland: Springer International Publishing. 2017. 1–44, 61–86쪽. ISBN 9783319397078. OCLC 984342596.
- ↑ 가 나 다 라 마 Baljevic M, Jabbour E, O'Brien S, Kantarjian HM (2016). 〈Acute Lymphoblastic Leukemia〉. Kantarjian HM, Wolff RA. 《The MD Anderson Manual of Medical Oncology》 3판. New York: McGraw-Hill Education. 2017년 11월 22일에 확인함.
- ↑ 가 나 Cordo V, Meijerink J (January 2021). “T-cell Acute Lymphoblastic Leukemia: A Roadmap to Targeted Therapies”. 《Blood Cancer Discovery》 2 (1): 19–31. doi:10.1158/2643-3230.BCD-20-0093. PMC 8447273. PMID 34661151.
- ↑ 가 나 다 라 Paul S, Kantarjian H, Jabbour EJ (November 2016). “Adult Acute Lymphoblastic Leukemia”. 《Mayo Clinic Proceedings》 91 (11): 1645–1666. doi:10.1016/j.mayocp.2016.09.010. PMID 27814839.
- ↑ 가 나 Boer JM, den Boer ML (September 2017). “BCR-ABL1-like acute lymphoblastic leukaemia: From bench to bedside”. 《European Journal of Cancer》 82: 203–218. doi:10.1016/j.ejca.2017.06.012. PMID 28709134.
- ↑ 가 나 다 Wang, Haidong; Naghavi, Mohsen; Allen, Christine; Barber, Ryan M.; Bhutta, Zulfiqar A.; Carter, Austin; Casey, Daniel C.; Charlson, Fiona J.; Chen, Alan Zian; Coates, Matthew M.; Coggeshall, Megan; Dandona, Lalit; Dicker, Daniel J.; Erskine, Holly E.; Ferrari, Alize J.; Fitzmaurice, Christina; Foreman, Kyle; Forouzanfar, Mohammad H.; Fraser, Maya S.; Fullman, Nancy; Gething, Peter W.; Goldberg, Ellen M.; Graetz, Nicholas; Haagsma, Juanita A.; Hay, Simon I.; Huynh, Chantal; Johnson, Catherine O.; Kassebaum, Nicholas J.; Kinfu, Yohannes; 외. (October 2016). “Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015”. 《Lancet》 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ↑ Marino, Bradley S.; Fine, Katie S. (2013). 《Blueprints Pediatrics》. Lippincott Williams & Wilkins. 205쪽. ISBN 9781451116045.
- ↑ Pui, Ching-Hon; Evans, William E. (2006년 1월 12일). “Treatment of Acute Lymphoblastic Leukemia”. 《New England Journal of Medicine》 354 (2): 166–178. doi:10.1056/NEJMra052603. ISSN 0028-4793. PMID 16407512.
- ↑ Larson, Richard A. (2018년 1월 2일). “Managing CNS disease in adults with acute lymphoblastic leukemia”. 《Leukemia & Lymphoma》 59 (1): 3–13. doi:10.1080/10428194.2017.1326597. ISSN 1042-8194. PMID 28535095. S2CID 24564241.
- ↑ 가 나 Vos, Theo; Allen, Christine; Arora, Megha; Barber, Ryan M.; Bhutta, Zulfiqar A.; Brown, Alexandria; Carter, Austin; Casey, Daniel C.; Charlson, Fiona J.; Chen, Alan Z.; Coggeshall, Megan; Cornaby, Leslie; Dandona, Lalit; Dicker, Daniel J.; Dilegge, Tina; Erskine, Holly E.; Ferrari, Alize J.; Fitzmaurice, Christina; Fleming, Tom; Forouzanfar, Mohammad H.; Fullman, Nancy; Gething, Peter W.; Goldberg, Ellen M.; Graetz, Nicholas; Haagsma, Juanita A.; Hay, Simon I.; Johnson, Catherine O.; Kassebaum, Nicholas J.; Kawashima, Toana; 외. (October 2016). “Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015”. 《Lancet》 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ “Acute Lymphocytic Leukemia – Cancer Stat Facts”. 《SEER》. 2017년 12월 20일에 확인함.
- ↑ Tubergen DG, Bleyer A, Ritchey AK (2011). 〈Acute Lymphoblastic Leukemia〉. Kliegman RM, Stanton BM, Geme J, Schor NF, Behrman RE. 《Nelson Textbook of Pediatrics》 19판. Philadelphia, PA: Elsevier/Saunders. 1732–1737쪽. ISBN 978-1437707557. OCLC 706780860.
- ↑ Brown P (2013년 12월 6일). “Treatment of infant leukemias: challenge and promise”. 《Hematology. American Society of Hematology. Education Program》 2013 (1): 596–600. doi:10.1182/asheducation-2013.1.596. PMC 4729208. PMID 24319237.
- ↑ Clarke RT, Van den Bruel A, Bankhead C, Mitchell CD, Phillips B, Thompson MJ (October 2016). “Clinical presentation of childhood leukaemia: a systematic review and meta-analysis”. 《Archives of Disease in Childhood》 101 (10): 894–901. doi:10.1136/archdischild-2016-311251. PMID 27647842.
- ↑ “Acute Lymphoblastic Leukemia”. 《The Lecturio Medical Concept Library》. 2021년 6월 27일에 확인함.
- ↑ Cortes J (February 2001). “Central nervous system involvement in adult acute lymphocytic leukemia”. 《Hematology/Oncology Clinics of North America》 15 (1): 145–62. doi:10.1016/s0889-8588(05)70203-3. PMID 11253605.
- ↑ 가 나 Acute Lymphoblastic Leukemia - eMedicine
- ↑ Bleyer WA (August 1988). “Central nervous system leukemia”. 《Pediatric Clinics of North America》 35 (4): 789–814. doi:10.1016/s0031-3955(16)36510-5. PMID 3047654.
- ↑ Ingram LC, Fairclough DL, Furman WL, Sandlund JT, Kun LE, Rivera GK, Pui CH (May 1991). “Cranial nerve palsy in childhood acute lymphoblastic leukemia and non-Hodgkin's lymphoma”. 《Cancer》 67 (9): 2262–8. doi:10.1002/1097-0142(19910501)67:9<2262::aid-cncr2820670909>3.0.co;2-u. PMID 2013032.
- ↑ Terwilliger T, Abdul-Hay M (June 2017). “Acute lymphoblastic leukemia: a comprehensive review and 2017 update”. 《Blood Cancer Journal》 7 (6): e577. doi:10.1038/bcj.2017.53. PMC 5520400. PMID 28665419.
- ↑ Meyer C, Hofmann J, Burmeister T, Gröger D, Park TS, Emerenciano M, 외. (November 2013). “The MLL recombinome of acute leukemias in 2013”. 《Leukemia》 27 (11): 2165–76. doi:10.1038/leu.2013.135. PMC 3826032. PMID 23628958.
- ↑ Benedikt A, Baltruschat S, Scholz B, Bursen A, Arrey TN, Meyer B, 외. (January 2011). “The leukemogenic AF4-MLL fusion protein causes P-TEFb kinase activation and altered epigenetic signatures”. 《Leukemia》 25 (1): 135–44. doi:10.1038/leu.2010.249. PMID 21030982.
- ↑ Smith MA, Rubinstein L, Anderson JR, Arthur D, Catalano PJ, Freidlin B, 외. (February 1999). “Secondary leukemia or myelodysplastic syndrome after treatment with epipodophyllotoxins”. 《Journal of Clinical Oncology》 17 (2): 569–77. doi:10.1200/JCO.1999.17.2.569. PMID 10080601.
- ↑ Greaves M (August 2018). “A causal mechanism for childhood acute lymphoblastic leukaemia”. 《Nature Reviews. Cancer》 18 (8): 471–484. doi:10.1038/s41568-018-0015-6. PMC 6986894. PMID 29784935.
- ↑ 가 나 다 라 마 Hunger SP, Mullighan CG (October 2015). “Acute Lymphoblastic Leukemia in Children”. 《The New England Journal of Medicine》 (영어) 373 (16): 1541–52. doi:10.1056/nejmra1400972. PMID 26465987. S2CID 609394.
- ↑ 가 나 다 Inaba H, Greaves M, Mullighan CG (June 2013). “Acute lymphoblastic leukaemia”. 《Lancet》 381 (9881): 1943–55. doi:10.1016/S0140-6736(12)62187-4. PMC 3816716. PMID 23523389.
- ↑ Acute Lymphoblastic Leukemia - eMedicine
- ↑ Rytting, ME, 편집. (November 2013). “Acute Leukemia”. 《Merck Manual Professional》. Merck Sharp & Dohme Corp. 15 July 2014에 원본 문서에서 보존된 문서. 17 April 2014에 확인함.
- ↑ 가 나 Hoffbrand AV, Moss PA (2015년 10월 6일). 《Hoffbrand's essential haematology》 Seven판. Chichester, West Sussex. ISBN 9781118408636. OCLC 910009732.
- ↑ Bhojwani D, Pei D, Sandlund JT, Jeha S, Ribeiro RC, Rubnitz JE, 외. (February 2012). “ETV6-RUNX1-positive childhood acute lymphoblastic leukemia: improved outcome with contemporary therapy”. 《Leukemia》 26 (2): 265–70. doi:10.1038/leu.2011.227. PMC 3345278. PMID 21869842.
- ↑ Stams WA, den Boer ML, Beverloo HB, Meijerink JP, van Wering ER, Janka-Schaub GE, Pieters R (April 2005). “Expression levels of TEL, AML1, and the fusion products TEL-AML1 and AML1-TEL versus drug sensitivity and clinical outcome in t(12;21)-positive pediatric acute lymphoblastic leukemia”. 《Clinical Cancer Research》 11 (8): 2974–80. doi:10.1158/1078-0432.CCR-04-1829. PMID 15837750.
- ↑ 가 나 다 라 Pakakasama S, Kajanachumpol S, Kanjanapongkul S, Sirachainan N, Meekaewkunchorn A, Ningsanond V, Hongeng S (August 2008). “Simple multiplex RT-PCR for identifying common fusion transcripts in childhood acute leukemia”. 《International Journal of Laboratory Hematology》 30 (4): 286–91. doi:10.1111/j.1751-553X.2007.00954.x. PMID 18665825.
- ↑ McWhirter JR, Neuteboom ST, Wancewicz EV, Monia BP, Downing JR, Murre C (September 1999). “Oncogenic homeodomain transcription factor E2A-Pbx1 activates a novel WNT gene in pre-B acute lymphoblastoid leukemia”. 《Proceedings of the National Academy of Sciences of the United States of America》 96 (20): 11464–9. Bibcode:1999PNAS...9611464M. doi:10.1073/pnas.96.20.11464. PMC 18056. PMID 10500199.
- ↑ Rudolph C, Hegazy AN, von Neuhoff N, Steinemann D, Schröck E, Stripecke R, 외. (August 2005). “Cytogenetic characterization of a BCR-ABL transduced mouse cell line”. 《Cancer Genetics and Cytogenetics》 161 (1): 51–6. doi:10.1016/j.cancergencyto.2004.12.021. PMID 16080957.
- ↑ Caslini C, Serna A, Rossi V, Introna M, Biondi A (June 2004). “Modulation of cell cycle by graded expression of MLL-AF4 fusion oncoprotein”. 《Leukemia》 18 (6): 1064–71. doi:10.1038/sj.leu.2403321. PMID 14990976.
- ↑ Martín-Subero JI, Odero MD, Hernandez R, Cigudosa JC, Agirre X, Saez B, 외. (August 2005). “Amplification of IGH/MYC fusion in clinically aggressive IGH/BCL2-positive germinal center B-cell lymphomas”. 《Genes, Chromosomes & Cancer》 43 (4): 414–23. doi:10.1002/gcc.20187. PMID 15852472. S2CID 2025900.
- ↑ Zalcberg IQ, Silva ML, Abdelhay E, Tabak DG, Ornellas MH, Simões FV, 외. (October 1995). “Translocation 11;14 in three children with acute lymphoblastic leukemia of T-cell origin”. 《Cancer Genetics and Cytogenetics》 84 (1): 32–8. doi:10.1016/0165-4608(95)00062-3. PMID 7497440.
- ↑ Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DA, Gralnick HR, Sultan C (August 1976). “Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group”. 《British Journal of Haematology》 33 (4): 451–8. doi:10.1111/j.1365-2141.1976.tb03563.x. PMID 188440. S2CID 9985915.
- ↑ “ACS :: How Is Acute Lymphocytic Leukemia Classified?”. 2008년 3월 23일에 원본 문서에서 보존된 문서.
- ↑ DeAngelo DJ, Pui C. Acute lymphoblastic leukemia and lymphoblastic lymphoma. Chapter 19 of American Society of Hematology Self-Assessment Program. 2013. ISBN 9780982843512
- ↑ 가 나 Orkin SH, Nathan DG, Ginsburg D, 외. (2014). 《Nathan and Oski's Hematology and Oncology of Infancy and Childhood》 8판. Saunders. ISBN 978-1-4557-5414-4.
- ↑ Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM, 외. (May 2016). “The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia”. 《Blood》 127 (20): 2391–405. doi:10.1182/blood-2016-03-643544. PMID 27069254. S2CID 18338178.
- ↑ “Acute lymphoblastic leukemia (ALL) Information – Mount Sinai – New York”. 《Mount Sinai Health System》. 2016년 8월 3일에 원본 문서에서 보존된 문서. 2017년 11월 18일에 확인함.
- ↑ 가 나 다 라 Hoffbrand, Victor; Moss, Paul; Pettit, John (2006년 10월 31일). 《Essential Haematology》. Wiley. 192–196쪽. ISBN 978-1-4051-3649-5. 2015년 3월 21일에 원본 문서에서 보존된 문서. 2013년 9월 14일에 확인함.
- ↑ 가 나 다 라 마 “Adult Acute Lymphoblastic Leukemia Treatment”. 《National Cancer Institute》. 2017년 12월 6일에 확인함.
- ↑ Jabbour E, Thomas D, Cortes J, Kantarjian HM, O'Brien S (May 2010). “Central nervous system prophylaxis in adults with acute lymphoblastic leukemia: current and emerging therapies”. 《Cancer》 116 (10): 2290–300. doi:10.1002/cncr.25008. PMID 20209620. S2CID 13634096.
- ↑ Yanada M (June 2015). “Time to tune the treatment of Ph+ ALL”. 《Blood》 125 (24): 3674–5. doi:10.1182/blood-2015-04-641704. PMID 26069331.
- ↑ Seiter K, Harris JE. Acute Lymphoblastic Leukemia Treatment Protocols. emedicine; Medscape. “Acute Lymphoblastic Leukemia Treatment Protocols: Treatment Protocols”. 2015년 9월 1일에 원본 문서에서 보존된 문서. 2015년 8월 16일에 확인함.
- ↑ 가 나 Hoffbrand AV, Moss PA (2015년 10월 26일). 《Hoffbrand's essential haematology》 Seven판. Chichester, West Sussex. ISBN 9781118408674. OCLC 909538759.
- ↑ Lambrou GI, Papadimitriou L, Chrousos GP, Vlahopoulos SA (April 2012). “Glucocorticoid and proteasome inhibitor impact on the leukemic lymphoblast: multiple, diverse signals converging on a few key downstream regulators”. 《Molecular and Cellular Endocrinology》 351 (2): 142–51. doi:10.1016/j.mce.2012.01.003. PMID 22273806. S2CID 28749125.
- ↑ Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, 외. (April 2013). “Chimeric antigen receptor-modified T cells for acute lymphoid leukemia”. 《The New England Journal of Medicine》 368 (16): 1509–1518. doi:10.1056/NEJMoa1215134. PMC 4058440. PMID 23527958.
- ↑ Barrett DM, Singh N, Porter DL, Grupp SA, June CH (2014). “Chimeric antigen receptor therapy for cancer”. 《Annual Review of Medicine》 65: 333–47. doi:10.1146/annurev-med-060512-150254. PMC 4120077. PMID 24274181.
- ↑ Alonso-Camino V, Sánchez-Martín D, Compte M, Nuñez-Prado N, Diaz RM, Vile R, Alvarez-Vallina L (May 2013). “CARbodies: Human Antibodies Against Cell Surface Tumor Antigens Selected From Repertoires Displayed on T Cell Chimeric Antigen Receptors”. 《Molecular Therapy: Nucleic Acids》 2 (5): e93. doi:10.1038/mtna.2013.19. PMC 4817937. PMID 23695536.
- ↑ Zufferey R, Dull T, Mandel RJ, Bukovsky A, Quiroz D, Naldini L, Trono D (December 1998). “Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery”. 《Journal of Virology》 72 (12): 9873–80. doi:10.1128/JVI.72.12.9873-9880.1998. PMC 110499. PMID 9811723.
- ↑ Office of the Commissioner. “Press Announcements—FDA approval brings first gene therapy to the United States”. 《www.fda.gov》. 2017년 9월 3일에 원본 문서에서 보존된 문서. 2017년 9월 12일에 확인함.
- ↑ Ledford H (July 2017). “Engineered cell therapy for cancer gets thumbs up from FDA advisers”. 《Nature》 547 (7663): 270. Bibcode:2017Natur.547..270L. doi:10.1038/nature.2017.22304. PMID 28726836.
- ↑ Kantarjian H, Stein A, Gökbuget N, Fielding AK, Schuh AC, Ribera JM, 외. (March 2017). “Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia”. 《The New England Journal of Medicine》 (영어) 376 (9): 836–847. doi:10.1056/nejmoa1609783. PMC 5881572. PMID 28249141.
- ↑ Estcourt L, Stanworth S, Doree C, Hopewell S, Murphy MF, Tinmouth A, Heddle N (May 2012). Cochrane Haematological Malignancies Group, 편집. “Prophylactic platelet transfusion for prevention of bleeding in patients with haematological disorders after chemotherapy and stem cell transplantation”. 《The Cochrane Database of Systematic Reviews》 (5): CD004269. doi:10.1002/14651858.CD004269.pub3. PMID 22592695.
- ↑ Estcourt LJ, Stanworth SJ, Doree C, Hopewell S, Trivella M, Murphy MF (November 2015). Cochrane Haematological Malignancies Group, 편집. “Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation”. 《The Cochrane Database of Systematic Reviews》 2015 (11): CD010983. doi:10.1002/14651858.CD010983.pub2. PMC 4717525. PMID 26576687.
- ↑ Fisher SA, Cutler A, Doree C, Brunskill SJ, Stanworth SJ, Navarrete C, Girdlestone J (January 2019). Cochrane Haematological Malignancies Group, 편집. “Mesenchymal stromal cells as treatment or prophylaxis for acute or chronic graft-versus-host disease in haematopoietic stem cell transplant (HSCT) recipients with a haematological condition”. 《The Cochrane Database of Systematic Reviews》 1 (1): CD009768. doi:10.1002/14651858.CD009768.pub2. PMC 6353308. PMID 30697701.
- ↑ Knips L, Bergenthal N, Streckmann F, Monsef I, Elter T, Skoetz N (January 2019). Cochrane Haematological Malignancies Group, 편집. “Aerobic physical exercise for adult patients with haematological malignancies”. 《The Cochrane Database of Systematic Reviews》 1 (1): CD009075. doi:10.1002/14651858.CD009075.pub3. PMC 6354325. PMID 30702150.
- ↑ “FDA approves brexucabtagene autoleucel for relapsed or refractory B-cell precursor acute lymphoblastic leukemia”. 《U.S. Food and Drug Administration (FDA)》. 2021년 10월 1일. 2021년 10월 2일에 확인함.
 이 문서는 퍼블릭 도메인 출처의 본문을 포함합니다.
이 문서는 퍼블릭 도메인 출처의 본문을 포함합니다.
- ↑ “U.S. FDA Approves Kite's Tecartus as the First and Only Car T for Adults With Relapsed or Refractory B-cell Acute Lymphoblastic Leukemia”. 《Kite》. 2021년 10월 1일. 2021년 10월 1일에 확인함 – Business Wire 경유.
- ↑ 가 나 다 “FDA Approves First Cell-Based Gene Therapy For Adult Patients with Relapsed or Refractory MCL”. 《U.S. Food and Drug Administration (FDA)》. 2020년 7월 24일. 2020년 7월 24일에 확인함.
 이 문서는 퍼블릭 도메인 출처의 본문을 포함합니다.
이 문서는 퍼블릭 도메인 출처의 본문을 포함합니다.
- ↑ Hutter JJ (June 2010). “Childhood leukemia”. 《Pediatrics in Review》 31 (6): 234–41. doi:10.1542/pir.31-6-234. PMID 20516235.
- ↑ “Prognosis and survival for acute lymphocytic leukemia - Canadian Cance”. 《www.cancer.ca》. 2017년 12월 7일에 원본 문서에서 보존된 문서. 2017년 12월 6일에 확인함.
- ↑ Nelson Essentials of Pediatrics By Karen Marcdante, Robert M. Kliegman, Richard E. Behrman, Hal B. Jenson p597
- ↑ The Guide Paediatrics. ISBN 978-978-917-9909. p51
- ↑ Hoffbrand AV, Moss PA (2015년 10월 26일). 《Hoffbrand's essential haematology》 Seven판. Chichester, West Sussex. 194쪽. ISBN 9781118408674. OCLC 909538759.
- ↑ Moorman AV, Harrison CJ, Buck GA, Richards SM, Secker-Walker LM, Martineau M, 외. (April 2007). “Karyotype is an independent prognostic factor in adult acute lymphoblastic leukemia (ALL): analysis of cytogenetic data from patients treated on the Medical Research Council (MRC) UKALLXII/Eastern Cooperative Oncology Group (ECOG) 2993 trial”. 《Blood》 109 (8): 3189–97. doi:10.1182/blood-2006-10-051912. PMID 17170120. S2CID 1038016.
- ↑ Den Boer ML, van Slegtenhorst M, De Menezes RX, Cheok MH, Buijs-Gladdines JG, Peters ST, 외. (February 2009). “A subtype of childhood acute lymphoblastic leukaemia with poor treatment outcome: a genome-wide classification study”. 《The Lancet. Oncology》 10 (2): 125–34. doi:10.1016/S1470-2045(08)70339-5. PMC 2707020. PMID 19138562.
- ↑ Guo LM, Xi JS, Ma Y, Shao L, Nie CL, Wang GJ (January 2014). “ARID5B gene rs10821936 polymorphism is associated with childhood acute lymphoblastic leukemia: a meta-analysis based on 39,116 subjects”. 《Tumour Biology》 35 (1): 709–13. doi:10.1007/s13277-013-1097-0. PMID 23975371. S2CID 12601034.
- ↑ Greer JP, Arber DA, Glader B, 외. (2013). 《Wintrobe's Clinical Hematology》 13판. Lippincott Williams & Wilkins. ISBN 978-1-4511-7268-3.
- ↑ Urayama KY, Manabe A (October 2014). “Genomic evaluations of childhood acute lymphoblastic leukemia susceptibility across race/ethnicities”. 《[Rinsho Ketsueki] the Japanese Journal of Clinical Hematology》 55 (10): 2242–8. PMID 25297793.
- ↑ Ries LA, Smith MA, Gurney JG, Linet M, Tamra T, Young JL, Bunin GR (1999). 《Cancer Incidence and Survival among Children and Adolescents: United States SEER Program 1975–1995.》. Bethesda, MD: National Cancer Institute, SEER Program.
- ↑ 가 나 Shapira T, Pereg D, Lishner M (September 2008). “How I treat acute and chronic leukemia in pregnancy”. 《Blood Reviews》 22 (5): 247–59. doi:10.1016/j.blre.2008.03.006. PMID 18472198.