퓨린: 두 판 사이의 차이
잔글 봇: 위키공용분류 틀 추가 |
영어판 위키(2020년 8월 4일 버전)를 참고하여 기존의 한국어판 문서의 내용을 보충함. |
||
| 1번째 줄: | 1번째 줄: | ||
{{화합물 정보 |
|||
'''퓨린'''(purine)은 [[화학식]] C5H4N4로 이루어진 질소 [[헤테로고리 화합물|헤테로고리]] 계열의 [[유기 화합물]]이다. 1899년에 [[에밀 피셔]]가 처음으로 합성에 성공하였다. 사실 푸린 분자 자체는 자연계에 별로 존재하지 않으나 그 유도체는 자연계에 매우 풍부하게 존재하며 생명체에서 매우 중요한 역할을 하고 있다. 특히 [[핵산]]은 퓨린 계열 염기와 [[피리미딘]] 계열 염기 두 종류로 나누어지며, 푸린 계열 염기에는 [[아데닌]]과 [[구아닌]]이 있다. 아데닌과 구아닌은 DNA와 RNA를 이루는 4가지 [[뉴클레오티드]] 중 두 가지의 전구체이다. |
|||
|이름 = 퓨린 |
|||
|그림 = Purin num2.svg |
|||
|그림크기 = 150px |
|||
|그림1 = Purine-3D-balls.png |
|||
|그림크기1 = 150px |
|||
|그림2 = Purine-3D-spacefill.png |
|||
|그림크기2 = 150px |
|||
|그림설명 = |
|||
|IUPAC = 9''H''-purine |
|||
|화학식 = C<sub>5</sub>H<sub>4</sub>N<sub>4</sub> |
|||
|분자식 = |
|||
|별칭 = |
|||
|CAS = 120-73-0 |
|||
|원자량 = |
|||
|분자량 = 120.12 |
|||
|녹는점 = 214 |
|||
|끓는점 = |
|||
|밀도 = |
|||
|용해도 = |
|||
|용해성 = |
|||
|상온상태 = |
|||
|상온색 = |
|||
|기체 = |
|||
|기체1 = |
|||
|액체 = |
|||
|액체1 = |
|||
|고체 = |
|||
|고체1 = |
|||
|섭취 = |
|||
|흡입 = |
|||
|피부 = |
|||
|눈 = |
|||
|R-phrase = |
|||
|기타 = |
|||
|LD50 = |
|||
}} |
|||
'''퓨린'''({{llang|en|purine}})은 [[피리미딘]] 고리와 [[이미다졸]] 고리가 융합된 두 개의 고리 구조를 특징으로 하는 분자식이 C<sub>5</sub>H<sub>4</sub>N<sub>4</sub>인 [[방향족성|방향족]] [[헤테로고리 화합물|헤테로고리]] [[유기 화합물]]이다. 퓨린은 수용성이다. 퓨린이란 용어는 또한 치환된 퓨린 및 퓨린의 [[호변이성질체]]를 포함하는 보다 넓은 의미로도 사용된다. 퓨린은 자연에서 가장 널리 생성되는 [[질소]]를 함유하고 있는 헤테로고리 화합물이다.<ref>{{cite journal|last1=Rosemeyer|first1=Helmut|title=The Chemodiversity of Purine as a Constituent of Natural Products|journal=Chemistry & Biodiversity|date=March 2004|volume=1|issue=3|pages=361–401|doi=10.1002/cbdv.200490033|pmid=17191854}}</ref> |
|||
이외에도 퓨린 유도체는 NAD, FAD 등의 [[조효소]]에도 구성성분으로 존재한다. 푸린은 몸 밖으로 배출되기 위해 요산(uric acid) 형태로 변환되는데 과도한 요산은 관절염 등의 질병을 일으킬 수 있다. |
|||
퓨린은 육류 및 육류 제품 특히 [[간]], [[콩팥]]과 같은 내부 장기에서 고농도로 발견된다. 일반적으로 식물성 식단에는 퓨린의 함량이 낮다.<ref>{{cite web|url=http://www.dietaryfiberfood.com/purine-food.php |title=Gout: List of Foods High and Low in Purine Content |website=Dietaryfiberfood.com |date=2016-04-08 |accessdate=2016-07-16}}</ref> 퓨린의 함량이 높은 공급원의 예로는 [[스위트브레드]], [[멸치]], [[정어리]], 간, 소의 콩팥, [[뇌]], [[고기 추출물]](예: 옥소, 보브릴), [[청어]], [[고등어]], [[가리비]], [[맥주]]([[효모]]로부터 유래), [[그레이비]] 등이 있다. |
|||
== 구조 == |
|||
푸린 분자는 하나의 [[피리미딘]] 고리와 하나의 [[이미다졸]] 고리가 탄소-탄소 결합 하나를 공유하는 구조를 하고 있다. 분자식은 C<sub>5</sub>H<sub>4</sub>N<sub>4</sub>이며, 고리를 구성하는 탄소 원자 5개와 질소 원자 4개 간의 결합 전체에 걸쳐 단일 결합과 이중 결합의 공명이 일어나는 방향족 화합물이다. |
|||
붉은 고기, [[쇠고기]], [[돼지고기]], [[가금류]], 물고기, [[해산물]], [[아스파라거스]], [[콜리플라워]], [[시금치]], [[식용 버섯]], [[완두]], [[렌즈콩]], [[콩]], [[오트밀]], [[속겨]], 밀배아 등에도 적당한 양의 퓨린이 함유되어 있다.<ref>{{cite web|url=http://www.healthcastle.com/gout.shtml |title=Gout Diet: What Foods To Avoid |website=Healthcastle.com |date= |accessdate=2016-07-16}}</ref> |
|||
== 퓨린 유도체의 종류 == |
|||
[[파일:Purines.svg]]<br /> |
|||
[[핵염기]]는 퓨린 계열 염기와 [[피리미딘]] 계열의 염기로 구성된다. [[DNA]]의 빌딩 블록인 4가지 [[디옥시리보뉴클레오타이드]]들 중 2가지([[디옥시아데노신 일인산]], [[디옥시구아노신 일인산]]) 및 [[RNA]]의 빌딩 블록인 4가지 [[리보뉴클레오타이드]]들 중 2가지([[아데노신 일인산]], [[구아노신 일인산]])는 퓨린 뉴클레오타이드이다. DNA와 RNA를 생성하기 위해, 세포에서 퓨린 및 피리미딘 둘 다 대략 동인한 양으로 필요하다. 퓨린과 피리미딘은 둘 다 자가억제 및 활성화된다. 퓨린이 생성되면 더 많은 퓨린을 생성하기 위해 필요한 효소들을 저해한다. 이러한 자가억제는 또한 피리미딘을 생성하기 위해 필요한 효소들을 활성화시키기 때문에 일어난다. 피리미딘도 동시에 유사한 방식으로 자가억제하고 퓨린 생성을 활성화시킨다. 이 때문에 세포 내에 항상 거의 같은 양의 퓨린과 피리미딘이 존재한다.<ref>{{Cite book|title=Textbook of Medical Physiology|url=https://archive.org/details/textbookmedicalp00acgu|url-access=limited|last=Guyton|first=Arthur C.|publisher=Elsevier|year=2006|isbn=978-0-7216-0240-0|location=Philadelphia, PA|page=[https://archive.org/details/textbookmedicalp00acgu/page/n71 37]}}</ref> |
|||
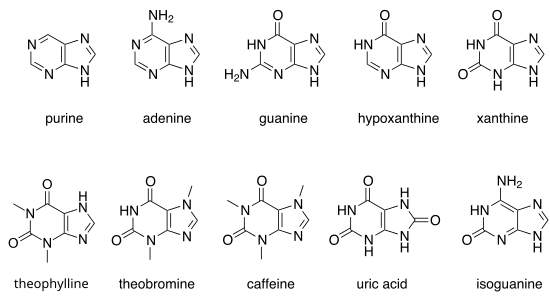
퓨린의 고리를 구성하는 원자와 결합한 수소 원자가 다른 원자로 치환되면 다양한 [[유도체]]가 만들어지는데, 생물체에 존재하는 퓨린 유도체로는 [[핵산]]의 염기인 [[아데닌]](2)과 [[구아닌]](3)<ref>Peter Vollhardt, Neil Schore, ''Organic Chemistry : structure and function'' 6th ed., New York: W.H.Freeman and Company, 2011, p.1241.</ref>, 이들의 분해 과정 중간에 생성되는 [[하이포잔틴]](4)과 [[잔틴]](5)<ref>Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, ''Biochemistry'' 6th ed., New York: W.H.Freeman and Company, 2007, pp.725-726.</ref>, [[카카오]]를 비롯한 많은 식물에 포함되어 있으며<ref>{{웹 인용 |url=http://www.ars-grin.gov/cgi-bin/duke/chemical.pl?THEOBROMINE# |제목=보관된 사본 |확인날짜=2012-05-02 |보존url=https://web.archive.org/web/20001206051400/http://www.ars-grin.gov/cgi-bin/duke/chemical.pl?THEOBROMINE# |보존날짜=2000-12-06 |url-status=dead }}</ref> 생물체의 대사 속도를 증가시켜 각성 작용을 하는 [[테오브로민]](6)<ref>Peter Vollhardt, Neil Schore, 앞의 책, p.1194.</ref> 및 [[카페인]](7)<ref>위의 책, pp.974-975.</ref>, [[조류]]나 [[파충류]]의 체내에서 [[단백질]]의 최종 대사 산물인 [[요산]](8)<ref>John McMurry, ''Organic Chemistry: A Biological Approach'', Belmont: Thomson Brooks/Cole, 2007, p.827.</ref>, [[DNA]]가 산화로 손상되어 생성되며 [[돌연변이]]를 일으키는 [[아이소구아닌]](9)<ref>X L Yang, H Sugiyama, S Ikeda, I Saito, and A H Wang, "Structural studies of a stable parallel-stranded DNA duplex incorporating isoguanine:cytosine and isocytosine:guanine basepairs by nuclear magnetic resonance spectroscopy", ''Biophysical Journal'' 1998 September; 75(3), pp.1163–1171.</ref> 등이 있다. |
|||
== 특성 == |
|||
퓨린은 매우 약한 산(pK<sub>a</sub> 2.39)이며, 약한 염기(pK<sub>a</sub> 8.93)이다.<ref>{{cite book|author1=F. Seela|display-authors=etal|editor1-last=Ernst Schaumann|title=Houben-Weyl Methods of Organic Chemistry Vol. E 9b/2, 4th Edition Supplement: Hetarenes III (Six-Membered Rings and Larger Hetero-Rings with Maximum Unsaturation) - Part 2b|date=2014|isbn=9783131815040|page=310|url=https://books.google.com/books?id=wy2GAwAAQBAJ&pg=PA310}}</ref> 물에 용해되면 [[수소 이온 농도 지수|pH]]는 이 두 pKa 값 사이의 중간값이 된다. |
|||
== 주목할만한 퓨린 == |
|||
자연적으로 생성되는 많은 퓨린들이 있다. 이들은 [[핵염기]]인 ('''2''') [[아데닌]]과 ('''3''') [[구아닌]]을 포함한다. [[DNA]]에서 아데닌은 [[상보성 (분자생물학)|상보적인]] [[피리미딘]]인 [[티민]]과, 구아닌은 [[사이토신]]과 [[수소 결합]]을 형성한다. 이들은 상보적인 [[염기쌍]]이라고 불린다. RNA에서 아데닌은 티민 대신에 [[유라실]]과 상보적인 염기쌍을 형성한다. |
|||
다른 주목할만한 퓨린으로는 ('''4''') [[하이포잔틴]], ('''5''') [[잔틴]], ('''6''') [[테오브로민]], ('''7''') [[카페인]], ('''8''') [[요산]], ('''9''') [[아이소구아닌]]이 있다. |
|||
{| |
|||
|[[파일:purines.svg|섬네일|왼쪽|550px|퓨린 계열의 화합물]] |
|||
|} |
|||
=== N9 치환 유도체 === |
=== N9 치환 유도체 === |
||
퓨린 고리의 9번 질소 원자(N9)에 결합된 수소 원자가 다른 원자 혹은 원자단으로 치환된 많은 화합물들은 생물체 내에서, 혹은 약물로써 다양한 기능을 한다. |
퓨린 고리의 9번 질소 원자(N9)에 결합된 수소 원자가 다른 원자 혹은 원자단으로 치환된 많은 화합물들은 생물체 내에서, 혹은 약물로써 다양한 기능을 한다. [[아데노신 삼인산]](ATP)과 [[구아노신 삼인산]](GTP)은 생물체의 에너지 전달에 필수적인 분자이며,<ref>Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, 앞의 책, pp.412-413.</ref> 이 분자들에서 인산기 2개를 떼어낸 [[아데노신 일인산]](AMP)과 [[구아노신 일인산]](GMP) 및 [[리보스]]가 아닌 [[디옥시리보스]] 치환기를 갖는 dAMP와 dGMP는 각각 유전 정보를 저장하는 [[RNA]]와 [[DNA]]의 구성요소인 [[뉴클레오타이드]]의 일종이다.<ref>John McMurry, 앞의 책, p.981.</ref> [[NADH]], [[NADPH]], [[FADH2|FADH<sub>2</sub>]]는 생물체 내 [[산화환원 반응]]에서 [[전자공여체]]로 쓰인다.<ref>위의 책, pp.802-803.</ref> |
||
<gallery> |
<gallery> |
||
파일: |
파일:Adenosintriphosphat protoniert.svg|ATP |
||
파일:Guanosintriphosphat protoniert.svg|GTP |
파일:Guanosintriphosphat protoniert.svg|GTP |
||
파일:DAMP chemical structure.png|dAMP |
파일:DAMP chemical structure.png|dAMP |
||
파일:NAD+ |
파일:NAD+ phys.svg|NADH의 산화된 형태인 NAD<sup>+</sup> |
||
파일:Flavin adenine dinucleotide.png| |
파일:Flavin adenine dinucleotide.png|FADH<sub>2</sub>의 산화된 형태인 FAD |
||
</gallery> |
</gallery> |
||
N9에 [[아릴기]]가 치환된 많은 화합물은 체내에 들어갔을 때 항바이러스 및 항암 효과를 갖고 있다는 사실이 알려져 있다.<ref>Hong-Ying Niu, Chao Xia 외 6명, "CuBr Catalyzed C–N cross coupling reaction of purines and diaryliodonium salts to 9-arylpurines", ''Organic & Biomolecular Chemistry'' Issue 14, 2011, pp.5039-5042에서 재인용.</ref> |
N9에 [[아릴기]]가 치환된 많은 화합물은 체내에 들어갔을 때 항바이러스 및 항암 효과를 갖고 있다는 사실이 알려져 있다.<ref>Hong-Ying Niu, Chao Xia 외 6명, "CuBr Catalyzed C–N cross coupling reaction of purines and diaryliodonium salts to 9-arylpurines", ''Organic & Biomolecular Chemistry'' Issue 14, 2011, pp.5039-5042에서 재인용.</ref> |
||
== |
== 기능 == |
||
[[File:Blausen 0323 DNA Purines.png|thumb|The main purine-derived [[nucleobase]]s.]] |
|||
생물체 내에서, 퓨린 유도체 염기를 포함하는 뉴클레오타이드는 5-phosphoribosyl-1-pyrophosphate(PRPP)로부터 생합성된다. [[리보스]]의 1번 탄소에 결합되어 있던 [[피로인산]]기가 질소 원자로 치환되고, 9단계에 걸쳐 이미다졸 고리와 피리미딘 고리를 구성한다. 푸린 고리가 완성된 분자의 이름은 이노신산(IMP)이며, 이노신산은 합성효소인 adenylosuccinate synthase 및 GMP synthetase의 작용으로 추가적인 몇 단계의 반응을 거쳐 각각 아데닐산(AMP) 또는 구아닐산(GMP)로 변환될 수 있다.<ref>Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, 위의 책, pp.714-718.</ref><br /> |
|||
DNA 및 RNA에서 퓨린(아데닌 및 구아닌)의 중요한 역할 외에도, 퓨린은 [[아데노신 삼인산|ATP]], [[구아노신 삼인산|GTP]], [[고리형 아데노신 일인산|cAMP]], [[NADH]], [[조효소 A]]와 같은 여러 다른 중요한 생체분자에서 주요 구성 성분이다. ('''1''') 퓨린 그 자체는 자연에서 발견되지 않았지만, [[유기 합성]]에 의해 만들어질 수 있다. |
|||
[[파일:Nucleotides syn1.png|가운데]] |
|||
이들은 또한 퓨린작동성 수용체에 작용하여 [[신경전달물질]]로 직접 작용할 수 있다. 아데노신은 아데노신 수용체를 활성화시킨다. |
|||
퓨린은 1899년 독일의 화학자인 [[에밀 피셔]]에 의해 처음 인공적으로 합성되었다. 피셔의 방법에서 합성 시작물질은 요산(8)이며, 2,6,8-삼염화퓨린(10)과 2,6-이아이오딘화퓨린(11)을 거쳐 퓨린(1)으로 환원된다.<ref>Helmut Rosemeyer, 앞의 논문에서 재인용.</ref> |
|||
<br /> |
|||
[[파일:FischerPurineSynthesis.gif|가운데]] |
|||
== 역사 == |
|||
1972년 도쿄 대학의 Hiroshi Yamade와 Toshihiko Okamoto는 열린 용기에서 포름아미드를 170-190℃의 온도로 28시간 동안 가열하여 푸린을 71%의 수득률로 얻어냈다.<ref>Hiroshi Yamade, Toshihiko Okamoto, "A One-step Synthesis of Purine Ring from Formamide", ''Chemical and Pharmaceutical Bulletin'' Vol. 20, No. 3, 1972, pp.623-624.</ref> |
|||
퓨린(purine) ("순수한 오줌(pure urine)"에서 유래)<ref name="McGuigan">{{cite book|url=http://www.ebooksread.com/authors-eng/hugh-mcguigan/an-introduction-to-chemical-pharmacology-pharmacodynamics-in-relation-to--goo/page-20-an-introduction-to-chemical-pharmacology-pharmacodynamics-in-relation-to--goo.shtml|title=An Introduction To Chemical Pharmacology|last=McGuigan|first=Hugh|year=1921|publisher=P. Blakiston's Sons & Co.|page=283|accessdate=July 18, 2012}}</ref>이라는 단어는 1884년에 [[독일]]의 [[화학자]] [[에밀 피셔]]가 만들었다.<ref>{{cite journal|first=Emil |last=Fischer |date=1884 |url=https://babel.hathitrust.org/cgi/pt?id=uiug.30112025692879;view=1up;seq=342 |title=Ueber die Harnsäure. I. |trans-title=On uric acid. I. |journal=Berichte der Deutschen Chemischen Gesellschaft |volume=17 |pages=328–338 |doi=10.1002/cber.18840170196}} {{open access}}<br>[https://babel.hathitrust.org/cgi/pt?id=uiug.30112025692879;view=1up;seq=343 From p. 329]: ''"Um eine rationelle Nomenklatur der so entstehenden zahlreichen Substanzen zu ermöglichen, betrachte ich dieselben als Abkömmlinge der noch unbekannten Wasserstoffverbindung CH<sub>3</sub>.C<sub>5</sub>N<sub>4</sub>H<sub>3</sub> and nenne die letztere Methylpurin."'' (In order to make possible a rational nomenclature for the numerous existing substances, I regarded them as derivatives of a still unknown hydrogen compound, CH<sub>3</sub>.C<sub>5</sub>N<sub>4</sub>H<sub>3</sub>, and call the latter "methylpurine".)</ref><ref name="Fischer1898">{{cite journal|first=Emil |last=Fischer |date=1898 |url=https://babel.hathitrust.org/cgi/pt?id=hvd.cl1i1u;view=1up;seq=14 |title=Ueber das Purin und seine Methylderivate |trans-title=On purine and its methyl derivatives |journal=Berichte der Deutschen Chemischen Gesellschaft |volume=31 |issue=3 |pages=2550–2574 |doi=10.1002/cber.18980310304}} {{open access}}<br>[https://babel.hathitrust.org/cgi/pt?id=hvd.cl1i1u;view=1up;seq=14 From p. 2550]: ''"…hielt ich es für zweckmäßig, alle diese Produkte ebenso wie die Harnsäure als Derivate der sauerstofffreien Verbindung C<sub>5</sub>H<sub>4</sub>N<sub>4</sub> zu betrachten, und wählte für diese den Namen Purin, welcher aus den Wörtern purum und uricum kombiniert war."'' (…I regarded it as expedient to consider all of these products, just like uric acid, as derivatives of the oxygen-free compound C<sub>5</sub>H<sub>4</sub>N<sub>4</sub>, and chose for them the name "purine", which was formed from the [Latin] words ''purum'' and ''uricum''.)</ref> 에밀 피셔는 1898년에 처음으로 퓨린을 합성했다.<ref name="Fischer1898" /> 반응의 출발 물질은 ('''8''') [[요산]]이었다. 요산은 1776년에 [[칼 빌헬름 셸레]]에 의해 [[신장 결석]]에서 분리되었다.<ref>{{cite journal | last1 = Scheele | first1 = C. W. | year = 1776 | title = Examen chemicum calculi urinari | trans-title = A chemical examination of kidney stones | url = | journal = Opuscula | volume = 2 | issue = | page = 73 }}</ref> ('''8''') 요산을 오염화 인(PCl<sub>5</sub>)과 반응시켜 ('''10''') 2,6,8-트라이클로로퓨린을 얻었고, 이를 [[아이오딘화 수소]](HI)와 PH<sub>4</sub>I로 전환시켜, ('''11''') 2,6-다이아이오도퓨린을 얻었다. [[아연]] 분말을 사용하여 생성물을 ('''1''') 퓨린으로 환원시켰다. |
|||
<br /> |
|||
{| |
|||
[[파일:Purinesynthesis.gif|가운데]] |
|||
|[[파일:FischerPurineSynthesis.gif|섬네일|왼쪽|800px|피셔가 고안한 퓨린 합성 과정]] |
|||
|} |
|||
== 물질대사 == |
|||
{{main article|퓨린 대사}} |
|||
많은 생물들이 퓨린을 합성하고 분해하기 위한 [[대사 경로]]를 가지고 있다. |
|||
퓨린은 [[뉴클레오사이드]](핵염기와 [[리보스]]가 결합됨)로 생물학적으로 합성된다. |
|||
다양한 세포 내 대사 과정, 특히 [[DNA]] 및 [[RNA]]와 관련된 대사 과정에 결함이 있으면 변형된 퓨린 뉴클레오타이드가 축적된다. 생존하기 위해, 생물은 다수의 (디옥시)퓨린 포스포하이드롤레이스를 가지고 있으며, 이 효소는 이들 퓨린 유도체들을 [[가수분해]]하여 활성 [[뉴클레오사이드 삼인산|NTP]] 및 [[디옥시뉴클레오사이드 삼인산|dNTP]] 풀에서 이들을 제거한다. 퓨린 염기의 탈아미노화는 [[이노신 삼인산|ITP]], dITP, [[잔토신 삼인산|XTP]], dXTP와 같은 뉴클레오사이드의 축적을 초래할 수 있다.<ref name="pmid 22531138">{{cite journal | last1 = Davies | first1 = O. | last2 = Mendes | first2 = P. | last3 = Smallbone | first3 = K. | last4 = Malys | first4 = N. | title = Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism | journal = BMB Reports | volume = 45 | issue = 4 | pages = 259–264 | year = 2012 | pmid = 22531138| doi = 10.5483/BMBRep.2012.45.4.259 | doi-access = free }}</ref> |
|||
퓨린의 생성 및 분해를 조절하는 효소의 결함은 세포의 DNA 서열을 심하게 변화시킬 수 있으며, 이는 퓨린 대사 효소의 특정 유전자 변이체를 가지고 있는 사람들이 일부 유형의 [[암]]에 대한 발병 위험이 더 높은 이유를 말해준다. |
|||
=== 통풍과의 관계 === |
|||
{{see also|통풍}} |
|||
[[육류]] 및 [[해산물]]의 섭취량이 많을수록 [[통풍]]의 위험이 증가하는 반면, [[유제품]]의 섭취량이 많을수록 통풍의 위험이 감소하는 것과 관련이 있다. 퓨린이 풍부한 채소나 단백질의 적당한 섭취는 통풍의 위험이 증가하는 것과 관련이 없다.<ref>{{cite journal|title=Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men|doi=10.1056/NEJMoa035700|pmid=15014182|volume=350|issue=11|journal=New England Journal of Medicine|pages=1093–1103|year=2004|last1=Choi|first1=Hyon K.|last2=Atkinson|first2=Karen|last3=Karlson|first3=Elizabeth W.|last4=Willett|first4=Walter|last5=Curhan|first5=Gary}}</ref><ref>{{cite web|url=http://www.ars.usda.gov/is/AR/archive/mar03/osteo0303.htm|publisher=USDA|title=Bone Health|accessdate=2016-07-17}}</ref> [[고요산혈증]]의 위험이 있는 유사한 결과가 발견되었다. |
|||
==실험실에서의 합성== |
|||
[[퓨린 대사]]에서 퓨린의 [[생체내|생체 내]] 합성 외에도, 퓨린은 인위적으로 합성될 수도 있다. |
|||
1972년 도쿄 대학의 야마데 히로시와 오카모토 토시히코는 개방된 용기에서 [[폼아마이드]]를 170-190℃의 온도로 28시간 동안 가열하여 ('''1''') 퓨린을 양호한 수율로 얻어냈다.<ref name="Yamada">{{cite journal|journal=Chemical & Pharmaceutical Bulletin|year=1972|volume=20|page=623|title=A One-step Synthesis of Purine Ring from Formamide|last1=Yamada|first1=H.|last2=Okamoto|first2=T.|doi=10.1248/cpb.20.623|issue=3|url=http://www.journalarchive.jst.go.jp/english/jnlabstract_en.php?cdjournal=cpb1958&cdvol=20&noissue=3&startpage=623|archive-url=http://arquivo.pt/wayback/20160516170519/http://www.journalarchive.jst.go.jp/english/jnlabstract_en.php?cdjournal=cpb1958&cdvol=20&noissue=3&startpage=623|url-status=dead|archivedate=2016-05-16|doi-access=free}}</ref> |
|||
{| |
|||
|[[파일:Purinesynthesis.gif|섬네일|왼쪽|300px|퓨린 합성]] |
|||
|} |
|||
이 반응과 다른 반응들은 [[생명의 기원]]과 관련하여 논의되었다.<ref name="Saladino">{{cite journal|last1=Saladino|first1=Raffaele|title=About a Formamide-Based Origin of Informational Polymers: Syntheses of Nucleobases and Favourable Thermodynamic Niches for Early Polymers |journal=Origins of Life and Evolution of Biospheres|volume=36|issue=5–6|year=2006|pmid=17136429|pages=523–531|doi=10.1007/s11084-006-9053-2|last2=Crestini|first2=Claudia|last3=Ciciriello|first3=Fabiana|last4=Costanzo|first4=Giovanna|last5=Mauro|first5=Ernesto|bibcode = 2006OLEB...36..523S |display-authors=etal}}</ref> |
|||
오로(Oro), 오겔(Orgel) 및 동료들은 4개의 [[사이안화 수소]](HCN) 분자가 사량체화되어 ('''12''') [[다이아미노말레오나이트릴|다이아미노말레오다이나이트릴]]을 형성하며, 이는 거의 모든 자연적으로 생성되는 퓨린으로 전환될 수 있음을 보여주었다.<ref>{{Cite journal |last1=Sanchez |first1=R. A. |last2=Ferris |first2=J. P. |last3=Orgel |first3=L. E. | journal = Journal of Molecular Biology | year = 1967 | volume = 30 | pages = 223–253 | pmid = 4297187 | title = Studies in prebiotic synthesis. II. Synthesis of purine precursors and amino acids from aqueous hydrogen cyanide | issue = 2| doi = 10.1016/S0022-2836(67)80037-8}}</ref><ref>{{cite journal|last1=Ferris|first1=James P.|last2=Orgel|first2=L. E.|title=An Unusual Photochemical Rearrangement in the Synthesis of Adenine from Hydrogen Cyanide|journal=Journal of the American Chemical Society|date=March 1966|volume=88|issue=5|page=1074|doi=10.1021/ja00957a050}}</ref><ref>{{Cite journal | last1 = Ferris | first1 = J. P. | last2 = Kuder | first2 = J. E. | last3 = Catalano | first3 = O. W. | journal = Science | year = 1969 | volume = 166 | pages = 765–766 | bibcode = 1969Sci...166..765F | title = Photochemical Reactions and the Chemical Evolution of Purines and Nicotinamide Derivatives | doi = 10.1126/science.166.3906.765 | pmid = 4241847 | issue = 3906}}</ref><ref>{{Cite journal | last1 = Oro | first1 = J. | last2 = Kamat | first2 = J. S. | journal = Nature | year = 1961 | volume = 190 | pages = 442–443 | bibcode = 1961Natur.190..442O | title = Amino-acid Synthesis from Hydrogen Cyanide under Possible Primitive Earth Conditions | doi = 10.1038/190442a0 | pmid = 13731262 | issue = 4774}}</ref><ref>{{cite book |last1=Bauer |first1=Wolfgang |title=Houben-Weyl Methods of Organic Chemistry Vol. E 5, 4th Edition Supplement |date=1985 |publisher=Thieme Georg Verlag |isbn=9783131811547 |page=1547}}</ref> 예를 들어, 5개의 HCN 분자 발열 반응에서 응축되어 특히 [[암모니아]]의 존재 하에서 [[아데닌]]을 생성한다. |
|||
{| |
|||
|[[파일:Basicpurines.png|섬네일|왼쪽|550px|퓨린 유도체의 합성]] |
|||
|} |
|||
트라우베 퓨린 합성(1900)은 [[아민]]-치환된 [[피리미딘]]과 [[폼산]] 사이의 고전적인 반응으로 빌헬름 트라우베(Wilhelm Traube)의 이름을 따서 명명되었다.<ref>{{cite book |title=Organic Syntheses Based on Name Reactions |first1=Alfred |last1=Hassner |first2=C. |last2=Stumer |publisher=Elsevier |year=2002 |edition=2nd |isbn=0-08-043259-X}}</ref> |
|||
{| |
|||
|[[파일:TraubePurineSynthesis.svg|섬네일|왼쪽|400px|트라우베 퓨린 합성]] |
|||
|} |
|||
== 반응 == |
== 반응 == |
||
항암제 등의 약물 합성을 위한 반응물로 퓨린 유도체가 사용되는데, [[아릴기]]가 N9 원자에 치환된 |
항암제 등의 약물 합성을 위한 반응물로 퓨린 유도체가 사용되는데, [[아릴기]]가 N9 원자에 치환된 퓨린 유도체를 합성하는 방법으로 피리미딘 유도체에서 시작하여 고리화 반응을 통해 아릴기가 치환된 이미다졸 부분(7,8,9번 원자)을 합성하는 방법이 알려져 있다. 하지만 이 방법은 여러 단계를 필요로 한다.<ref>Hong-Ying Niu, Chao Xia 외 6명, 앞의 논문에서 재인용.</ref> 2003년, 노르웨이 오슬로 대학의 Anne Kristin Bakkestuen과 Lise-Lotte Gundersen이 아세트산구리(copper(II) acetate) 존재 하에서 N9 원자에 아무것도 치환되지 않은 퓨린 유도체에 아릴기를 직접 치환하는 데 성공하였다.<ref>Anne Kristin Bakkestuen, Lise-Lotte Gundersen, "Regioselective N-9 arylation of purines employing arylboronic acids in the presence of Cu(II)", ''Tetrahedron Letters'' Volume 44, Issue 16, 2003, pp.3359–3362.</ref> |
||
== 같이 보기 == |
|||
* [[퓨리논]] |
|||
* [[피리미딘]] |
|||
* [[단순 방향족 고리]] |
|||
* [[전이 (유전학)]] |
|||
* [[전환 (유전학)]] |
|||
* [[통풍]] – 퓨린 대사 장애 |
|||
== 각주 == |
== 각주 == |
||
{{위키공용분류}} |
{{위키공용분류}} |
||
{{각주|30em}} |
|||
<references /> |
|||
== 외부 링크 == |
|||
* [http://www.dietaryfiberfood.com/purine-food.php Purine Content in Food] |
|||
{{핵염기}} |
{{핵염기}} |
||
{{전거 통제}} |
{{전거 통제}} |
||
[[분류:퓨린| ]] |
[[분류:퓨린| ]] |
||
[[분류:단순 방향족 고리]] |
[[분류:단순 방향족 고리]] |
||
[[분류:1898년 과학]] |
|||
2020년 10월 5일 (월) 15:39 판

| |

| |

| |
| 일반적인 성질 | |
|---|---|
| IUPAC 이름 | 9H-purine |
| 화학식 | C5H4N4 |
| CAS 번호 | 120-73-0 |
| PubChem | 1044 |
| ChemSpider | 1015 |
| 물리적 성질 | |
| 분자량 | 120.12 g/mol |
| 녹는점 | 487.15 K 214 °C 417.2 °F |
| 열화학적 성질 | |
| 안전성 | |
퓨린(영어: purine)은 피리미딘 고리와 이미다졸 고리가 융합된 두 개의 고리 구조를 특징으로 하는 분자식이 C5H4N4인 방향족 헤테로고리 유기 화합물이다. 퓨린은 수용성이다. 퓨린이란 용어는 또한 치환된 퓨린 및 퓨린의 호변이성질체를 포함하는 보다 넓은 의미로도 사용된다. 퓨린은 자연에서 가장 널리 생성되는 질소를 함유하고 있는 헤테로고리 화합물이다.[1]
퓨린은 육류 및 육류 제품 특히 간, 콩팥과 같은 내부 장기에서 고농도로 발견된다. 일반적으로 식물성 식단에는 퓨린의 함량이 낮다.[2] 퓨린의 함량이 높은 공급원의 예로는 스위트브레드, 멸치, 정어리, 간, 소의 콩팥, 뇌, 고기 추출물(예: 옥소, 보브릴), 청어, 고등어, 가리비, 맥주(효모로부터 유래), 그레이비 등이 있다.
붉은 고기, 쇠고기, 돼지고기, 가금류, 물고기, 해산물, 아스파라거스, 콜리플라워, 시금치, 식용 버섯, 완두, 렌즈콩, 콩, 오트밀, 속겨, 밀배아 등에도 적당한 양의 퓨린이 함유되어 있다.[3]
핵염기는 퓨린 계열 염기와 피리미딘 계열의 염기로 구성된다. DNA의 빌딩 블록인 4가지 디옥시리보뉴클레오타이드들 중 2가지(디옥시아데노신 일인산, 디옥시구아노신 일인산) 및 RNA의 빌딩 블록인 4가지 리보뉴클레오타이드들 중 2가지(아데노신 일인산, 구아노신 일인산)는 퓨린 뉴클레오타이드이다. DNA와 RNA를 생성하기 위해, 세포에서 퓨린 및 피리미딘 둘 다 대략 동인한 양으로 필요하다. 퓨린과 피리미딘은 둘 다 자가억제 및 활성화된다. 퓨린이 생성되면 더 많은 퓨린을 생성하기 위해 필요한 효소들을 저해한다. 이러한 자가억제는 또한 피리미딘을 생성하기 위해 필요한 효소들을 활성화시키기 때문에 일어난다. 피리미딘도 동시에 유사한 방식으로 자가억제하고 퓨린 생성을 활성화시킨다. 이 때문에 세포 내에 항상 거의 같은 양의 퓨린과 피리미딘이 존재한다.[4]
특성
퓨린은 매우 약한 산(pKa 2.39)이며, 약한 염기(pKa 8.93)이다.[5] 물에 용해되면 pH는 이 두 pKa 값 사이의 중간값이 된다.
주목할만한 퓨린
자연적으로 생성되는 많은 퓨린들이 있다. 이들은 핵염기인 (2) 아데닌과 (3) 구아닌을 포함한다. DNA에서 아데닌은 상보적인 피리미딘인 티민과, 구아닌은 사이토신과 수소 결합을 형성한다. 이들은 상보적인 염기쌍이라고 불린다. RNA에서 아데닌은 티민 대신에 유라실과 상보적인 염기쌍을 형성한다.
다른 주목할만한 퓨린으로는 (4) 하이포잔틴, (5) 잔틴, (6) 테오브로민, (7) 카페인, (8) 요산, (9) 아이소구아닌이 있다.
 |
N9 치환 유도체
퓨린 고리의 9번 질소 원자(N9)에 결합된 수소 원자가 다른 원자 혹은 원자단으로 치환된 많은 화합물들은 생물체 내에서, 혹은 약물로써 다양한 기능을 한다. 아데노신 삼인산(ATP)과 구아노신 삼인산(GTP)은 생물체의 에너지 전달에 필수적인 분자이며,[6] 이 분자들에서 인산기 2개를 떼어낸 아데노신 일인산(AMP)과 구아노신 일인산(GMP) 및 리보스가 아닌 디옥시리보스 치환기를 갖는 dAMP와 dGMP는 각각 유전 정보를 저장하는 RNA와 DNA의 구성요소인 뉴클레오타이드의 일종이다.[7] NADH, NADPH, FADH2는 생물체 내 산화환원 반응에서 전자공여체로 쓰인다.[8]
-
ATP
-
GTP
-
dAMP
-
NADH의 산화된 형태인 NAD+
-
FADH2의 산화된 형태인 FAD
N9에 아릴기가 치환된 많은 화합물은 체내에 들어갔을 때 항바이러스 및 항암 효과를 갖고 있다는 사실이 알려져 있다.[9]
기능

DNA 및 RNA에서 퓨린(아데닌 및 구아닌)의 중요한 역할 외에도, 퓨린은 ATP, GTP, cAMP, NADH, 조효소 A와 같은 여러 다른 중요한 생체분자에서 주요 구성 성분이다. (1) 퓨린 그 자체는 자연에서 발견되지 않았지만, 유기 합성에 의해 만들어질 수 있다.
이들은 또한 퓨린작동성 수용체에 작용하여 신경전달물질로 직접 작용할 수 있다. 아데노신은 아데노신 수용체를 활성화시킨다.
역사
퓨린(purine) ("순수한 오줌(pure urine)"에서 유래)[10]이라는 단어는 1884년에 독일의 화학자 에밀 피셔가 만들었다.[11][12] 에밀 피셔는 1898년에 처음으로 퓨린을 합성했다.[12] 반응의 출발 물질은 (8) 요산이었다. 요산은 1776년에 칼 빌헬름 셸레에 의해 신장 결석에서 분리되었다.[13] (8) 요산을 오염화 인(PCl5)과 반응시켜 (10) 2,6,8-트라이클로로퓨린을 얻었고, 이를 아이오딘화 수소(HI)와 PH4I로 전환시켜, (11) 2,6-다이아이오도퓨린을 얻었다. 아연 분말을 사용하여 생성물을 (1) 퓨린으로 환원시켰다.
 |
물질대사
많은 생물들이 퓨린을 합성하고 분해하기 위한 대사 경로를 가지고 있다.
퓨린은 뉴클레오사이드(핵염기와 리보스가 결합됨)로 생물학적으로 합성된다.
다양한 세포 내 대사 과정, 특히 DNA 및 RNA와 관련된 대사 과정에 결함이 있으면 변형된 퓨린 뉴클레오타이드가 축적된다. 생존하기 위해, 생물은 다수의 (디옥시)퓨린 포스포하이드롤레이스를 가지고 있으며, 이 효소는 이들 퓨린 유도체들을 가수분해하여 활성 NTP 및 dNTP 풀에서 이들을 제거한다. 퓨린 염기의 탈아미노화는 ITP, dITP, XTP, dXTP와 같은 뉴클레오사이드의 축적을 초래할 수 있다.[14]
퓨린의 생성 및 분해를 조절하는 효소의 결함은 세포의 DNA 서열을 심하게 변화시킬 수 있으며, 이는 퓨린 대사 효소의 특정 유전자 변이체를 가지고 있는 사람들이 일부 유형의 암에 대한 발병 위험이 더 높은 이유를 말해준다.
통풍과의 관계
육류 및 해산물의 섭취량이 많을수록 통풍의 위험이 증가하는 반면, 유제품의 섭취량이 많을수록 통풍의 위험이 감소하는 것과 관련이 있다. 퓨린이 풍부한 채소나 단백질의 적당한 섭취는 통풍의 위험이 증가하는 것과 관련이 없다.[15][16] 고요산혈증의 위험이 있는 유사한 결과가 발견되었다.
실험실에서의 합성
퓨린 대사에서 퓨린의 생체 내 합성 외에도, 퓨린은 인위적으로 합성될 수도 있다.
1972년 도쿄 대학의 야마데 히로시와 오카모토 토시히코는 개방된 용기에서 폼아마이드를 170-190℃의 온도로 28시간 동안 가열하여 (1) 퓨린을 양호한 수율로 얻어냈다.[17]
 |
이 반응과 다른 반응들은 생명의 기원과 관련하여 논의되었다.[18]
오로(Oro), 오겔(Orgel) 및 동료들은 4개의 사이안화 수소(HCN) 분자가 사량체화되어 (12) 다이아미노말레오다이나이트릴을 형성하며, 이는 거의 모든 자연적으로 생성되는 퓨린으로 전환될 수 있음을 보여주었다.[19][20][21][22][23] 예를 들어, 5개의 HCN 분자 발열 반응에서 응축되어 특히 암모니아의 존재 하에서 아데닌을 생성한다.
 |
트라우베 퓨린 합성(1900)은 아민-치환된 피리미딘과 폼산 사이의 고전적인 반응으로 빌헬름 트라우베(Wilhelm Traube)의 이름을 따서 명명되었다.[24]
 |
반응
항암제 등의 약물 합성을 위한 반응물로 퓨린 유도체가 사용되는데, 아릴기가 N9 원자에 치환된 퓨린 유도체를 합성하는 방법으로 피리미딘 유도체에서 시작하여 고리화 반응을 통해 아릴기가 치환된 이미다졸 부분(7,8,9번 원자)을 합성하는 방법이 알려져 있다. 하지만 이 방법은 여러 단계를 필요로 한다.[25] 2003년, 노르웨이 오슬로 대학의 Anne Kristin Bakkestuen과 Lise-Lotte Gundersen이 아세트산구리(copper(II) acetate) 존재 하에서 N9 원자에 아무것도 치환되지 않은 퓨린 유도체에 아릴기를 직접 치환하는 데 성공하였다.[26]
같이 보기
각주
- ↑ Rosemeyer, Helmut (March 2004). “The Chemodiversity of Purine as a Constituent of Natural Products”. 《Chemistry & Biodiversity》 1 (3): 361–401. doi:10.1002/cbdv.200490033. PMID 17191854.
- ↑ “Gout: List of Foods High and Low in Purine Content”. 《Dietaryfiberfood.com》. 2016년 4월 8일. 2016년 7월 16일에 확인함.
- ↑ “Gout Diet: What Foods To Avoid”. 《Healthcastle.com》. 2016년 7월 16일에 확인함.
- ↑ Guyton, Arthur C. (2006). 《Textbook of Medical Physiology》. Philadelphia, PA: Elsevier. 37쪽. ISBN 978-0-7216-0240-0.
- ↑ F. Seela; 외. (2014). Ernst Schaumann, 편집. 《Houben-Weyl Methods of Organic Chemistry Vol. E 9b/2, 4th Edition Supplement: Hetarenes III (Six-Membered Rings and Larger Hetero-Rings with Maximum Unsaturation) - Part 2b》. 310쪽. ISBN 9783131815040.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, 앞의 책, pp.412-413.
- ↑ John McMurry, 앞의 책, p.981.
- ↑ 위의 책, pp.802-803.
- ↑ Hong-Ying Niu, Chao Xia 외 6명, "CuBr Catalyzed C–N cross coupling reaction of purines and diaryliodonium salts to 9-arylpurines", Organic & Biomolecular Chemistry Issue 14, 2011, pp.5039-5042에서 재인용.
- ↑ McGuigan, Hugh (1921). 《An Introduction To Chemical Pharmacology》. P. Blakiston's Sons & Co. 283쪽. 2012년 7월 18일에 확인함.
- ↑ Fischer, Emil (1884). “Ueber die Harnsäure. I.” [On uric acid. I.]. 《Berichte der Deutschen Chemischen Gesellschaft》 17: 328–338. doi:10.1002/cber.18840170196.

From p. 329: "Um eine rationelle Nomenklatur der so entstehenden zahlreichen Substanzen zu ermöglichen, betrachte ich dieselben als Abkömmlinge der noch unbekannten Wasserstoffverbindung CH3.C5N4H3 and nenne die letztere Methylpurin." (In order to make possible a rational nomenclature for the numerous existing substances, I regarded them as derivatives of a still unknown hydrogen compound, CH3.C5N4H3, and call the latter "methylpurine".) - ↑ 가 나 Fischer, Emil (1898). “Ueber das Purin und seine Methylderivate” [On purine and its methyl derivatives]. 《Berichte der Deutschen Chemischen Gesellschaft》 31 (3): 2550–2574. doi:10.1002/cber.18980310304.

From p. 2550: "…hielt ich es für zweckmäßig, alle diese Produkte ebenso wie die Harnsäure als Derivate der sauerstofffreien Verbindung C5H4N4 zu betrachten, und wählte für diese den Namen Purin, welcher aus den Wörtern purum und uricum kombiniert war." (…I regarded it as expedient to consider all of these products, just like uric acid, as derivatives of the oxygen-free compound C5H4N4, and chose for them the name "purine", which was formed from the [Latin] words purum and uricum.) - ↑ Scheele, C. W. (1776). “Examen chemicum calculi urinari” [A chemical examination of kidney stones]. 《Opuscula》 2: 73.
- ↑ Davies, O.; Mendes, P.; Smallbone, K.; Malys, N. (2012). “Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism”. 《BMB Reports》 45 (4): 259–264. doi:10.5483/BMBRep.2012.45.4.259. PMID 22531138.
- ↑ Choi, Hyon K.; Atkinson, Karen; Karlson, Elizabeth W.; Willett, Walter; Curhan, Gary (2004). “Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men”. 《New England Journal of Medicine》 350 (11): 1093–1103. doi:10.1056/NEJMoa035700. PMID 15014182.
- ↑ “Bone Health”. USDA. 2016년 7월 17일에 확인함.
- ↑ Yamada, H.; Okamoto, T. (1972). “A One-step Synthesis of Purine Ring from Formamide”. 《Chemical & Pharmaceutical Bulletin》 20 (3): 623. doi:10.1248/cpb.20.623. 2016년 5월 16일에 원본 문서에서 보존된 문서.
- ↑ Saladino, Raffaele; Crestini, Claudia; Ciciriello, Fabiana; Costanzo, Giovanna; Mauro, Ernesto; 외. (2006). “About a Formamide-Based Origin of Informational Polymers: Syntheses of Nucleobases and Favourable Thermodynamic Niches for Early Polymers”. 《Origins of Life and Evolution of Biospheres》 36 (5–6): 523–531. Bibcode:2006OLEB...36..523S. doi:10.1007/s11084-006-9053-2. PMID 17136429.
- ↑ Sanchez, R. A.; Ferris, J. P.; Orgel, L. E. (1967). “Studies in prebiotic synthesis. II. Synthesis of purine precursors and amino acids from aqueous hydrogen cyanide”. 《Journal of Molecular Biology》 30 (2): 223–253. doi:10.1016/S0022-2836(67)80037-8. PMID 4297187.
- ↑ Ferris, James P.; Orgel, L. E. (March 1966). “An Unusual Photochemical Rearrangement in the Synthesis of Adenine from Hydrogen Cyanide”. 《Journal of the American Chemical Society》 88 (5): 1074. doi:10.1021/ja00957a050.
- ↑ Ferris, J. P.; Kuder, J. E.; Catalano, O. W. (1969). “Photochemical Reactions and the Chemical Evolution of Purines and Nicotinamide Derivatives”. 《Science》 166 (3906): 765–766. Bibcode:1969Sci...166..765F. doi:10.1126/science.166.3906.765. PMID 4241847.
- ↑ Oro, J.; Kamat, J. S. (1961). “Amino-acid Synthesis from Hydrogen Cyanide under Possible Primitive Earth Conditions”. 《Nature》 190 (4774): 442–443. Bibcode:1961Natur.190..442O. doi:10.1038/190442a0. PMID 13731262.
- ↑ Bauer, Wolfgang (1985). 《Houben-Weyl Methods of Organic Chemistry Vol. E 5, 4th Edition Supplement》. Thieme Georg Verlag. 1547쪽. ISBN 9783131811547.
- ↑ Hassner, Alfred; Stumer, C. (2002). 《Organic Syntheses Based on Name Reactions》 2판. Elsevier. ISBN 0-08-043259-X.
- ↑ Hong-Ying Niu, Chao Xia 외 6명, 앞의 논문에서 재인용.
- ↑ Anne Kristin Bakkestuen, Lise-Lotte Gundersen, "Regioselective N-9 arylation of purines employing arylboronic acids in the presence of Cu(II)", Tetrahedron Letters Volume 44, Issue 16, 2003, pp.3359–3362.