안지오텐신 전환효소 2
안지오텐신 전환효소 2(영어: Angiotensin-converting enzyme 2, 줄여서 ACE2)는 메탈로카복시펩티다제 (metallo-carboxypeptidase)의 하나로, 안지오텐신 전환효소와 상동하는 1형 막관통 단백질이며, 진핵생물과 세균에서 발견할 수 있다. 안지오텐신 전환효소 2는 체내 수분과 혈압을 조절하는 레닌-안지오텐신-알도스테론계 (RAAS)에서 중요한 역할을 담당한다.
중합효소 연쇄 반응 (PCR)을 통해 안지오텐신 전환효소 2가 심장, 폐, 콩팥, 혈관내피와 소화계통에 발현된다는 것을 알아낼 수 있다.[5][6] 또한 ACE2는 SARS-CoV와 SARS-CoV-2를 포함한 여러 코로나바이러스가 세포에 침입할 때 이용하는 수용체이기도 하다.[7][8][9]
구조
[편집]안지오텐신 전환효소 2는 전체 구조의 약 62%를 차지하는 20개의 알파나선(a-helix) 분절과 9개의 310나선 (310-Helix) 및 3.5% 정도의 지분을 가진 6개의 짧은 베타병풍 (β-sheet)을 포함한다. 인간 ACE2의 세포외 부분은 두개의 단백질 도메인으로 구성되어 있는데 아연 메탈로펩티다제 도메인과 C 말단 콜렉트린 (collectrin) 상동성 도메인이 그 것이다. 이 중에서 아연 메탈로펩티다제 도메인은 다시 I과 II의 두 하위 도메인으로 나뉠 수 있으며, 이 둘의 사이에 활성자리가 위치한다. 하위 도메인 I은 N 말단과 아연 이온을, 하위 도메인 II는 C 말단을 포함한다. 두 하위 도메인은 알파나선으로 연결되어 있다.
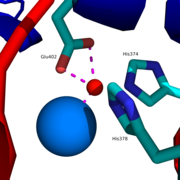
활성자리의 아연 이온은 아미노산 잔기 His374, His378, Glu402 및 물 분자 하나와 함께 배위 결합되어 있으며, 이들은 „HEXXH + E“ 모티프 (H = 히스티딘, E = 글루탐산, X = 임의의 아미노산)를 구성한다. 한편 염화 이온은 아미노산 잔기 Arg169, Trp477, Lys481에 의해 하위 도메인 II 부분에서 배위 결합되어 있다.[10]
생리학적 기능
[편집]심혈관계 질환을 방비하는 효과
[편집]안지오텐신 II는 레닌-안지오텐신-알도스테론계 (RAAS)의 주역 중 하나로서 주로 안지오텐신 II 1형 수용체 (AT1 수용체)와 결합하여 세포의 성장, 증식, 이동을 불러일으킨다. 이 과정들은 조절이 잘못될 경우 심장과 혈관체계의 구조변화에 영향을 주어 여러 심혈관계 질환의 원인이 되기도 한다. 효소인 ACE2와 그 생성물인 안지오텐신(1-7) 및 안지오텐신(1-9)로 이루어진 레닌-안지오텐신-알도스테론계 역조절 축 (counter-regulatory axis)은 안지오텐신(1-7)이 Mas 수용체와 결합해 안지오텐신 전환효소 2의 효과를 억제함으로서 심혈관계 질환을 방비하는 역할을 한다.
안지오텐신(1-9)는 심장의 안지오텐신 전환효소 2 2형 수용체 (AT2 수용체)와 결합하여 콜라겐 합성을 줄이고, 따라서 심장의 섬유화도 덜 진행되며, 로키나제 (Rho-Kinase)의 활동성이 줄어들게 만들어 심장이 비대해지는 것을 줄여준다. 안지오텐신(1-9)가 혈관의 AT2 수용체와 결합할 경우 일산화질소의 농도의 상승이나 BK2 수용체와의 crosstalk로 인해 혈관 확장이 일어난다.[11]
메커니즘
[편집]안지오텐신 전환효소 2는 펩타이드 결합들이 C 말단 부분에서 활성자리에 있는 아연 이온의 조력으로 가수분해되는 것을 촉매한다. 옥타펩타이드 (octapeptide)인 안지오텐신 II를 반응물로 쓰면 헵타펩타이드 (heptapeptide)인 안지오텐신(1-7)과 아미노산인 페닐알라닌이 만들어지고, 데카펩타이드 (decapeptide)인 안지오텐신 I이 반응물이 되면 노나펩타이드인 안지오텐신(1-9)와 아미노산 류신을 얻게 된다.
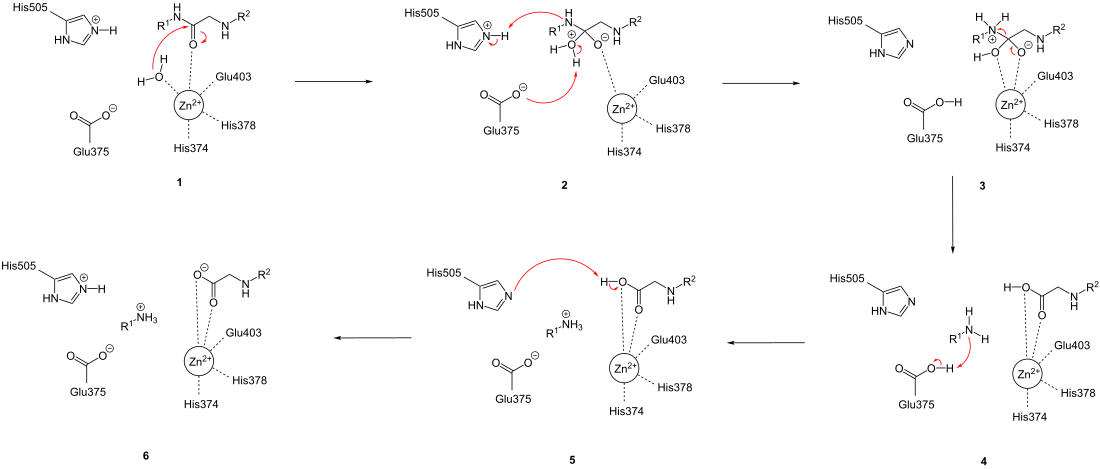
반응의 첫번째 단계에서는 효소-기질 복합체 (1)가 사면체형 중간체 (2)로 변화한다. 이를 위해서는 아연과 결합한 물 분자가 펩타이드의 카보닐기에 친핵성 치환을 시도하며, (1) 이로 인해 물 분자로부터 아미노산 잔기 Glu375로의 양성자 이동이 일어나며, 동시에 His505의 양성자 하나가 분리되어야 할 질소 원자로 이동한다 (2). 그 다음에는 사면체형 중간체가 붕괴하고 펩타이드 결합이 쪼개지면서 (3) Glu375의 양성자가 분리된 아미노산으로 이동한다 (4). 이 다음 수순으로는 양성자 하나가 용매와의 양성자 교환을 통해 올리고펩타이드의 카보닐기에서 His505로 직접적으로나 (5) 간접적으로 이동하게 된다.[10]
코로나바이러스의 수용체
[편집]SARS-CoV
[편집]SARS-CoV는 바이러스 외피의 돌기단백질을 이용해 인간의 안지오텐신 전환효소 2 효소에 달라붙는 것이 가능하다.[12] ACE2-바이러스 복합체가 엔도솜으로 운반되면 엔도펩티다제 카텝신 L에 의해 분해되어[13] 바이러스가 (클라트린과 카베올라 없이도 이루어지는) pH 의존적 수용체 매개 세포내이입을 통해 세포 내로 들어온다.[14] 이외에도 돌기단백질 (spike protein)을 TMPRSS2로 활성화시킨 후 그에 따르는 막 융합을 통해 바이러스가 세포 내로 들어가는 방법도 있다.[15]
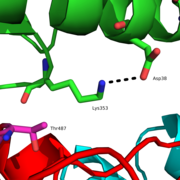
SARS-CoV의 돌기단백질은 두개의 서브유닛으로 이루어져 있다. S1 서브유닛은 ACE2와 결합할 수 있는 수용체 결합 도메인 (Receptor binding domain, RBD)을 포함한다. 수용체 결합 도메인이 ACE2와 결합하면 바이러스 외피와 세포막의 융합이 용이해지도록 S2 서브유닛의 형태가 달라진다.[16] 수용체 결합 도메인의 아미노산 잔기 424-494는 수용체 결합 모티프를 형성한다. ACE2의 18 잔기와 직접적인 접촉이 있는 수용체 결합 모티프의 14 잔기들 중 6개는 ACE2의 인식에 쓰이는 티로신 잔기이고, 여러개의 시스테인 잔기 역시 다이설파이드 결합을 통해 같은 목적으로 활용된다. 수용체 결합 도메인의 아미노산 잔기 Asn479와 Thr487는 사스의 질병과정과 Sars-CoV 향성 (tropism)에 영향을 준다. Asn479는 대부분의 인간 Sars-CoV S 단백질 서열에서 발견할 수 있다. 수용체 결합 도메인의 479와 487번 위치에서 일어나는 어떤 변화도 인수공통감염이나 인간들 사이의 전염에 영향을 끼칠 수가 있다.[17][18] 흰코사향고양이에 의해 일어나는 Sars-CoV 인수공통감염에서는 수용체 결합 도메인의 479번 위치가 라이신 잔기인데, 이로 인해 His34 같은 ACE2의 N 말단 나선과의 입체장애 및 정전기적 간섭이 발생한다. Lys479→Asn479로의 점 돌연변이가 발생하면 N 말단 나선과의 방해적인 상호 작용이 줄어들고 대신 수용체 결합 도메인과 ACE2 사이의 친화도가 늘어나 인수공통감염에 한 역할을 담당할 가능성이 있다. 또한 소수성 환경에서 형성된 인간 ACE2의 Lys31과 Glu35 사이의 이온 결합은 결합에너지를 방출하게 함으로서 바이러스와 수용체의 상호 작용을 더 용이하게 만든다. Thr487 역시 수용체 결합 도메인과 ACE2 사이의 친화도를 상승시키는 요인이다. Thr487의 γ-메틸기는 Lys353의 곁사슬이 Asp38이 ACE2 쪽으로 염다리를 놓을 수 있도록 위치를 잡으므로 사람간 전파에 영향을 끼칠 가능성이 있다.[8][19][20]
-
인간 ACE2 수용체와 결합한 SARS-CoV 돌기단백질의 수용체 결합 도메인 (RBM)
-
RBM의 아미노산 잔기 Leu472는 ACE2의 Met82 및 Leu79와의 소수성 작용을 통해 RBD와 ACE2 사이의 친화성을 높여준다.
-
RBM의 Lys479→Asn479 돌연변이와 Lys31과 Glu35 사이의 이온 결합은 바이러스와 수용체 사이의 상호 작용을 강화하고, 이것은 인수공통감염 확률에 영향을 줄 수 있다.
-
Thr487의 메틸기는 Lys353과 Asp3 사이에 염다리를 만들어 RBD와 ACE2 사이의 친화성을 높여 인간들 사이의 감염에 영향을 끼쳤을 가능성이 있다. 이후 일어난 RBM의 Thr487→Ser487 돌연변이는 상호 작용을 약화시켜 사스 유행이 수그러드는데 일조했을 수가 있다.
SARS-CoV-2
[편집]SARS-CoV-2 감염은 바이러스의 돌기단백질이 ACE2와 결합함으로서 이루어지며, 이 과정에서 세린 프로테아제인 TMPRSS2의 조력이 필요하다.[21] SARS-CoV-2는 주로 폐포세포에 침입하며 이로 인해 호흡기 증상을 유발한다. 이 증상들은 심혈관계 질환을 가진 환자들에게서 더 위중하게 나타나는데, 이는 아마도 이들 체내의 ACE2의 발현이 건강한 사람들에 비해 높기 때문이다. ACE2와 그 생성물인 안지오텐신(1-7) 및 안지오텐신(1-9)에 의해 형성되는 레닌-안지오텐신-알도스테론계 역조절 축은 심혈관계 질환을 방비하는 효과가 있다. ACE 억제제와 안지오텐신 전환효소 2 수용체 차단제는 안지오텐신 전환효소 2의 레벨을 낮추어 역조절 축을 활성화할 수 있는데, 이는 ACE2 레벨의 상승으로 인해 평형이 역조절 축 쪽으로 이동하여 항염증, 항산화 효과에 의해 심장과 폐를 보호하는 결과를 낳기 때문이다.[22] 그 외에도 ACE2를 통한 SARS-CoV-2 감염은 안지오텐신 전환효소 2-AT1수용체 축을 따라 이루어지는 사이토카인 방출에 의해 염증을 강화시키며, 따라서 인터루킨 6-STAT3 축을 통한 치료 타겟이 될 수가 있다.[23]
레닌-안지오텐신-알도스테론계 억제제를 통한 치료는 감염의 규모와 상관이 있으며,[24] 이들은 ACE2 레벨에 각기 다른 영향을 준다. ACE 억제제나 안지오텐신 수용체 차단제를 투여받은 루이스 쥐 (Lewis rat, 1950년대에 나온 실험용 쥐)들은 위약을 투여받은 쥐들보다 ACE2-전령 RNA 레벨이 높았다. 특히 쥐 심장에서는 Ace2-전령 RNA 레벨이 리시노프릴 (Lisinopril)을 투여받았을 때 4.7배, 로자탄을 투여받았을 때 2.8배가 높았고, ACE2의 활동량은 플라시보와 비교하면 로자탄은 그대로이고 리시노프릴은 더 높았다.[25] 캡토프릴을 통한 치료는 급성호흡곤란증후군 (ARDS)에 시달리는 쥐 체내의 ACE2 발현을 크게 늘릴 수 있다.[26] ARDS에 시달리는 쥐들의 ACE 활동량과 안지오텐신 전환효소 2 발현은 늘어나지만, 반대로 ACE2 활동량과 안지오텐신(1-7)의 발현은 줄어든다.[22][27]
여러 실험적, 임상적 모형을 통해 안지오텐신 전환효소 2 수용체 차단제와 무기질코르티코이드 수용체 차단제가 ACE2의 발현과 활동량을 높인다는 결과가 나온 것과 별개로,[28][29] ACE 억제제의 투여는 심장 ACE2-전령 RNA 레벨의 상승을 불러왔으나 실험적 모형에서는 ACE2의 활동량에 아무런 영향이 없었다.[30] 이외에도 한 동물 모델에 따르면 당뇨병성 신증에서 직접적 레닌 억제제인 알리스키렌 (Aliskiren)의 투여는 ACE2 발현을 감소시키는 효과가 있었다.[31]
베이징 유안병원 (北京佑安医院)에서는 특히 상태가 좋지 않은 COVID-19 환자들에게 ACE2 음성 중간엽 줄기세포를 정맥 이식했다.[32]
COVID-19 치료를 위해 RAAS 억제제와 스타틴을 통해 ACE2를 조절하는 것에 대해서는 임상적 우려가 있다.[33][34][35]
독일 연방 의약품/의약기기청은 재조합된 ACE2를 COVID-19 중환자들에게 임상시험하는 것을 허가했다.[36]
같이 보기
[편집]각주
[편집]- ↑ 가 나 다 GRCh38: Ensembl release 89: ENSG00000130234 - 앙상블, May 2017
- ↑ 가 나 다 GRCm38: Ensembl release 89: ENSMUSG00000015405 - 앙상블, May 2017
- ↑ “Human PubMed Reference:”. 《National Center for Biotechnology Information, U.S. National Library of Medicine》.
- ↑ “Mouse PubMed Reference:”. 《National Center for Biotechnology Information, U.S. National Library of Medicine》.
- ↑ C. Tikellis, M. C. Thomas: Angiotensin-Converting Enzyme 2 (ACE2) Is a Key Modulator of the Renin Angiotensin System in Health and Disease. In: International journal of peptides. Vol. 2012, 2012, S. 256294, doi 10.1155/2012/256294, PMID 22536270.
- ↑ “ACE-2: The SARS Receptor Identified”. 2020년 5월 15일에 확인함.
- ↑ W. Li, M. J. Moore, N. Vasilieva, J. Sui, S. K. Wong, M. A. Berne, M. Somasundaran, J. L. Sullivan, K. Luzuriaga, T. C. Greenough, H. Choe, M. Farzan: Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. In: Nature. Vol. 426, No. 6965, November 2003, S. 450–454, doi 10.1038/nature02145, PMID 14647384
- ↑ 가 나 Yushun Wan, Jian Shang, Rachel Graham, Ralph S. Baric, Fang Li: Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus, doi 10.1128/JVI.00127-20
- ↑ H. Hofmann, K. Pyrc, L. van der Hoek, M. Geier, B. Berkhout, S. Pöhlmann: Human coronavirus NL63 employs the severe acute respiratory syndrome coronavirus receptor for cellular entry. In: Proceedings of the National Academy of Sciences. Vol. 102, No. 22, May 2005, S. 7988–7993, doi 10.1073/pnas.0409465102, PMID 15897467.
- ↑ 가 나 P. Towler, B. Staker, S. G. Prasad, S. Menon, J. Tang, T. Parsons, D. Ryan, M. Fisher, D. Williams, N. A. Dales, M. A. Patane, M. W. Pantoliano: ACE2 X-ray structures reveal a large hinge-bending motion important for inhibitor binding and catalysis. In: Journal of Biological Chemistry. Vol. 279, No. 17, April 2004, S. 17996–18007, doi 10.1074/jbc.M311191200, PMID 14754895.
- ↑ C. A. McKinney, C. Fattah, C. M. Loughrey, G. Milligan, S. A. Nicklin: Angiotensin-(1-7) and angiotensin-(1-9): function in cardiac and vascular remodelling. In: Clinical science. Vol. 126, No. 12, June 2014, S. 815–827, doi 10.1042/CS20130436, PMID 24593683 (Review).
- ↑ Y. Inoue, N. Tanaka, Y. Tanaka, S. Inoue, K. Morita, M. Zhuang, T. Hattori, K. Sugamura: Clathrin-dependent entry of severe acute respiratory syndrome coronavirus into target cells expressing ACE2 with the cytoplasmic tail deleted. In: Journal of Virology. Vol. 81, No. 16, August 2007, S. 8722–8729, doi 10.1128/JVI.00253-07, PMID 17522231.
- ↑ G. Simmons, D. N. Gosalia, A. J. Rennekamp, J. D. Reeves, S. L. Diamond, P. Bates: Inhibitors of cathepsin L prevent severe acute respiratory syndrome coronavirus entry. In: Proceedings of the National Academy of Sciences. Vol. 102, No. 33, August 2005, S. 11876–11881, doi 10.1073/pnas.0505577102, PMID 16081529.
- ↑ H. Wang, P. Yang, K. Liu, F. Guo, Y. Zhang, G. Zhang, C. Jiang: SARS coronavirus entry into host cells through a novel clathrin- and caveolae-independent endocytic pathway. In: Cell research. Vol. 18, No. 2, February 2008, S. 290–301, doi 10.1038/cr.2008.15, PMID 18227861.
- ↑ S. Matsuyama, N. Nagata, K. Shirato, M. Kawase, M. Takeda, F. Taguchi: Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. In: Journal of Virology. Vol. 84, No. 24, December 2010, S. 12658–12664, doi 10.1128/JVI.01542-10, PMID 20926566.
- ↑ S. K. Wong, W. Li, M. J. Moore, H. Choe, M. Farzan: A 193-amino acid fragment of the SARS coronavirus S protein efficiently binds angiotensin-converting enzyme 2. In: Journal of Biological Chemistry. Vol. 279, No. 5, January 2004, S. 3197–3201, doi 10.1074/jbc.C300520200, PMID 14670965.
- ↑ L. Du, Y. He, Y. Zhou, S. Liu, B. J. Zheng, S. Jiang: The spike protein of SARS-CoV–a target for vaccine and therapeutic development. In: Nature reviews. Microbiology. Vol. 7, No. 3, March 2009, S. 226–236, doi 10.1038/nrmicro2090, PMID 19198616 (Review).
- ↑ F. Li, W. Li, M. Farzan, S. C. Harrison: Structure of SARS coronavirus spike receptor-binding domain complexed with receptor. In: Science. Vol. 309, No. 5742, September 2005, S. 1864–1868, doi 10.1126/science.1116480, PMID 16166518.
- ↑ F. Li: Structural analysis of major species barriers between humans and palm civets for severe acute respiratory syndrome coronavirus infections. In: Journal of Virology. Vol. 82, No. 14, July 2008, S. 6984–6991, doi 10.1128/JVI.00442-08, PMID 18448527.
- ↑ F. Li, W. Li, M. Farzan, S. C. Harrison: Interactions between SARS coronavirus and its receptor. In: Advances in Experimental Medicine and Biology. Vol. 581, 2006, S. 229–234, doi 10.1007/978-0-387-33012-9_38, PMID 17037534.
- ↑ M. Hoffmann, H. Kleine-Weber, S. Schroeder, N. Krüger, T. Herrler, S. Erichsen, T. S. Schiergens, G. Herrler, N. H. Wu, A. Nitsche, M. A. Müller, C. Drosten, S. Pöhlmann: SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. In: Cell. March 2020, doi 10.1016/j.cell.2020.02.052, PMID 32142651.
- ↑ 가 나 Ying-Ying Zheng, Yi-Tong Ma, Jin-Ying Zhang, Xiang Xie: Reply to: ‘Interaction between RAAS inhibitors and ACE2 in the context of COVID-19’. In: Nature Reviews Cardiology. 30. March 2020, doi 10.1038/s41569-020-0369-9.
- ↑ T. Hirano, M. Murakami: COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome. In: Immunity. [elektronische Veröffentlichung vor dem Druck] April 2020, doi 10.1016/j.immuni.2020.04.003, PMID 32325025.
- ↑ Y. Y. Zheng, Y. T. Ma, J. Y. Zhang, X. Xie: COVID-19 and the cardiovascular system. In: Nature reviews. Cardiology. 5. March 2020, doi 10.1038/s41569-020-0360-5, PMID 32139904.
- ↑ C. M. Ferrario, J. Jessup, M. C. Chappell, D. B. Averill, K. B. Brosnihan, E. A. Tallant, D. I. Diz, P. E. Gallagher: Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. In: Circulation. Vol. 111, No. 20, May 2005, S. 2605–2610, doi 10.1161/CIRCULATIONAHA.104.510461, PMID 15897343.
- ↑ Y. Li, Z. Zeng, Y. Li, W. Huang, M. Zhou, X. Zhang, W. Jiang: Angiotensin-converting enzyme inhibition attenuates lipopolysaccharide-induced lung injury by regulating the balance between angiotensin-converting enzyme and angiotensin-converting enzyme 2 and inhibiting mitogen-activated protein kinase activation. In: Shock. Vol. 43, No. 4, April 2015, S. 395–404, doi 10.1097/SHK.0000000000000302, PMID 25768373.
- ↑ R. M. Wösten-van Asperen, R. Lutter, P. A. Specht, G. N. Moll, J. B. van Woensel, C. M. van der Loos, H. van Goor, J. Kamilic, S. Florquin, A. P. Bos: Acute respiratory distress syndrome leads to reduced ratio of ACE/ACE2 activities and is prevented by angiotensin-(1-7) or an angiotensin II receptor antagonist. In: The Journal of pathology. Vol. 225, No. 4, December 2011, S. 618–627, doi 10.1002/path.2987, PMID 22009550.
- ↑ S. Keidar, A. Gamliel-Lazarovich, M. Kaplan, E. Pavlotzky, S. Hamoud, T. Hayek, R. Karry, Z. Abassi: Mineralocorticoid receptor blocker increases angiotensin-converting enzyme 2 activity in congestive heart failure patients. In: Circulation research. Vol. 97, No. 9, October 2005, S. 946–953, doi 10.1161/01.RES.0000187500.24964.7A, PMID 16179584.
- ↑ J. C. Zhong, J. Y. Ye, H. Y. Jin, X. Yu, H. M. Yu, D. L. Zhu, P. J. Gao, D. Y. Huang, M. Shuster, H. Loibner, J. M. Guo, X. Y. Yu, B. X. Xiao, Z. H. Gong, J. M. Penninger, G. Y. Oudit: Telmisartan attenuates aortic hypertrophy in hypertensive rats by the modulation of ACE2 and profilin-1 expression. In: Regulatory peptides. Vol. 166, No. 1–3, January 2011, S. 90–97, doi 10.1016/j.regpep.2010.09.005, PMID 20854846.
- ↑ S. R. Tipnis, N. M. Hooper, R. Hyde, E. Karran, G. Christie, A. J. Turner: A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase. In: Journal of Biological Chemistry. Vol. 275, No. 43, October 2000, S. 33238–33243, doi 10.1074/jbc.M002615200, PMID 10924499.
- ↑ W. Ding, X. Li, W. Wu, H. He, Y. Li, L. Gao, L. Gan, M. Wang, S. Ou, J. Liu: [Aliskiren inhibits angiotensin II/angiotensin 1-7(Ang II/Ang1-7) signal pathway in rats with diabetic nephropathy]. In: Xi bao yu fen zi mian yi xue za zhi = Chinese journal of cellular and molecular immunology. Vol. 34, No. 10, October 2018, S. 891–895, PMID 30554582 (chinesisch).
- ↑ Zikuan Leng, Rongjia Zhu, Wei Hou, Yingmei Feng, Yanlei Yang, Qin Han, Guangliang Shan, Fanyan Meng, Dongshu Du, Shihua Wang, Junfen Fan, Wenjing Wang, Luchan Deng, Hongbo Shi, Hongjun Li, Zhongjie Hu, Fengchun Zhang, Jinming Gao, Hongjian Liu, Xiaoxia Li, Yangyang Zhao, Kan Yin, Xijing He, Zhengchao Gao, Yibin Wang, B. o. Yang, Ronghua Jin, Ilia Stambler, Lee Wei Lim, Huanxing Su, Alexey Moskalev, Antonio Cano, Sasanka Chakrabarti, Kyung-Jin Min, Georgina Ellison-Hughes, Calogero Caruso, Kunlin Jin, Robert Chunhua Zhao: Transplantation of ACE2- Mesenchymal Stem Cells Improves the Outcome of Patients with COVID-19 Pneumonia. In: Aging and disease. Vol. 11, 9. March 2020, S. 216, doi 10.14336/AD.2020.0228.
- ↑ A. M. South, D. Diz, M. C. Chappell: COVID-19, ACE2 and the Cardiovascular Consequences. In: American Journal of Physiology – Heart and Circulatory Physiology. [elektronische Veröffentlichung vor dem Druck] March 31st 2020, doi 10.1152/ajpheart.00217.2020, PMID 32228252.
- ↑ “ESH UPDATE ON COVID-19”. 2020년 4월 15일에 원본 문서에서 보존된 문서. 2020년 5월 15일에 확인함.
- ↑ B. Williams, G. Mancia, W. Spiering, E. Agabiti Rosei, M. Azizi, M. Burnier, D. L. Clement, A. Coca, G. de Simone, A. Dominiczak, T. Kahan, F. Mahfoud, J. Redon, L. Ruilope, A. Zanchetti, M. Kerins, S. E. Kjeldsen, R. Kreutz, S. Laurent, G. Y. Lip, R. McManus, K. Narkiewicz, F. Ruschitzka, R. E. Schmieder, E. Shlyakhto, C. Tsioufis, V. Aboyans, I. Desormais: 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. In: Journal of hypertension. Vol. 36, No. 10, 10 2018, S. 1953–2041, doi 10.1097/HJH.0000000000001940, PMID 30234752.
- ↑ “Coronavirus SARS-CoV-2”. 2020년 5월 15일에 원본 문서에서 보존된 문서. 2020-05-15] 웹 아카이브에서에 확인함.