피브린
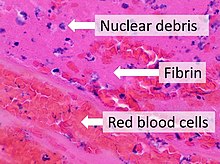

피브린(fibrin, Ia 인자)는 혈액 응고에 관여하는 섬유질의 비구형 단백질이다. 피브리노겐에 대한 단백질분해효소인 트롬빈의 작용에 의해 형성되어 중합을 유발한다. 중합된 피브린은 혈소판과 함께 상처 부위에 지혈 플러그 또는 딱지를 형성한다.
피브린은 혈관 내벽이 부서지면 혈소판을 끌어당겨 혈소판 마개를 형성한다. 이 혈소판은 표면에 혈청 트롬빈 분자에 결합하는 트롬빈 수용체를 가지고 있으며,[1] 혈청의 가용성 섬유소원을 상처 부위에서 섬유소로 전환한다. 피브린은 혈소판에 결합된 단단한 불용성 단백질의 긴 가닥을 형성한다. 인자 XIII는 섬유소의 가교를 완료하여 딱딱하게 굳힌다. 가교된 피브린은 응고를 완성하는 혈소판 마개 위에 망을 형성한다.
질병에서의 역할[편집]

응고 캐스케이드의 활성화로 인한 섬유소의 과도한 생성은 혈전증, 적혈구, 혈소판, 중합 섬유소 등의 기타 구성 요소의 응집에 의한 혈관의 폐쇄를 유발한다. 비효율적인 섬유소 생성 또는 조기 용해는 출혈 가능성을 높인다.
간 기능 장애나 질병은 피브린의 비활성 전구체인 피브리노겐 생성의 감소 또는 활성이 감소된 비정상 피브리노겐 분자 생성(이상피브리노겐혈증)을 유발할 수 있다. 피브린 유전자는 4번 염색체에 존재하는데, 섬유소원의 유전적 이상은 본질적으로 양적이거나 질적 이상을 보이며 아피브리노겐혈증, 저섬유소원혈증, 이상섬유소원혈증을 포함한다.
감소, 결석 또는 기능 장애 섬유소는 환자를 혈우병으로 만들 수 있다.
생리학[편집]

다른 동물 공급원의 피브린은 일반적으로 복합형 바이안테나리 아스파라긴 연결 글리칸으로 글리코실화된다. 코어 푸코실화 정도와 시알산 및 갈락토오스 결합의 유형에서 다양성이 발견된다.[2]
구조[편집]

피브린은 피브리노겐 A알파 사슬로부터 피브리노펩티드 A(FPA)의 트롬빈 절단 후에 형성되어 피브린 중합을 시작한다. 이중 가닥 원섬유의 말단에서 중간 도메인(D:E) 연결을 통해 형성되고, 수반되는 측면 원섬유 연결 및 분기는 응괴 네트워크를 생성한다.[3][4] 섬유소 조립은 감마 사슬 쌍의 분자간 역평행 C-말단 정렬을 용이하게 한 다음 인자 XIII(혈장 프로트랜스글루타미나제, plasma protransglutaminase) 또는 XIIIa에 의해 공유적으로 가교되어 감마-이량체(gamma-dimer)를 형성한다. 왼쪽 이미지는 두 개의 결합된 리간드가 있는 인간 피브린의 이중 d 단편의 결정 구조이다. 영상을 얻기 위해 사용한 실험적 방법은 X선 회절법이며, 해상도는 2.30 Å이다. 구조는 주로 빨간색으로 표시된 단일 알파 나선과 노란색으로 표시된 베타 시트로 구성된다. 두 개의 파란색 구조는 결합된 리간드이다. 리간드는 Ca2+이온, 알파-D-만노스(C6H12O6), D-글루코사민(C6H13NO5)으로 이루어져 있다.[5]
각주[편집]
- ↑ Kehrel BE (2003). “[Blood platelets: biochemistry and physiology]”. 《Hamostaseologie》 (독일어) 23 (4): 149–58. doi:10.1055/s-0037-1619592. PMID 14603379.
- ↑ “Mass + retention time = structure: a strategy for the analysis of N-glycans by carbon LC-ESI-MS and its application to fibrin N-glycans”. 《Anal. Chem.》 79 (13): 5051–7. July 2007. doi:10.1021/ac070363i. PMID 17539604.
|제목=에 지움 문자가 있음(위치 23) (도움말) - ↑ Mosesson, M. W. (August 2005). “Fibrinogen and fibrin structure and functions”. 《Journal of Thrombosis and Haemostasis》 3 (8): 1894–1904. doi:10.1111/j.1538-7836.2005.01365.x. ISSN 1538-7933. PMID 16102057.
- ↑ Undas, Anetta; Ariëns, Robert A.S. (2011년 12월 1일). “Fibrin Clot Structure and Function”. 《Arteriosclerosis, Thrombosis, and Vascular Biology》 31 (12): e88–e99. doi:10.1161/ATVBAHA.111.230631. PMID 21836064.
- ↑ Weisel, John W.; Litvinov, Rustem I. (2017), Parry, David A.D.; Squire, John M., 편집., “Fibrin Formation, Structure and Properties”, 《Fibrous Proteins: Structures and Mechanisms》 (Cham: Springer International Publishing) 82, 405–456쪽, doi:10.1007/978-3-319-49674-0_13, ISBN 978-3-319-49672-6, PMC 5536120, PMID 28101869
