산화수
산화수(酸化數, 영어: oxidation number)는 하나의 물질(분자, 이온 화합물, 홑원소 물질 등) 내에서 전자의 교환이 완전히 일어났다고 가정하였을 때 물질을 이루는 특정 원자가 갖게 되는 전하수를 말하며 산화 상태(酸化狀態, 영어: oxidation state)라고도 한다. 어떤 물질에서 원소의 산화정도를 나타내는 가상적인 전하량이므로 반드시 이온전하를 의미하지는 않는다.
산화수를 표현할 때에는 몇몇 경우를 제외하고는 보통 정수로 표현한다.
원자에서 화학 변화를 통해 산화수의 증가가 이루어질 경우에는 산화라고 칭하며, 그 반대로 산화수가 감소될 경우에는 환원이라고 이야기 한다. 즉 반응물과 생성물을 이루는 원소들이 반응 후 산화수가 증가하면 그 원소는 산화된 것이며, 산화수가 반응 후 감소하면 그 원소는 환원된 것이다. 형식적으로 전하가 끌려갔다는 것을 표현한다.
원자의 산화수는 진짜 원자의 전하를 나타나지 않는다. 말 그대로 형식상일 뿐이다. 이것은 높은 산화수에서도 특별히 성립한다. 또한 원소의 산화수는 전기음성도에 따라 달라진다. 그래서 원소의 산화수는 형식상이다.
배경 용어 정의
[편집]산화수는 실제로 존재하는 것이 아니라, 산화 반응과 환원 반응을 명시적으로 이해하기 위하여 만들어진 인공의 수이기 때문에 산화수에 대하여 이야기 하려면 우선, 산화와 환원을 이해하는 과정이 필요하다. 우선 맨 처음 산화 반응을 정의한 사람은 프랑스의 화학자 '앙투안 라부아지에'로 초기에는 '산화(酸化)'라는 한자 뜻 그대로, 산소를 얻고 잃는 반응을 의미하는 것이었다. 하지만 이러한 정의로는 설명할 수 없는 현상이 있었고, 시간이 지난후에 그 물질이 산화되는 과정에서 전자를 잃는다는 것이 알려져 산화라는 것이 산소의 유무에 상관없이 전자를 잃는 반응을 산화라고 하는 의미로 그 의미가 확장되었다. 산화와 환원은 항상 동시에 일어나는 반응으로 한 곳에서 산화가 일어났다면 다른 한 곳에서는 환원 반응이 일어난다. 산화, 환원 반응에 대한 정의는 시간이 지남에 따라 변해왔다. 산화, 환원반응은 전자를 주고 받는 과정에서 전자가 어디서 어디로 이동하느냐에 따라 결정난다. 즉, 산화수의 변화를 통해 산화, 환원 반응을 결정하는 것이므로, 산화수가 변화하지 않았다면 이는 산화, 환원 반응이 아니다.
두가지 원소가 결합할 때 그 결합의 전자쌍은 이동하게 되는데, 그 이동에 있어서 영향을 미치는 것이 전기 음성도이다.
전기 음성도(電氣陰性度, electronegativity)란 원자나 분자가 화학 결합을 할 때 다른 전자를 끌어들이는 능력의 척도이다. 공유하고 있는 전자쌍을 끌어들이는 성질을 말한다.
| → 원자 반지름 감소 → 이온화 에너지 증가 → 전기음성도 증가 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 족 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 주기 | |||||||||||||||||||
| 1 | H2.20 | He | |||||||||||||||||
| 2 | Li0.98 | Be1.57 | B2.04 | C2.55 | N3.04 | O3.44 | F3.98 | Ne | |||||||||||
| 3 | Na0.93 | Mg1.31 | Al1.61 | Si1.90 | P2.19 | S2.58 | Cl3.16 | Ar | |||||||||||
| 4 | K0.82 | Ca1.00 | Sc1.36 | Ti1.54 | V1.63 | Cr1.66 | Mn1.55 | Fe1.83 | Co1.88 | Ni1.91 | Cu1.90 | Zn1.65 | Ga1.81 | Ge2.01 | As2.18 | Se2.55 | Br2.96 | Kr3.00 | |
| 5 | Rb0.82 | Sr0.95 | Y1.22 | Zr1.33 | Nb1.6 | Mo2.16 | Tc1.9 | Ru2.2 | Rh2.28 | Pd2.20 | Ag1.93 | Cd1.69 | In1.78 | Sn1.96 | Sb2.05 | Te2.1 | I2.66 | Xe2.6 | |
| 6 | Cs0.79 | Ba0.89 | *
|
Hf1.3 | Ta1.5 | W2.36 | Re1.9 | Os2.2 | Ir2.20 | Pt2.28 | Au2.54 | Hg2.00 | Tl1.62 | Pb2.33 | Bi2.02 | Po2.0 | At2.2 | Rn | |
| 7 | Fr0.7 | Ra0.9 | **
|
Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 란타넘족 | *
|
La1.1 | Ce1.12 | Pr1.13 | Nd1.14 | Pm1.13 | Sm1.17 | Eu1.2 | Gd1.2 | Tb1.1 | Dy1.22 | Ho1.23 | Er1.24 | Tm1.25 | Yb1.1 | Lu1.27 | |||
| 악티늄족 | **
|
Ac1.1 | Th1.3 | Pa1.5 | U1.38 | Np1.36 | Pu1.28 | Am1.13 | Cm1.28 | Bk1.3 | Cf1.3 | Es1.3 | Fm1.3 | Md1.3 | No1.3 | Lr | |||
폴링 척도에 의한 전기음성도 주기율표
자세한 내용은 전기 음성도 페이지 참조
개요
[편집]산화수는 산화 환원 반응(redox reaction)에서 전자의 흐름을 확인하기 위하여 사용하는 하나의 방법으로 실제 특정 물질 내의 원자가 가지는 전하량과 반드시 일치하지는 않는다. 예를 들어 염화수소(HCl)의 경우 HCl은 이온 화합물이 아니기 때문에 H와 Cl이 이온 상태로 존재하지 않지만(전하수가 +1과 -1이 아니지만) 각각의 산화수는 +1과 -1이다.
산화수의 가장 큰 장점은 임의의 화학 반응이 산화-환원 반응인지 아닌지 쉽게 확인할 수 있다는 점이며 이는 화학 반응의 반응물과 생성물을 이루는 원소들의 산화수 변화를 통해 확인이 가능하다. 즉, 산화수가 반응 후 증가하면 그 원소는 산화된 것이며, 산화수가 반응 후 감소하면 그 원소는 환원된 것이다. 예를 들어 금속 아연(Zn)과 황산구리(II)(CuSO4) 용액의 반응에서 반응식은 다음과 같다.

위의 반응에서 Zn의 산화수는 0에서 +2로 증가하였으므로 Zn은 산화되었으며, Cu의 산화수는 +2에서 0으로 감소하였으므로 Cu는 환원되었다. 또한 산화수의 변화가 있으므로 위의 반응은 산화-환원 반응임을 알 수 있다.[1]
여러 물질의 산화수 계산법
[편집]특정 원소의 산화수는 불변의 값이 아니며 원소가 이루고 있는 화합물에 따라 그 값이 변하지만, 다음의 규칙에 따라 산화수를 구할 수 있다.
홑원소 물질의 산화수 계산법
[편집]홑원소 물질이란 순물질이면서 구성하는 원소가 하나뿐인 물질이다.
- 홑원소 물질을 이루는 원소의 산화수는 0이다.
- 홑원소 물질을 이루는 원소간의 전기음성도가 서로 같아 전자의 치우침이 없다.
- 대표적으로 산소(O2), 수소(H2), 질소(N2), 금속원소(Cu, Al, Na) 등 물질은 산화수가 모두 0이다.
단원자 이온의 산화수 계산법
[편집]- 단원자 이온은 원자 하나로 이루어진 이온을 칭하는 말이다.
- 단원자 이온의 산화수는 이온의 전하수와 같은데, 이는 산화수의 규칙을 적용한 것이다.
- 산화수는 전자의 이동을 표시하기 위해 쓰는 것이기 때문에 전자의 잃고 얻음이 확실한 이온에도 적용할 수 있는 것이다.
원자번호 20번 내에서 대표적인 단원자 이온에는 수소 양이온 (H+), 리튬 이온 (Li+), 나트륨 이온 (Na+), 마그네슘 이온 (Mg2+)이 있다. 위의 이온들 모두 자신의 전하수와 동일한 산화수를 가지고 있다. 즉 이온들의 전하수를 이용하여 산화수를 측정할 수 있다.
다원자 이온의 산화수 계산법
[편집]- 다원자 이온의 전체 산화수는 단원자 이온과 동일하게 전하수를 보고 결정하면 된다.
- 다원자 이온의 전체 전하수는 구성 원자들의 산화수의 합으로 결정된다.
예를 들어 탄산 이온의 경우 탄소는 산소와의 결합이 4개 있으므로 산화수가 +4가 된다. 또한 탄소와 이중결합한 산소 1개와 단일결합한 산소 2개가 있는데 이중결합한 산소의 산화수는 그대로 -2가 되고 단일결합한 산소는 결합만 본다면 산화수가 -1이지만 산소의 형식전하 -1이 존재하기 때문에 산화수가 -2가 되어서 전체 합이 -2가 된다.
중성 분자의 산화수 계산법
[편집]- 중성 분자(혹은 화합물)의 경우 원자들의 산화수의 총합은 0이다.
- 특수한 경우를 제외하고는 원자의 산화수는 원자의 원자가전자와 관계가 있다. 산화수는 전자의 이동을 표현한 것인데 원자가전자수에 따라 결합의 숫자나 이동할 수 있는 전자의 수가 달라지기 때문이다.
- 주기율표에서 수소(H)를 제외한 1족 원소들(알칼리 금속)의 산화수는 +1이고 2족 원소들(알칼리 토금속)의 산화수는 +2이며, 3족 원소(스칸듐(Sc), 이트륨(Y), 란타넘(La), 악티늄(Ac))의 산화수는 +3이다.
- 13족 원소 알루미늄(Al)은 모든 화합물에서 산화수가 +3이다.
- 플루오린(F)과 아스타틴(At)의 경우 산화수는 항상 -1이다. 다른 할로젠은 대부분 이성분화합물에서 -1의 산화수를 갖지만, 산소음이온(oxyanion)과 같이 산소와 결합할 때는 양의 산화 상태를 갖는다.
- 수소의 산화수는 금속과 이온화합물을 이룰 때를 제외하고는(이 경우 산화수는 -1) +1이다
- 대부분의 화합물에서 산소(O)의 산화수는 -2이다. 예외적으로 과산화물상태에서 각 산소의 산화수는 -1이다.
화합물 산화수 예시
[편집]| 분자 | 원소 산화수 | 원소 산화수 | 원소 산화수 |
|---|---|---|---|
| SO2 | O=-2 | S=+4 | |
| SO4(2-) | O=-2 | S=+6 | |
| NH4+ | H=+1 | N=-3 | |
| NO2- | O=-2 | N=+3 | |
| NO3- | O=-2 | N=+5 | |
| OF2 | F=-1 | O=+2 | |
| ClF5 | F=-1 | Cl=+5 | |
| KMnO4 | K=+1 | O=-2 | Mn=+7 |
| H2O2 | H=+1 | O=-1 | |
| H2O | H=+1 | O=-2 |
탄소 산화수의 다양성
[편집]탄소의 산화수는 많은 화합물에서 대부분 +4이나, 다른 화합물에서는 -4부터 +4까지의 다양한 산화수를 가지는 경우도 있다.
탄소보다 전기음성도가 작은 원소와 결합할 때에는 탄소의 산화수는 결합한 원소들에 의해 달라진다.
예를 들어, 메테인(CH4)에서 수소의 전기 음성도가 탄소의 전기 음성도보다 작다. 따라서 수소의 산화수가 +1이 된다. 그런데 화합물에서 모든 원소의 산화수 합은 0이어야 하므로 탄소의 산화수는 -4가 된다. 알케인(C2H6)의 경우 산화수 합이 0이 되기 위해서는 탄소의 산화수가 -3이 되어야 한다. 또한 탄화수소에서 탄소와 수소의 구성비가 정수비를 이루지 않는 경우 분자식으로만 보면 탄소의 산화수가 분수가 나오지만 이는 탄소 산화수들의 평균값에 해당한다. 각 탄소의 정확한 산화수를 알기 위해서는 구조식을 통한 전기음성도 비교가 필요하다.



C4H8 에서는 탄소 2개가 수소 3개와 결합하고 있고 탄소 1개가 수소 2개와 결합하고 있다. 위 설명대로 탄소와 수소간의 결합에선 수소의 산화수가 +1이므로 수소 3개와 결합하고 있는 탄소의 산화수는 -3이고, 수소 2개와 결합하고 있는 탄소의 산화수는 -2이다. 탄소간 결합에선 전기음성도가 같아 전자의 치우침이 없으므로 가운데 결합한 탄소의 산화수는 0이다.
C2H2 에서는 각각의 탄소는 수소 1개와 결합하고 있다. 탄소와 수소간의 결합에선 수소의 산화수가 +1이므로 탄소의 산화수는 각각 -1 이 된다.
C6H6(벤젠)에서는 탄소간에 공명구조를 이루고 있으므로 탄소간의 결합길이와 전기음성도가 같아 탄소간의 결합은 산화수에 영향을 끼치지 않는다. 탄소 6개는 각각 수소 1개씩과 결합하고 있으므로 수소의 산화수는 +1, 탄소의 산화수는 -1이 된다.
탄화수소 외 다른 경우의 예를 살펴보자

HCN 에선 C이 H와 단일결합 N삼중결합을 하고 있다. 전기음성도가 강한 질소가 탄소의 전자 3개를 끌어당겨 질소의 산화수는 -3이며, 수소와 비교해서 상대적으로 전기음성도가 강한 탄소는 수소의 전자 1개를 끌어당겨 수소의 산화수는 +1이다. HCN의 산화수 총합은 0이므로 탄소의 탄화수는 +2이다.

수소와 비교해서 상대적으로 전기음성도가 강한 탄소는 수소의 전자 1개를 끌어당겨 탄소와 결합한 수소의 산화수는 +1이다. 따라서 수소 3개와 결합한 탄소의 산화수는 -3이다, 전기음성도가 강한 산소는 수소로부터 1개, 탄소로부터 1개의 전자를 끌어오고 일반적인 경우와 같이 산화수는 -2이다. 탄소와 2중결합한 산소도 탄소로부터 2개의 전자를 끌어와 산화수는 -2가 된다. 산소와 결합한 수소의 산화수는 +1이며 CH3COOH의 산화수 총합은 0이므로 산소와 이중결합한 탄소의 산화수는 +3이 된다.
이와 같이 한 분자 내에서도 탄소는 주변 원소들과 어떤 구조로 결합되어있느냐에 따라 산화수는 달라진다.
탄소 특성상 탄소는 다양한 결합이 가능하며, 어떻게 주변 원자들과 결합되어 있느냐에 따라 탄소의 산화수는 유기적으로 변한다.
원소의 산화수
[편집]이것은 원소들의 알려진 정수만 포함한 산화수 목록이다. 이 표는 그린우드[2]의 책에서 비롯되었다.
| 원소의 산화수 | ||||||||||||||||||
| 원소 | 음수 | 양수 | 족 | |||||||||||||||
| −5 | −4 | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||||
| Z | ||||||||||||||||||
| 1 | 수소 | H | −1 | 1 | 1 | |||||||||||||
| 2 | 헬륨 | He | 18 | |||||||||||||||
| 3 | 리튬 | Li | 1 | 1 | ||||||||||||||
| 4 | 베릴륨 | Be | 0 | 1 | 2 | 2 | ||||||||||||
| 5 | 붕소 | B | −5 | −1 | 0 | 1 | 2 | 3 | 13 | |||||||||
| 6 | 탄소 | C | −4 | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 14 | ||||||
| 7 | 질소 | N | −3 | −2 | −1 | 1 | 2 | 3 | 4 | 5 | 15 | |||||||
| 8 | 산소 | O | −2 | −1 | 0 | 1 | 2 | 16 | ||||||||||
| 9 | 플루오린 | F | −1 | 17 | ||||||||||||||
| 10 | 네온 | Ne | 18 | |||||||||||||||
| 11 | 나트륨 | Na | −1 | 1 | 1 | |||||||||||||
| 12 | 마그네슘 | Mg | 1 | 2 | 2 | |||||||||||||
| 13 | 알루미늄 | Al | −2 | −1 | 1 | 2 | 3 | 13 | ||||||||||
| 14 | 규소 | Si | −4 | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 14 | ||||||
| 15 | 인 | P | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 15 | ||||||
| 16 | 황 | S | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 16 | ||||||
| 17 | 염소 | Cl | −1 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 17 | |||||||
| 18 | 아르곤 | Ar | 18 | |||||||||||||||
| 19 | 칼륨 | K | −1 | 1 | 1 | |||||||||||||
| 20 | 칼슘 | Ca | 1 | 2 | 2 | |||||||||||||
| 21 | 스칸듐 | Sc | 0 | 1 | 2 | 3 | 3 | |||||||||||
| 22 | 티타늄 | Ti | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 4 | ||||||||
| 23 | 바나듐 | V | −3 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 5 | |||||||
| 24 | 크로뮴 | Cr | −4 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 6 | |||||
| 25 | 망가니즈 | Mn | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 7 | ||||
| 26 | 철 | Fe | −4 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||||
| 27 | 코발트 | Co | −3 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 9 | |||||||
| 28 | 니켈 | Ni | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 10 | ||||||||
| 29 | 구리 | Cu | −2 | 0 | 1 | 2 | 3 | 4 | 11 | |||||||||
| 30 | 아연 | Zn | −2 | 1 | 2 | 12 | ||||||||||||
| 31 | 갈륨 | Ga | −5 | −4 | −3 | −2 | −1 | 1 | 2 | 3 | 13 | |||||||
| 32 | 게르마늄 | Ge | −4 | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 14 | ||||||
| 33 | 비소 | As | −3 | −2 | −1 | 1 | 2 | 3 | 4 | 5 | 15 | |||||||
| 34 | 셀레늄 | Se | −2 | −1 | 1 | 2 | 3 | 4 | 5 | 6 | 16 | |||||||
| 35 | 브로민 | Br | −1 | 1 | 3 | 4 | 5 | 7 | 17 | |||||||||
| 36 | 크립톤 | Kr | 2 | 18 | ||||||||||||||
| 37 | 루비듐 | Rb | −1 | 1 | 1 | |||||||||||||
| 38 | 스트론튬 | Sr | 1 | 2 | 2 | |||||||||||||
| 39 | 이트륨 | Y | 0 | 1 | 2 | 3 | 3 | |||||||||||
| 40 | 지르코늄 | Zr | −2 | 1 | 2 | 3 | 4 | 4 | ||||||||||
| 41 | 나이오븀 | Nb | −3 | −1 | 1 | 2 | 3 | 4 | 5 | 5 | ||||||||
| 42 | 몰리브데넘 | Mo | −4 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 6 | |||||
| 43 | 테크네튬 | Tc | −3 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 7 | |||||
| 44 | 루테늄 | Ru | −4 | −2 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 8 | ||||
| 45 | 로듐 | Rh | −3 | −1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 9 | ||||||
| 46 | 팔라듐 | Pd | 0 | 1 | 2 | 3 | 4 | 10 | ||||||||||
| 47 | 은 | Ag | −2 | −1 | 1 | 2 | 3 | 11 | ||||||||||
| 48 | 카드뮴 | Cd | −2 | 1 | 2 | 12 | ||||||||||||
| 49 | 인듐 | In | −5 | −2 | −1 | 1 | 2 | 3 | 13 | |||||||||
| 50 | 주석 | Sn | −4 | −3 | −2 | −1 | 0 | 1 | 2 | 3 | 4 | 14 | ||||||
| 51 | 안티모니 | Sb | −3 | −2 | −1 | 1 | 2 | 3 | 4 | 5 | 15 | |||||||
| 52 | 텔루륨 | Te | −2 | −1 | 1 | 2 | 3 | 4 | 5 | 6 | 16 | |||||||
| 53 | 아이오딘 | I | −1 | 1 | 3 | 4 | 5 | 6 | 7 | 17 | ||||||||
| 54 | 제논 | Xe | 2 | 4 | 6 | 8 | 18 | |||||||||||
| 55 | 세슘 | Cs | −1 | 1 | 1 | |||||||||||||
| 56 | 바륨 | Ba | 1 | 2 | 2 | |||||||||||||
산화수의 주기성이 Irving Langmuir의 옥텟 규칙을 채택할 수 있는 증거가 되었다.[10]
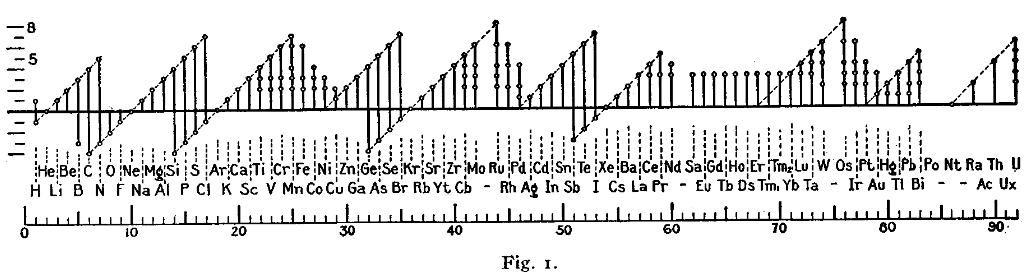
산화수의 활용법
[편집]반응식에서 각 원소간 산화수의 변화를 통해서 반응식이 산화환원 반응인지 쉽게 확인할 수 있다. 산화수가 변했다면 산화환원 반응이다.
산화수의 변화를 통해 산화, 환원과 산화제와 환원제를 알 수 있다. 특정 원소의 산화수가 증가 하였다면 그 원소는 산화된 것이며 동시에 환원제이다. 반대로 특정 원소의 산화수가 감소하였다면 그 원소는 환원된 것이며 동시에 산화제이다.
같이 보기
[편집]각주
[편집]- ↑ Raymond Chang, 《레이먼드 창의 일반화학》(제 10판), 서울:사이플러스, pp.146-151, 2010
- ↑ Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBNÄ0080379419, p. 28.
- ↑ The compound magnesium diboride, a known superconductor, is an example of boron in its Ä1 oxidation state.
- ↑ Low-valent magnesium compounds with Mg(I) have been obtained using bulky ligands; see Green, S. P.; Jones C.; Stasch A. (December 2007). "Stable Magnesium(I) Compounds with Mg-Mg Bonds". Science 318 (5857): 1754Å1757. doi:10.1126/science.1150856. PMIDÄ17991827.
- ↑ "Yttrium: yttrium(II) hydride compound data" (http://www.webelements.com/webelements/compounds/text/Y/H2Y1-13598351.html). WebElements.com. . Retrieved 2007-12-10.
- ↑ "Yttrium: yttrium(I) bromide compound data" (http://www.openmopac.net/data_normal/yttrium(i)[깨진 링크(과거 내용 찾기)] bromide_jmol.html). OpenMOPAC.net. . Retrieved 2007-12-10.
- ↑ Ir(Ä3) has been observed in Ir(CO)3
3Ä
- see Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford
- ↑ Hg4+ has been observed in mercury tetrafluoride; see Xuefang Wang; Lester Andrews; Sebastian Riedel; and Martin Kaupp (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4 .". Angew. Chem. Int. Ed. 46 (44): 8371Å8375. doi:10.1002/anie.200703710. PMIDÄ17899620..
- ↑ Rn2+ has been observed in radon difluoride; see Stein, L. (1970). "Ionic Radon Solution". Science 168 (3929): 362. doi:10.1126/science.168.3929.362. PMIDÄ17809133. and Kenneth S. Pitzer (1975). "Fluorides of radon and element 118". J. Chem. Soc., Chem. Commun., (18): 760b Å 761. doi:10.1039/C3975000760b.
- ↑ Irving Langmuir. The arrangement of electrons in atoms and molecules. J. Am. Chem. Soc. 1919, 41, 868-934. doi:10.1021/ja02227a002
