신경전달물질 수용체

신경전달물질 수용체(神經傳達物質受容體, 영어: neurotransmitter receptor)는 신경전달물질에 의해[1] 활성화되는 막 수용체 단백질이다.[2] 신경수용체(神經受容體, 영어: neuroreceptor)라고도 한다. 신경전달물질과 같은 세포 외부의 화학물질은 수용체가 있는 세포막에 부딪칠 수 있다. 신경전달물질이 해당 수용체와 부딪치면 결합하여 세포 내부에서 다른 사건이 일어나는 것을 유발할 수 있다. 따라서 막 수용체는 세포가 서로 통신할 수 있도록 하는 분자 기구의 일부이다. 신경전달물질 수용체는 다른 분자와 달리 신경전달물질과 특이적으로 결합하는 수용체의 부류이다.
시냅스후 뉴런에서 신경전달물질 수용체는 이온 통로의 활성을 조절하여 전기 신호를 유발하는 신호를 받는다. 신경전달물질이 특정 수용체에 결합하여 열린 이온 통로를 통한 이온의 유입은 뉴런의 막 전위를 변화시킬 수 있다. 이로 인해 축삭돌기를 따라 전도되는 신호(활동 전위를 참조)가 발생하고 시냅스에서 다른 뉴런으로 신호가 전달되고 아마도 신경망으로 신호가 전달될 수 있다.[2] 시냅스전 뉴런에는 피드백을 제공하고 과도한 신경전달물질의 방출을 중재하는, 해당 세포에서 방출되는 신경전달물질에 특이적인 자가수용체라고 알려진 수용체가 있다.[3]
신경전달물질 수용체에는 이온성 수용체(ionotropic receptor)와 대사성 수용체(metabotropic receptor)라는 두 가지 주요 유형이 있다. 이온성이란 이온이 수용체를 통과할 수 있음을 의미하는 반면, 대사성이란 세포 내부의 2차 전달자가 메세지를 전달한다는 것을 의미한다(즉, 대사성 수용체에는 통로가 없다). G 단백질 연결 수용체를 포함한 여러 종류의 대사성 수용체가 있다.[1][4] 이온성 수용체는 리간드 개폐 이온 통로라고도 하며 글루탐산 및 γ-아미노뷰티르산(GABA)와 같은 신경전달물질(리간드)에 의해 활성화될 수 있으며, 이는 특정 이온이 막을 통과하도록 허용한다. 나트륨 이온(예를 들어, 글루탐산 수용체에 의해 통과되도록 허용됨)은 시냅스후 세포를 자극하는 반면, 염화 이온(예를 들어, GABA 수용체에 의해 통과되도록 허용됨)은 시냅스후 세포를 억제한다. 억제는 활동 전위가 일어날 가능성을 감소시키는 반면, 흥분은 활동 전위가 일어날 가능성을 증가시킨다. 반대로, G 단백질 연결 수용체는 흥분성도 억제성도 아니다. 오히려 이들은 흥분성 및 억제성 이온 통로의 작용을 조절하거나 세포 내부의 저장소로부터 칼슘을 방출하는 신호전달 캐스케이드를 촉발하는 것과 같은 광범위한 기능을 가질 수 있다.[1] 대부분의 신경전달물질 수용체는 G 단백질 연결 수용체이다.[2]
위치[편집]
신경전달물질 수용체는 신경 세포와 신경아교세포의 표면에 위치한다. 시냅스에서 한 뉴런은 신경전달물질을 통해 다른 뉴런으로 메시지를 전달한다. 따라서 메시지를 수신하는 시냅스후 뉴런은 막의 특정 위치에 신경전달물질 수용체를 모아 놓는다. 신경전달물질 수용체는 가지돌기, 축삭돌기 및 신경세포체와 같은 뉴런 막의 모든 영역에 삽입될 수 있다.[5] 수용체는 신체의 다른 부분에 위치하여 특정 신경전달물질에 대한 억제성 수용체 또는 흥분성 수용체 역할을 할 수 있다.[6] 이에 대한 예로는 신경전달물질인 아세틸콜린(ACh)에 대한 수용체가 있다. 어떤 아세틸콜린 수용체는 골격근의 신경근 접합부에 위치하여 근육 수축(흥분성)을 촉진하는 반면, 다른 수용체는 심장에 위치하여 심박수를 낮춘다(억제성).[6]
이온성 수용체: 신경전달물질 개폐 이온 통로[편집]

리간드 개폐 이온 통로(LGIC)는 이온성 수용체 또는 이온 통로 연결 수용체의 한 유형이다. 이는 신경전달물질[7]과 같은 화학적 메신저(즉, 리간드)[8]의 결합에 반응하여 열리거나 닫히는 막관통 이온 통로의 부류이다.
리간드 개폐 이온 통로의 내인성 리간드의 결합 부위는 일반적으로 이온 전도 구멍에 위치한 부위와 비교하여 단백질의 다른 부분(알로스테릭 결합 부위)에 위치한다. 리간드 개폐 이온 통로의 특징인 리간드 결합과 이온 통로의 열림 또는 닫힘 사이의 직접적인 연결은 2차 전달자를 사용하는 대사성 수용체의 간접적인 기능과 대조된다. 리간드 개폐 이온 통로는 또한 전압 개폐 이온 통로(막 전위에 따라 열리고 닫히는) 및 인장 개폐 이온 통로(세포막의 기계적 변형에 따라 열리고 닫히는)와도 다르다.[7][9]
대사성 수용체: G 단백질 연결 수용체[편집]
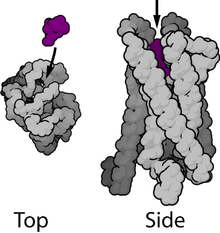
7-막관통 도메인 수용체, 7TM 수용체, 7나선 수용체, 세르펜틴 수용체라고도 알려진 G 단백질 연결 수용체(GPCR)는 세포 외부의 분자를 감지하고 내부 신호전달 경로 및 궁극적으로 세포 반응을 활성화하는 막관통 수용체의 대규모 단백질 패밀리로 구성된다. G 단백질 연결 수용체는 효모, 동정편모충류[10] 및 동물을 포함한 진핵생물에서만 발견된다. 이러한 수용체와 결합하고 활성화시키는 리간드에는 감광성 화합물, 냄새 분자, 페로몬, 호르몬 및 신경전달물질이 포함되며 저분자에서 펩타이드, 큰 단백질에 이르기까지 크기가 다양하다. G 단백질 연결 수용체는 많은 질병에 관여하며, 모든 현대 의약품의 약 30%의 표적이기도 하다.[11][12]
G 단백질 연결 수용체와 관련된 두 가지 주요 신호전달 경로는 cAMP 신호전달 경로와 포스파티딜이노시톨 신호전달 경로이다.[13] 리간드가 G 단백질 연결 수용체에 결합하면 G 단백질 연결 수용체의 입체구조적 변화가 발생하여 구아닌 뉴클레오타이드 교환인자(GEF)로 역할을 할 수 있다. 그런 다음 G 단백질 연결 수용체는 결합된 GDP를 GTP로 교환하여 관련된 G 단백질을 활성화시킬 수 있다. G 단백질의 α 소단위체는 결합된 GTP와 함께 β 및 γ 소단위체로부터 분리되어 α 소단위체의 유형(Gαs, Gαi/o, Gαq/11, Gα12/13)에 따라 세포내 신호전달 단백질 또는 표적 기능성 단백질에 직접적으로 영향을 미칠 수 있다.[14]
탈감작 및 신경전달물질의 농도[편집]
신경전달물질 수용체는 리간드에 의해 유발된 탈감작을 겪는다. 즉, 신경전달물질에 장기간 노출되면 반응이 일어나지 않을 수 있다. 신경전달물질 수용체는 시냅스후 뉴런과 시냅스전 뉴런 모두에 존재하며 시냅스후 뉴런은 신경전달물질을 수용하는 데 사용되고 시냅스전 뉴런은 주어진 신경전달물질의 추가적인 방출을 방지하는 목적으로 사용된다.[15] 신경전달물질 수용체는 신경 세포에서 발견되는 것 외에도 다양한 면역 조직과 근육 조직에서도 발견된다. 많은 신경전달물질 수용체는 세포막을 1번이 아니라 7번 관통하기 때문에 세르펜틴 수용체 또는 G 단백질 연결 수용체로 분류된다. 신경전달물질 수용체는 신경전달물질에 장기간 노출되면 수용하는 신경전달물질 유형에 반응하지 않는 것으로 알려져 있다. 이러한 현상은 리간드에 의한 탈감작[15] 또는 하향조절로 알려져 있다.
신경전달물질 수용체의 예[편집]
다음은 신경전달물질 수용체의 몇 가지 주요 부류이다.[16]
- 아드레날린작동성 수용체: α1A, α1b, α1c, α1d, α2a, α2b, α2c, α2d, β1, β2, β3
- 아세틸콜린 수용체(콜린작동성):
- 무스카린성 아세틸콜린 수용체: M1, M2, M3, M4, M5
- 니코틴성 아세틸콜린 수용체: 근육, 신경 세포(α-분가로톡신에 민감함), 신경 세포(α-분가로톡신에 민감함)
- 도파민 수용체(도파민작동성): D1, D2, D3, D4, D5
- GABA 수용체(GABA작동성): GABAA, GABAB1a, GABAB1δ, GABAB2, GABAC
- 글루탐산 수용체(글루탐산작동성): NMDA, AMPA, 카인산, mGluR1, mGluR2, mGluR3, mGluR4, mGluR5, mGluR6, mGluR7
- 글리신 수용체(글리신작동성): 글리신
- 히스타민 수용체(히스타민 작동성): H1, H2, H3
- 오피오이드 수용체(오피오이드작동성): μ, δ1, δ2, κ
- 5-HT 수용체(세로토닌작동성): 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT3, 5-HT4, 5-HT5, 5-HT6, 5-HT7
같이 보기[편집]
각주[편집]
- ↑ 가 나 다 “Neurological Control - Neurotransmitters”. Brain Explorer. 2011년 12월 20일. 2012년 11월 4일에 확인함.
- ↑ 가 나 다 Levitan, Irwin B.; Leonard K. Kaczmarek (2002). 《The Neuron》 Thi pg. 285판. Oxford University Press.
- ↑ “Neurotransmitter Receptors, Transporters, & Ion Channels”. www.rndsystems.com.
- ↑ “3. Neurotransmitter Postsynaptic Receptors”. Web.williams.edu. 2012년 11월 4일에 확인함.
- ↑ F., Bear, Mark (2007). 《Neuroscience : exploring the brain》. Connors, Barry W., Paradiso, Michael A. 3판. Philadelphia, PA: Lippincott Williams & Wilkins. 106쪽. ISBN 9780781760034. OCLC 62509134.
- ↑ 가 나 Goldman, B. (2010, November 17). New imaging method developed at Stanford reveals stunning details of brain connections. In Stanford medicine news center. Retrieved from https://med.stanford.edu/news/all-news/2010/11/new-imaging-method-developed-at-stanford-reveals-stunning-details-of-brain-connections.html.
- ↑ 가 나 Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). 《Neuroscience. 4th ed.》. Sinauer Associates. 156–7쪽. ISBN 978-0-87893-697-7.
- ↑ "ligand-gated channel" - 돌란드 의학사전
- ↑ Connolly CN, Wafford KA (2004). “The Cys-loop superfamily of ligand-gated ion channels: the impact of receptor structure on function”. 《Biochem. Soc. Trans.》 32 (Pt3): 529–34. doi:10.1042/BST0320529. PMID 15157178. S2CID 9115777.
- ↑ King N, Hittinger CT, Carroll SB (2003). “Evolution of key cell signaling and adhesion protein families predates animal origins”. 《Science》 301 (5631): 361–3. Bibcode:2003Sci...301..361K. doi:10.1126/science.1083853. PMID 12869759. S2CID 9708224.
- ↑ Filmore, David (2004). “It's a GPCR world”. 《Modern Drug Discovery》 2004 (November): 24–28.
- ↑ Overington JP, Al-Lazikani B, Hopkins AL (December 2006). “How many drug targets are there?”. 《Nat Rev Drug Discov》 5 (12): 993–6. doi:10.1038/nrd2199. PMID 17139284. S2CID 11979420.
- ↑ Gilman A.G. (1987). “G Proteins: Transducers of Receptor-Generated Signals”. 《Annual Review of Biochemistry》 56: 615–649. doi:10.1146/annurev.bi.56.070187.003151. PMID 3113327. S2CID 33992382.
- ↑ Wettschureck N, Offermanns S (October 2005). “Mammalian G proteins and their cell type specific functions”. 《Physiol. Rev.》 85 (4): 1159–204. doi:10.1152/physrev.00003.2005. PMID 16183910. S2CID 24270725.
- ↑ 가 나 “THE Medical Biochemistry Page”. Web.indstate.edu. 2019년 1월 10일에 원본 문서에서 보존된 문서. 2012년 11월 4일에 확인함.
- ↑ ed. Kebabain, J. W. & Neumeyer, J. L. (1994). "RBI Handbook of Receptor Classification"
외부 링크[편집]
- Brain Explorer
- Neurotransmitters Postsynaptic Receptors
- Snyder (2009) Neurotransmitters, Receptors, and Second Messengers Galore in 40 Years. Journal of Neuroscience. 29(41): 12717-12721.
- Snyder and Bennett (1976) Neurotransmitter Receptors in the Brain: Biochemical Identification. Annual Review of Physiology. Vol. 38: 153-175
- Neuroscience for Kids: Neurotransmitters
- Library of Congress Authorities and Vocabularies: Neurotransmitter Receptors
- Neurotransmitter Receptors, Transporters, & Ion Channels
- 의학주제표목 (MeSH)의 Neuroregulator+Receptor
