트라이아이오도티로닌
| |

| |
| 이름 | |
|---|---|
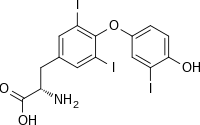
| IUPAC 이름
(2S)-2-amino-3-[4-(4-hydroxy-3-iodophenoxy)-3,5-diiodophenyl]propanoic acid
| |
| 별칭
triiodothyronine
T3 3,3′,5-triiodo-L-thyronine | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.027.272 |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C15H12I3NO4 | |
| 몰 질량 | 650.977 g·mol−1 |
| 위험 | |
| NFPA 704 (파이어 다이아몬드) | |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
트라이아이오도티로닌(영어: triiodothyronine, T3) 또는 '삼요드티로닌 '은 갑상샘 호르몬이다. 트라이아이오도트로닌은 인체의 발생과 생장, 물질대사, 체온 조절, 심박수 등 신체의 거의 모든 생리적 과정에 영향을 미친다.[1]
트라이아이오도티로닌(T3) 및 트라이아이오도티로닌의 프로호르몬인 티록신(T4)의 생성은 뇌하수체 전엽에서 방출되는 갑상샘 자극 호르몬(TSH)에 의해 활성화된다. 이러한 과정은 음성 피드백 조절 과정의 일부로 혈장에서 T3 및 T4의 농도 증가는 뇌하수체 전엽에서 TSH의 생성을 억제한다. T3 및 T4의 농도가 감소하면 뇌하수체 전엽은 TSH의 생성을 증가시키고, 이러한 과정에 의해 음성 피드백 조절 체계는 혈액의 갑상샘 호르몬의 양을 안정화시킨다.
트라이아이오도티로닌(T3)이 진정한 호르몬이며 티록신(T4)보다 표적 세포에 미치는 영향이 대략 4배 더 강력하다.[2] 생성되는 갑상샘 호르몬 중 약 20%만이 T3이고, 80%는 T4로 생성된다. 순환하는 T3의 약 85%는 나중에 T4의 외부 고리의 5번 탄소 원자에 결합된 아이오딘 원자를 제거함으로써 간이나 뇌하수체 전엽에서 생성된다. 어쨌든 사람의 혈장에서 T4의 농도는 T3의 농도보다 약 40배 정도 높다. 트라이아이오도티로닌(T3)의 생물학적 반감기는 약 2.5일이며,[3] T4의 생물학적 반감기는 약 6.5일이다.[4]
생성[편집]
티록신(T4)로부터 합성[편집]

트라이아이오도티로닌(T3)은 티록신(T4)으로부터 생성되는 대사 활성이 더 높은 호르몬이다. 티록신(T4)은 3가지 유형의 탈아이오딘화효소에 의해 탈아이오딘화되어 보다 활성이 높은 트라이아이오도티로닌(T3)을 생성한다.
- 제I형 탈아이오딘화효소는 간, 콩팥, 갑상샘 및 뇌하수체에 존재한다. 제I형 탈아이오딘화효소는 T4의 탈아이오딘화의 80%를 담당한다.
- 제II형 탈아이오딘화효소는 중추신경계, 뇌하수체, 갈색 지방 조직 및 심장 혈관에 존재한다. 뇌하수체에서 제II형 탈아이오딘화효소는 갑상샘 자극 호르몬에 대한 음성 피드백을 조절한다.
- 제III형 탈아이오딘화효소는 태반, 중추신경계 및 혈관종에 존재한다. 제III형 탈아이오딘화효소는 T4를 리버스 트라이아이오도티로닌으로 전환하는데, 리버스 트라이아이오도티로닌은 T3와는 달리 비활성형이다.
T4는 다음과 같이 갑상샘 소포 세포에서 합성된다.
- 나트륨/아이오딘화물 공동수송체는 아이오딘 이온과 함께 갑상샘 소포 세포의 기저막을 가로질러 2개의 나트륨 이온을 소포 세포 안으로 운반한다. 나트륨/아이오딘화물 공동수송체는 농도기울기에 역행하여 I−를 운반시키기 위해 Na+의 농도 기울기를 이용하는 2차 능동수송체이다.
- I−는 정단막을 가로 질러 소포의 콜로이드로 이동한다.
- 갑상샘 과산화효소는 2개의 I−를 산화시켜 I2를 형성한다. 아이오딘화물은 비반응성이며, 다음 단계에는 보다 반응성이 큰 아이오딘이 필요하다.
- 갑상샘 과산화효소는 콜로이드 내에서 티로글로불린의 티로실 잔기를 아이오딘화한다. 티로글로불린은 소포 세포의 소포체에서 합성되어 콜로이드로 분비되었다.
- 뇌하수체 전엽에서 분비된 갑상샘 자극 호르몬(TSH)은 세포의 기저측막에 있는 TSH 수용체(Gs 단백질 연결 수용체)와 결합하여 콜로이드의 세포 내 섭취를 자극한다.
- 세포 내 섭취된 소낭은 소포 세포의 리소좀과 융합된다. 리소좀의 효소들은 아이오딘화된 티로글로불린으로부터 T4를 절단한다.
- 그런 다음 이 소낭은 세포 외 배출되어 갑상샘 호르몬을 방출한다.
 |
직접 합성[편집]
갑상샘은 소량의 트라이아이오도티로닌(T3)을 직접 생성한다. 소포 세포 내강에서 티로신 잔기는 아이오딘화 된다. 이 반응에는 과산화 수소가 필요하다. 아이오딘의 유기화라고 불리는 과정에서 아이오딘은 티로글로불린의 티로신 잔기의 3번 탄소 또는 5번 탄소와 결합한다. 특정 티로신 잔기의 아이오딘화는 모노아이오도티로신(MIT) 및 다이아이오도티로신(DIT)을 생성한다. 모노아이오도티로신과 다이아이오도티로신은 갑상샘 과산화효소에 의해 서로 결합하여 트라이아이오도티로닌(T3)을 생성한다.
소량의 트라이아이오도티로닌(T3)은 조직에 따라 탈아이오딘화효소의 유비퀴틴화의 차이로 인해 T4에 대해 조직들이 상이한 민감성을 가지기 때문에 중요할 수 있다 링크. 이는 갑상샘 호르몬 대체 요법(thyroid hormone replacement therapy, THRT)에 T3가 포함되어야 하는지 다시 한 번 의문을 제기한다.
작용 메커니즘[편집]
트라이아이오도티로닌(T3)과 티록신(T4)은 핵 수용체(갑상샘 호르몬 수용체)에 결합한다.[6] T3와 T4는 소수성이지만 표적 세포의 인지질 이중층을 통과하여 수동적으로 확산될 수 없기 때문에 표적 세포 막의 아이오딘티로닌 운반체에 의해 이동된다.[7] T3와 T4의 소수성으로 인해 이들의 혈액에서의 수송을 위해 운반 단백질(티록신 결합 글로불린, 티록신 결합 프리알부민, 혈청 알부민)과 결합이 필요하다. 갑상샘 수용체는 유전자의 프로모터의 반응 요소에 결합하여, 전사를 활성화하거나 억제할 수 있다. T3에 대한 조직의 민감도는 갑상샘 수용체를 통해 조절된다.
수송[편집]

트라이아이오도티로닌(T3)과 티록신(T4)은 혈장 단백질과 결합하여 혈액을 통해 운반된다. 이는 호르몬의 반감기를 증가시키고, 말초 조직에 의해 흡수되는 속도를 감소시키는 효과가 있다. T3와 T4가 결합하는 3가지 주요 단백질이 있다. 티록신 결합 글로불린(TBG)은 T3보다 T4에 대해 더 높은 친화성을 가지는 당단백질이다. 트랜스티레틴은 T3에 대해서는 거의 친화성이 없고 T4만 운반하는 당단백질이다. T3와 T4는 혈청 알부민에 대해 낮은 친화력으로 결합하지만, 알부민의 이용가능성이 크기 때문에 용량이 크다.
내인성 T3에 대한 티로닌 결합 글로불린(TBG)의 포화 지점은 트라이아이오도티로닌 수지 흡수 시험에 의해 추정할 수 있다. 시험은 혈액 샘플을 채취한 후 방사성 원소로 표지된 과량의 외인성 T3를 첨가하여 T3에 결합하는 수지를 추가함으로써 수행된다. 방사성 원소로 표지된 T3의 일부는 내인성 갑상샘 호르몬에 의해 점유되지 않은 티로닌 결합 글로불린(TBG)과 결합하고, 나머지들은 수지와 결합한다. 수지와 결합한 방사성 원소로 표지된 홀몬의 양은 첨가된 총량에서 차감되고, 나머지는 티로닌 결합 글로불린의 결합 자리에 결합된 양이다.[9]
효과[편집]
트라이아이오도티로닌(T3)은 기초 대사율을 증가시켜 신체의 산소 및 에너지 소비를 증가시킨다. 기초 대사율은 휴식 중인 개인이 체온 유지, 심장 박동, 호흡 운동 등 생명을 유지하는 데 필요한 최소한의 에너지 요구량이다. T3는 비장을 포함한 몇 가지 예외를 제외하고 신체 내의 대부분의 조직에 작용한다. T3는 막을 경계로 이온의 균형을 맞추도록 하면서 Na+/K+-ATPase(일반적으로 세포 내 천제 ATP 소비량의 상당 부분을 차지함)의 생성을 증가시키고, 일반적으로 합성 및 분해를 증가시켜 다른 내인성 고분자들의 회전율을 증가시킨다.
단백질[편집]
트라이아이오도티로닌(T3)은 RNA 중합효소 I 및 RNA 중합효소 II 의 생성을 자극하고, 따라서 단백질 합성 속도를 증가시킨다. T3는 또한 단백질 분해 속도를 증가시키고, 단백질 양이 초과하면 단백질 분해 속도는 단백질 합성 속도를 초과한다. 이러한 상황에서는 신체는 음이온 균형에 들어갈 수 있다.
포도당[편집]
트라이아이오도티로닌(T3)은 β-아드레날린작동성 수용체가 포도당 대사에 미치는 영향을 강화시킨다. 따라서 포도당신생합성에서 글리코젠의 분해 속도 및 포도당 합성 속도가 증가한다.
지질[편집]
트라이아이오도티로닌(T3)은 콜레스테롤의 분해를 자극하고, 저밀도 지질단백질(LDL) 수용체의 수를 증가시켜서 지방 분해 속도를 증가시킨다.
심장[편집]
트라이아이오도티로닌(T3)은 심근에서 β-아드레날린작동성 수용체의 수를 증가시킴으로써 심박수와 수축력을 증가시켜 심박출량을 증가시킨다.[10] 이로 인해 수축기 혈압이 증가하고 이완기 혈압이 감소한다. 후자의 두 가지 효과는 갑상샘 기능 항진증에서 나타나는 전형적인 허탈 맥박을 형성하는 작용을 한다. 또한 T3는 마이오신 필라멘트를 상향 조절하여 수축성을 증가시킨다. 수축성을 평가하기 위한 유용한 임상적 측정 방법은 QRS파와 두 번째 심은 사이의 시간이다. 이것은 갑상샘 기능 항진증에서 종종 감소한다.
발생[편집]
트라이아이오도티로닌(T3)은 발생 중인 배아와 유아에게 중대한 영향을 미친다. T3는 폐에 영향을 미치며, 출생 후 중추신경계의 성장에 영향을 미친다. T3는 미엘린의 생성, 신경전달물질의 생성 및 축삭돌기의 생장을 자극한다. T3는 또한 뼈의 성장에서도 중요하다.
신경전달물질[편집]
트라이아이오도티로닌(T3)은 뇌에서, 특히 대뇌 겉질에서 세로토닌을 증가시킬 수 있으며, 5HT-2 수용체를 하향 조절할 수 있는데 이는 쥐에서 T3가 학습된 무기력을 역전시키는 연구 및 쥐 뇌의 생리학적 연구를 기초로 하고 있다.[11]
생리 기능[편집]
갑상샘 호르몬은 단백질의 회전율을 증가시키는 작용을 한다. 이것은 적절한 단백질로 장기 에너지 저장과 관련하여 적응 기능을 제공할 수 있다.[12][13] 에너지가 부족한 경우, 단백질 회전율의 감소는 에너지 부족의 영향을 개선시킬 수 있다.
측정[편집]
트라이아이오도티로닌(T3)은 유리 트라이아이오도티로닌으로 측정될 수 있는데, 이는 체내에서 트라이아이오도티로닌의 활성을 나타내는 지표이다. T3는 또한 티록신 결합 글로불린에 결합된 트라이아이오도티로닌에 의존하는 총 트라이아이오도티로닌으로 측정될 수 있다.[14]
용도[편집]
우울 장애의 치료[편집]
선택적 세로토닌 재흡수 저해제(SSRI)와 같은 기존의 치료제에 트라이아이오도티로닌을 추가하는 것은 치료 저항성 우울증에 대한 가장 널리 연구된 증강 전략 중 하나이지만, 치료의 성공은 T3의 복용량에 따라 달라질 수 있다.[15] 치료 저항성 우울증을 앓고 있는 17명의 환자에 대한 켈리(Kelly)와 리버만(Lieberman)의 장기 사례 연구에 따르면 14명의 환자가 평균 2년이라는 기간 동안 일부 경우에 치료 효과를 달성하기 위해 전통적으로 요구되는 50 µg 보다 더 많은 용량의 T3를 복용하는 경우 24개월의 복용 기간 동안 평균 80 µg의 용량인 경우에 지속적으로 증상이 개선되는 것으로 나타났다.[15] 같은 저자들은 양극성 장애 2형과 미분류 양극성 장애의 가장 흔한 2가지 범주의 질병을 가진 125명의 환자들을 대상으로 한 연구를 발표했는데, 이 두 가지 질병은 이전에 평균적으로 14가지의 다른 약물에 대해 내성을 가지고 있었다. 이들은 84%가 개선을 경험했고, 33%는 완전한 치료를 경험한 것으로 평균 20.3개월(표준 편차 9.7)의 기간 동안 나타났다. T3를 투여하는 중에 환자들 중에 아무도 경조증을 겪지 않았다.[16]
지방 감소 보충제로 사용[편집]
3,5-다이아이오도티로닌과 3,3'-다이아이오도티로닌은 보디빌딩용으로 고안된 특정 비처방 지방 감소 보충제의 성분으로 사용된다. 여러 연구에 따르면 이러한 화합물들은 쥐에서 지방산의 대사 및 지방 조직의 지방 소비를 증가시킨다.[17][18]
대체 의약품[편집]
트라이아이오도티로닌(T3)은 주류 의학에 의해 의학적 상태로 인식되지 않는 대체의학적 진단인 윌슨 체온 증후군을 치료하는 데 사용되었다. 이러한 진단은 일반적인 갑상선 기능 검사에도 불구하고 갑상선에 기인한 여러 가지 비특이적인 증상들을 포함한다. 미국 갑상샘 학회는 트라이아이오도티로닌을 처방한 치료법이 잠재적으로 해로울 수 있다는 우려를 제기했다.[19]
같이 보기[편집]
각주[편집]
- ↑ Bowen, R. (2010년 7월 24일). “Physiologic Effects of Thyroid Hormones”. Colorado State University. 2013년 9월 29일에 확인함.
- ↑ “How Your Thyroid Works – "A delicate Feedback Mechanism"”. endocrineweb. 2012년 1월 30일. 2013년 9월 29일에 확인함.
- ↑ “Cytomel (Liothyronine Sodium) Drug Information”. RxList. 2011년 1월 3일. 2013년 9월 29일에 확인함.
- ↑ Irizarry, Lisandro (2014년 4월 23일). “Thyroid Hormone Toxicity”. 《Medscape》. WedMD LLC. 2014년 5월 2일에 확인함.
- ↑ Boron, W. F. (2005). 《Medical Physiology: A Cellular And Molecular Approach》. Philadelphia, PA: Elsevier / Saunders. 1300쪽. ISBN 1-4160-2328-3. LCCN 2004051158.
- ↑ Lazar, MA; Chin, WW (December 1990). “Nuclear thyroid hormone receptors”. 《J. Clin. Invest.》 86: 1777–1782. doi:10.1172/JCI114906. PMC 329808. PMID 2254444.
- ↑ Dietrich, J. W.; Brisseau, K.; Boehm, B. O. (2008). “Resorption, Transport und Bioverfügbarkeit von Schilddrüsenhormonen” [Absorption, transport and bio-availability of iodothyronines]. 《Deutsche Medizinische Wochenschrift》 (독일어) 133 (31–32): 1644–1648. doi:10.1055/s-0028-1082780. PMID 18651367.
- ↑ References used in image are found in image article in Commons:Commons:File:Thyroid_system.png#References.
- ↑ triiodothyronine resin uptake test from Farlex Medical Dictionary, citing: Mosby's Medical Dictionary, 8th edition. 2009, Elsevier.
- ↑ “Thyroid physiology and tests of function”. Anaesthetist.com.
- ↑ Martin, P.; Brochet, D.; Soubrie, P.; Simon, P. (1985). “Triiodothyronine-induced reversal of learned helplessness in rats”. 《Biological Psychiatry》 20 (9): 1023–1025. doi:10.1016/0006-3223(85)90202-1. PMID 2992618.
- ↑ Fontana, L.; Klein, S.; Holloszy, J.O.; Premachandra, B.N. (2006). “Effect of long-term calorie restriction with adequate protein and micronutrients”. 《J. Clin. Endocrinol. Metab.》 91 (8): 3232–3235. doi:10.1210/jc.2006-0328. PMID 16720655.
- ↑ Roth, G.S.; Handy, A.M.; Mattison, J.A.; Tilmont, E.M.; Ingram, D.K.; Lane, M.A. (2002). “Effects of dietary calorie restriction and ageing on thyroid hormones of rhesus monkeys” (PDF). 《Horm. Metab. Res.》 34 (7): 378–382. doi:10.1055/s-2002-33469.
- ↑ Military Obstetrics & Gynecology – Thyroid Function Tests In turn citing: Operational Medicine 2001, Health Care in Military Settings, NAVMED P-5139, May 1, 2001, Bureau of Medicine and Surgery, Department of the Navy, 2300 E Street NW, Washington, D.C., 20372-5300
- ↑ 가 나 Kelly, T. F.; Lieberman, D. Z. (2009). “Long term augmentation with T3 in refractory major depression”. 《Journal of Affective Disorders》 115 (1–2): 230–233. doi:10.1016/j.jad.2008.09.022. ISSN 0165-0327. PMID 19108898.
- ↑ Kelly, T. F.; Lieberman, D. Z. (2009). “The use of triiodothyronine as an augmentation agent in treatment-resistant bipolar II and bipolar disorder NOS”. 《Journal of Affective Disorders》 116 (3): 222–226. doi:10.1016/j.jad.2008.12.010. PMID 19215985.
- ↑ Lombardi, A.; Lanni, A.; Moreno, M.; Brand, M. D.; Goglia, F. (1998). “Effect of 3,5-di-iodo-L-thyronine on the mitochondrial energy-transduction apparatus”. 《The Biochemical Journal》 330 (1): 521–526. doi:10.1042/bj3300521. PMC 1219168. PMID 9461551.
- ↑ Lanni, A. (2005). “3,5-Diiodo-L-thyronine powerfully reduces adiposity in rats by increasing the burning of fats”. 《The FASEB Journal》 19 (11): 1552–1554. doi:10.1096/fj.05-3977fje. ISSN 0892-6638. PMID 16014396.
- ↑ “ATA Statement on "Wilson's Syndrome"”. American Thyroid Association.
외부 링크[편집]
- Triiodothyronine bound to proteins in the PDB
- T3 at Lab Tests Online Archived 2017년 7월 28일 - 웨이백 머신

