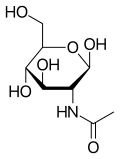
N-아세틸글루코사민

| |
 | |
| 이름 | |
|---|---|
| IUPAC 이름
β-D-(acetylamino)-2-deoxy-glucopyranose
| |
| 별칭
N-acetyl-D-glucosamine,
GlcNAc, NAG | |
| 식별자 | |
3D 모델 (JSmol)
|
|
| 1247660 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.028.517 |
| EC 번호 |
|
| 721281 | |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| 성질 | |
| C8H15NO6 | |
| 몰 질량 | 221.21 |
| 녹는점 | 211 |
| 관련 화합물 | |
관련 단단류
|
N-아세틸갈락토사민 |
관련 화합물
|
글루코사민 글루코스 |
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |
N-아세틸글루코사민(영어: N-Acetylglucosamine, GlcNAc)은 단당류인 포도당의 아마이드 유도체이다. N-아세틸글루코사민은 글루코사민과 아세트산 사이의 2차 아마이드이다. N-아세틸글루코사민은 여러 생물학적 시스템에서 중요하다.
이것은 N-아세틸글루코사민과 N-아세틸뮤람산(MurNAc)의 교대 단위로 구성된 세균 세포벽의 생체고분자의 일부이며, N-아세틸뮤람산의 젖산 잔기에서 올리고펩타이드로 가교된다. 이러한 층상 구조를 펩티도글리칸(이전에는 뮤레인이라고 불렀음)이라고 한다.
N-아세틸글루코사민은 곤충 및 갑각류와 같은 절지동물의 외골격을 형성하는 중합체인 키틴의 단량체 단위이다. N-아세틸글루코사민은 연체동물의 치설, 두족류의 부리, 대부분의 균류에서 세포벽의 주성분이다.
N-아세틸글루코사민은 글루쿠론산과 중합하여 히알루론산을 형성한다.
N-아세틸글루코사민은 인간의 과립구에서 엘라스테이스의 저해제(범위 8–17% 저해)로 보고되었지만, 이것은 N-아세틸갈락토사민에서 관찰되는 저해(범위 92–100%)보다 훨씬 약하다.[1]
의료용
[편집]N-아세틸글루코사민은 자가면역질환에 대한 치료제로 제안되었으며, 최근의 테스트에서 어느 정도 성과를 거두었다.[2]
O-N-아세틸글루코사민화
[편집]O-N-아세틸글루코사민화는 단백질의 세린이나 트레오닌에 단일 N-아세틸글루코사민을 첨가하는 과정이다.[3] 인산화와 비교하여 N-아세틸글루코사민의 첨가 또는 제거는 효소나 전사인자를 활성화시키거나 비활성화시키는 수단이다.[3] 사실, O-N-아세틸글루코사민화 및 인산화는 보통 동일한 세린/트레오닌 부위에 대해 경쟁한다.[3] O-N-아세틸글루코사민화는 염색질 단백질에서 가장 자주 일어나며, 보통 스트레스에 대한 반응으로 보인다.[3]
고혈당증은 O-N-아세틸글루코사민화를 증가시켜 인슐린 저항성을 유발한다.[4] 고혈당으로 인해 증가된 O-N-아세틸글루코사민화는 분명히 O-N-아세틸글루코사민화의 기능 장애 형태이다. 나이가 들면서 뇌의 O-N-아세틸글루코사민화의 감소는 인지 감소와 관련이 있다. 나이가 든 쥐의 해마에서 O-N-아세틸글루코사민화가 증가하면 공간 학습 능력과 기억력이 향상되었다.[5]
같이 보기
[편집]- 케라탄 황산
- N-아세틸갈락토사민 (GalNAc)
- N-아세틸락토사민 생성효소
- 밀배아응집소 – 이 기질에 결합하는 식물 렉틴
각주
[편집]- ↑ Kamel, M.; Hanafi, M.; Bassiouni, M. (1991). “Inhibition of elastase enzyme release from human polymorphonuclear leukocytes by N-acetyl-galactosamine and N-acetyl-glucosamine”. 《Clinical and Experimental Rheumatology》 9 (1): 17–21. PMID 2054963.
- ↑ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (2011). “N-Acetylglucosamine Inhibits T-helper 1 (Th1)/T-helper 17 (Th17) Cell Responses and Treats Experimental Autoimmune Encephalomyelitis”. 《Journal of Biological Chemistry》 286 (46): 40133–40141. doi:10.1074/jbc.M111.277814. PMC 3220534. PMID 21965673.
- ↑ 가 나 다 라 Hart GW, Slawson C, Ramirez-Correa G, Lagerlof O (2011). “Cross talk between O-GlcNAcylation and phosphorylation: roles in signaling, transcription, and chronic disease”. 《Annual Review of Biochemistry》 80: 825–858. doi:10.1146/annurev-biochem-060608-102511. PMC 3294376. PMID 21391816.
- ↑ Ma J, Hart GW (2013). “Protein O-GlcNAcylation in diabetes and diabetic complications”. 《Expert Review of Proteomics》 10 (4): 365–380. doi:10.1586/14789450.2013.820536. PMC 3985334. PMID 23992419.
- ↑ Wheatley EG, Albarran E, White CW 3rd, Bieri G, Sanchez-Diaz C, Pratt K, Snethlage CE, Ding JB, Villeda SA (2019). “Neuronal O-GlcNAcylation Improves Cognitive Function in the Aged Mouse Brain”. 《Current Biology》 29 (20): 3359–3369. doi:10.1016/j.cub.2019.08.003. PMC 7199460. PMID 31588002. 밴쿠버 양식 오류 (도움말)
