트레오닌: 두 판 사이의 차이
영어판 위키(2021년 1월 30일 버전)를 참고하여 기존의 한국어판 문서의 내용을 보충함. 태그: 시각 편집: 전환됨 동음이의 링크 |
|||
| 1번째 줄: | 1번째 줄: | ||
{{위키데이터 속성 추적}} |
{{위키데이터 속성 추적}} |
||
{{chembox |
{{chembox |
||
| Verifiedfields = changed |
|||
| verifiedrevid = 470609447 |
|||
| Name = 트레오닌 |
| Name = 트레오닌 |
||
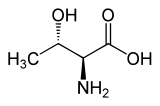
| ImageFile = L-Threonin - L-Threonine.svg |
| ImageFile = L-Threonin - L-Threonine.svg |
||
| ImageSize = 180px |
| ImageSize = 180px |
||
| ImageName = Skeletal formula |
| ImageName = Skeletal formula |
||
| ImageCaption = L-트레오닌의 [[골격 구조식]] |
|||
| ImageFile1 = L-Threonine-3D-balls.png |
|||
| ImageFileL1 = Threonine-from-xtal-3D-bs-17.png |
|||
| ImageSize1 = 160px |
|||
| ImageSizeL1 = |
|||
| ImageName1 = Ball-and-stick model |
|||
| ImageNameL1 = Ball-and-stick model |
|||
| IUPACName = Threonine |
|||
| ImageCaptionL1 = [[공-막대 모형]] |
|||
| OtherNames = 2-Amino-3-hydroxybutanoic acid |
|||
| ImageFileR1 = Threonine-from-xtal-3D-sf.png |
|||
| ImageSizeR1 = |
|||
| ImageNameR1 = Space-filling model |
|||
| ImageCaptionR1 = [[공간채움 모형]] |
|||
| IUPACName = threonine |
|||
| OtherNames = 2-amino-3-hydroxybutanoic acid |
|||
|Section1={{Chembox Identifiers |
|Section1={{Chembox Identifiers |
||
| index1_label = D/L |
|||
| index_label = L <!-- needs to be L (natural isomer) so drugbank etc. take correct index_label --> |
|||
| UNII1_Ref = {{fdacite|correct|FDA}} |
|||
| UNII1 = TFM6DU5S6A |
|||
| UNII_Ref = {{fdacite|correct|FDA}} |
| UNII_Ref = {{fdacite|correct|FDA}} |
||
| UNII = 2ZD004190S |
| UNII = 2ZD004190S |
||
| KEGG = D00041 |
|||
| IUPHAR_ligand = 4785 |
| IUPHAR_ligand = 4785 |
||
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
||
| 20번째 줄: | 29번째 줄: | ||
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
||
| StdInChIKey = AYFVYJQAPQTCCC-GBXIJSLDSA-N |
| StdInChIKey = AYFVYJQAPQTCCC-GBXIJSLDSA-N |
||
| InChIKey1 =AYFVYJQAPQTCCC-FGNFWGHYNA-N |
|||
| DrugBank_Ref = {{drugbankcite|correct|drugbank}} |
| DrugBank_Ref = {{drugbankcite|correct|drugbank}} |
||
| DrugBank = DB00156 |
| DrugBank = DB00156 |
||
| ChEBI_Ref = {{ebicite|correct|EBI}} |
| ChEBI_Ref = {{ebicite|correct|EBI}} |
||
| ChEBI = |
| ChEBI = 16857 |
||
| SMILES = C[C@H]([C@@H](C(=O)O)N)O |
| SMILES = C[C@H]([C@@H](C(=O)O)N)O |
||
| |
| SMILES3 = C[C@H]([C@@H](C(=O)[O-])[NH3+])O |
||
| |
| SMILES3_Comment = L Zwitterion |
||
| CASNo1 = 80-68-2 |
|||
| InChI = 1S/C4H9NO3/c1-2(6)3(5)4(7)8/h2-3,6H,5H2,1H3,(H,7,8)/t2-,3+/m1/s1 |
|||
| CASNo1_Ref = {{cascite|correct|CAS}} |
|||
| InChIKey1 = AYFVYJQAPQTCCC-GBXIJSLDSA-N |
|||
| CASNo = 80-68-2 |
|||
| CASNo_Ref = {{cascite|correct|CAS}} |
| CASNo_Ref = {{cascite|correct|CAS}} |
||
| CASNo= 72-19-5 |
|||
| CASNo2_Ref = {{cascite|changed|??}} |
|||
| CASNo2= 72-19-5 |
|||
| CASNo2_Comment = (<small>L</small>-isomer) <!-- also verified at CAS Common Chemistry --> |
|||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
||
| ChemSpiderID = 6051 |
| ChemSpiderID = 6051 |
||
| 39번째 줄: | 46번째 줄: | ||
| ChEMBL = 291747 |
| ChEMBL = 291747 |
||
| PubChem = 6288 |
| PubChem = 6288 |
||
| EINECS = |
| EINECS = 200-774-1 <!-- 200-774-1 for L-isomer 201-300-6 for DL mixed isomers --> |
||
}} |
}} |
||
|Section2={{Chembox Properties |
|Section2={{Chembox Properties |
||
| 47번째 줄: | 54번째 줄: | ||
| MeltingPt = |
| MeltingPt = |
||
| BoilingPt = |
| BoilingPt = |
||
| pKa=2.63 ( |
| pKa=2.63 (카복실기), 10.43 (아미노기)<ref>Dawson, R.M.C., et al., ''Data for Biochemical Research'', Oxford, Clarendon Press, 1959.</ref> |
||
| Solubility = (H2O, g/dl) 10.6(30°),14.1(52°),19.0(61°) |
| Solubility = (H2O, g/dl) 10.6(30°),14.1(52°),19.0(61°) |
||
}} |
}} |
||
| 55번째 줄: | 62번째 줄: | ||
}} |
}} |
||
}} |
}} |
||
'''트레오닌'''({{llang|en|threonine}}) (기호: '''Thr''' 또는 '''T''')<ref>{{cite web| url = http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html | title = Nomenclature and Symbolism for Amino Acids and Peptides | publisher = IUPAC-IUB Joint Commission on Biochemical Nomenclature | year = 1983 | access-date = 5 March 2018| archive-url= https://web.archive.org/web/20081009023202/http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html| archive-date= 9 October 2008 | url-status= live}}</ref>은 [[단백질의 생합성]]에 사용되는 α-[[아미노산]]이다. 트레오닌은 α-[[아미노기]](생물학적 조건에서 [[양성자화]]된 −NH{{su|b=3|p=+}} 형태), α-[[카복실기]](생물학적 조건에서 [[탈양성자화]]된 −COO<sup>−</sup> 형태) 및 [[곁사슬]]인 [[하이드록실기]]를 포함하고 있다. 트레오닌은 [[극성 (화학)|극성]] 비전하 아미노산으로 분류된다. 트레오닌은 [[필수 아미노산]]으로 [[인체]]에서 합성되지 않으며 음식을 통해 섭취해야 한다. 트레오닌은 [[대장균]]과 같은 [[세균]]에서 [[아스파르트산]]으로부터 합성된다.<ref>{{cite journal |title=Threonine synthesis from aspartate in Escherichia coli cell-free extracts: pathway dynamics |last1=Raïs |first1=Badr |last2=Chassagnole |first2=Christophe |last3=Lettelier |first3=Thierry |last4=Fell |first4=David |last5=Mazat |first5=Jean-Pierre |date=2001 |journal=Biochem J|doi= 10.1042/bj3560425|pmid=11368769 |pmc=1221853 |volume=356 |issue=Pt 2 |pages=425–32}}</ref> 트레오닌은 AC로 시작하는 모든 [[코돈]](ACU, ACC, ACA, ACG)에 의해 [[유전 부호|암호화]]되어 있다. |
|||
'''트레오닌'''({{llang|en|threonine}})은 알파-[[아미노산]]의 하나로 [[필수 아미노산]]에 속한다. 화학식으로는 HO<sub>2</sub>CCH(NH<sub>2</sub>)CH(OH)CH<sub>3</sub>이다. |
|||
트레오닌의 곁사슬은 보통 [[수소 결합]]되어 있다. 형성되는 가장 일반적인 작은 모티프는 [[ST 턴]], [[ST 모티프]](보통 α 나선의 시작 부분) 및 [[ST 스테이플]](일반적으로 α 나선의 중간 부분)이며, 이들은 [[세린]]과의 상호작용을 기반으로 한다. |
|||
== 친수성 == |
|||
트레오닌은 [[라이신]]과 함께 나머지 대부분의 필수 아미노산이 [[소수성]](hydrophobic)인것과는 다르게 [[친수성]](hydrophile)을 보인다. 한편, 친수성인 트레오닌(Threonine)은 산성이면서 비전하(uncharged) 되어 있는 극성(polar)이다. 함께 친수성인 [[라이신]](Lysine)은 친수성이지만 염기성이며 양 전하(pogitive charged)를 띄고 있다. |
|||
== 변형 == |
|||
트레오닌 잔기는 수 많은 [[번역 후 변형]]에 민감하다. [[곁사슬]]의 [[하이드록실기]]는 [[O-결합 글리코실화|''O''-결합 글리코실화]]를 겪을 수 있다. 또한 트레오닌 잔기는 트레오닌 키네이스에 의해 [[인산화]]된다. 트레오닌의 인산화된 형태는 포스포트레오닌이라고 할 수 있다. 포스포트레오닌은 3개의 잠재적인 배위 자리([[카복실기]], [[아미노기]], [[인산기]])를 가지고 있으며, [[생물]]에서 생성되는 인산화된 [[리간드 (생화학)|리간드]]와 금속 이온 사이의 배위 방식을 결정하는 것은 [[생물학적 과정]]에서 포스포트레오닌의 기능을 설명하는 데 중요하다.<ref>Jastrzab, Renata (2013). "Studies of new phosphothreonine complexes formed in binary and ternary systems including biogenic amines and copper(II)". ''Journal of Coordination Chemistry''. 66 (1): 98–113. {{doi|10.1080/00958972.2012.746678}}</ref> |
|||
== 역사 == |
|||
트레오닌은 20가지의 [[단백질생성성 아미노산]]들 중에서 가장 나중에 발견되었다. 트레오닌은 1936년에 커티스 마이어(Curtis Meyer)와 [[윌리엄 커밍 로즈]]<ref>{{Cite book|url=https://books.google.com/books?id=AtngooiwXikC&pg=PA459|title=A Dictionary of scientists.|date=1999|publisher=Oxford University Press|others=Daintith, John., Gjertsen, Derek.|isbn=9780192800862|location=Oxford|pages=459|oclc=44963215}}</ref>가 공동으로 발견했다. [[4탄당]]인 [[트레오스]]의 [[유도체]]로 [[분자식]]이 C<sub>4</sub>H<sub>8</sub>O<sub>5</sub>인 [[트레온산]]과 구조가 유사하기 때문에 트레오닌이라고 명명되었다.<ref>{{cite journal |last1=Meyer |first1=Curtis |title=The Spatial Configuation of Alpha-Amino-Beta-Hydroxy-n-Butyric Acid |journal=Journal of Biological Chemistry |date=20 July 1936 |volume=115 |issue=3 |pages=721–729 |doi=10.1016/S0021-9258(18)74711-X |url=http://www.jbc.org/content/115/3/721.full.pdf|doi-access=free }}</ref> |
|||
== 입체 이성질체 == |
|||
:{| class="wikitable" |
|||
|- |
|||
! [[일반명]] |
|||
! L-트레오닌 (2''S'',3''R'') |
|||
! D-트레오닌 (2''R'',3''S'') |
|||
! L-알로트레오닌 (2''S'',3''S'') |
|||
! D-알로트레오닌 (2''R'',3''R'') |
|||
|- |
|||
| [[구조식]] |
|||
| [[파일:L-Threonin - L-Threonine.svg|160px]] |
|||
| [[파일:D-Threonine.svg|160px]] |
|||
| [[파일:L-allo-Threonine.svg|160px]] |
|||
| [[파일:D-allo-Threonine.svg|160px]] |
|||
|} |
|||
트레오닌은 [[아이소류신]]과 함께 2개의 [[입체 중심]]이 있는 2가지 단백질생성성 아미노산 중 하나이다. 트레오닌은 (2''S'',3''R''), (2''R'',3''S''), (2''S'',3''S''), (2''R'',3''R'')의 [[입체배치]]를 갖는 4가지 가능한 [[입체 이성질체]]로 존재할 수 있다. 그러나 L-트레오닌이라는 이름은 하나의 단일 입체 이성질체인 (2''S'',3''R'')-2-아미노-3-하이드록시뷰탄산에 사용된다. 자연계에는 거의 존재하지 않는 두 번째 입체 이성질체 (2''S'',3''S'')를 L-알로트레오닌이라고 한다.<ref>{{cite journal |title=Nomenclature and symbolism for amino acids and peptides (Recommendations 1983) |journal=Pure and Applied Chemistry |date=1 January 1984 |volume=56 |issue=5 |pages=601, 603, 608 |doi=10.1351/pac198456050595}}</ref> 2가지 다른 입체 이성질체인 (2''R'',3''S'')-2-아미노-3-하이드록시뷰탄산과 (2''R'',3''R'')-2-아미노-3-하이드록시뷰탄산은 그다지 중요하지 않다. |
|||
== 생합성 == |
|||
트레오닌은 [[필수 아미노산]]으로 인체에서 합성되지 않으며, 식사를 통해 섭취해야 한다. 성인의 경우 매일 체중 1 kg당 20 mg의 트레오닌이 필요하다.<ref name="DRItext">{{cite book|title=Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids|last1=Institute of Medicine|author1-link=|year=2002|publisher=The National Academies Press|location=Washington, DC|pages=589–768|chapter=Protein and Amino Acids|doi=10.17226/10490|isbn=978-0-309-08525-0|chapter-url=https://www.nap.edu/read/10490/chapter/12}}</ref> 식물과 미생물에서 트레오닌은 α-아스파르틸-세미알데하이드 및 [[호모세린]]을 거쳐 [[아스파르트산]]으로부터 합성된다. 호모세린은 [[인산화|''O''-인산화]]를 겪는다. 이 [[인산 에스터]]는 하이드록실기의 재배치와 함께 [[가수분해]]를 겪는다.<ref>{{Lehninger3rd}}.</ref> 트레오닌의 일반적인 생합성에 관여하는 효소는 다음과 같다. |
|||
# [[아스파르트산 키네이스]] |
|||
# [[아스파르트산-세미알데하이드 탈수소효소]] |
|||
# [[호모세린 탈수소효소]] |
|||
# [[호모세린 키네이스]] |
|||
# [[트레오닌 생성효소]] |
|||
{| |
|||
|[[파일:Threonine biosynthesis.svg|섬네일|왼쪽|600px|트레오닌 생합성]] |
|||
|} |
|||
== 물질대사 == |
|||
트레오닌은 적어도 세 가지 방식으로 대사된다. |
|||
* 많은 동물에서 트레오닌은 [[L-트레오닌 3-탈수소효소]]에 의해 [[피루브산]]으로 전환된다. 이 경로의 [[대사 중간생성물]]은 CoA와 [[싸이올분해]]를 거쳐 [[아세틸-CoA]]와 [[글리신]]을 생성할 수 있다. |
|||
* 사람에서 L-트레오닌 3-탈수소효소 유전자는 비활성 [[위유전자]]이므로<ref>{{Cite book|url=https://books.google.com/books?id=XVNPAQAAQBAJ&pg=PA310|title=Biochemical, Physiological, and Molecular Aspects of Human Nutrition – E-Book|last1=Stipanuk|first1=Martha H.|last2=Caudill|first2=Marie A.|year=2013|publisher=Elsevier Health Sciences|isbn=9780323266956|language=en}}</ref> 트레오닌은 [[α-케토뷰티르산]]으로 전환된다. 첫 번째 단계의 메커니즘은 [[세린 탈수효소]]에 의해 촉매되는 것과 유사하며, 세린 탈수효소 및 트레오닌 탈수효소 반응은 아마도 동일한 효소에 의해 촉매된다.<ref>{{Cite book|url=https://books.google.com/books?id=93yeKr9W9TwC&pg=PA129|title=Biochemistry for Nurses|last1=Bhardwaj|first1=Uma|last2=Bhardwaj|first2=Ravindra|publisher=Pearson Education India|isbn=9788131795286|language=en}}</ref> |
|||
* 많은 생물에서 이는 추가적인 대사를 준비하는 키네이스에 의해 [[인산화|''O''-인산화]]된다. 이것은 [[세균]]에서 코발라민([[비타민 B12|비타민 B<sub>12</sub>]]) 생합성의 일부로 특히 중요하다. 그 이유는 대사산물이 비타민의 곁사슬에 결합되기 위해 [[1-아미노프로판-2-올]]로 전환되기 때문이다.<ref name="pmid28137297">{{cite journal |last1=Fang |first1=H |last2=Kang |first2=J |last3=Zhang |first3=D |title=Microbial production of vitamin B<sub>12</sub>: a review and future perspectives. |journal=Microbial Cell Factories |date=30 January 2017 |volume=16 |issue=1 |pages=15 |doi=10.1186/s12934-017-0631-y |pmid=28137297 |pmc=5282855 }}</ref> |
|||
*트레오닌은 쥐의 뇌와 간에서 L-카르니틴의 내인성 생성 동안 글리신을 합성하는 데 사용된다.<ref>{{cite journal |last1=Adeva-Andany |first1=M |last2=Souto-Adeva |first2=G |last3=Ameneiros-Rodríguez |first3=E |last4=Fernández-Fernández |first4=C |last5=Donapetry-García |first5=C |last6=Domínguez-Montero |first6=A |title=Insulin resistance and glycine metabolism in humans. |journal=Amino Acids |date=January 2018 |volume=50 |issue=1 |pages=11–27 |doi=10.1007/s00726-017-2508-0 |pmid=29094215|s2cid=3708658 }}</ref><ref>{{cite journal |last1=Dalangin |first1=R |last2=Kim |first2=A |last3=Campbell |first3=RE |title=The Role of Amino Acids in Neurotransmission and Fluorescent Tools for Their Detection. |journal=International Journal of Molecular Sciences |date=27 August 2020 |volume=21 |issue=17 |page=6197 |doi=10.3390/ijms21176197 |pmid=32867295 |pmc=7503967 |doi-access=free }}</ref> |
|||
== 공급원 == |
|||
트레오닌이 많이 함유된 식품으로는 [[코티지 치즈]], [[가금류]], [[생선]], [[고기]], [[렌즈콩]], [[검정거북콩]],<ref>{{cite web|url=http://ndb.nal.usda.gov/ndb/foods/show/4632?fg=&man=&lfacet=&count=&max=&sort=&qlookup=&offset=&format=Full&new=|title=Error|website=ndb.nal.usda.gov|access-date=2013-05-29|archive-date=2018-11-16|archive-url=https://web.archive.org/web/20181116093022/https://ndb.nal.usda.gov/ndb/foods/show/4632?fg=&man=&lfacet=&count=&max=&sort=&qlookup=&offset=&format=Full&new=|url-status=dead}}</ref> 및 참깨가 있다.<ref>{{cite web|url=http://nutritiondata.self.com/|title=SELF Nutrition Data - Food Facts, Information & Calorie Calculator|website=nutritiondata.self.com|access-date=27 March 2018}}</ref> |
|||
[[라세미 혼합물|라세미]] 트레오닌은 [[아세트산 수은(II)]]을 사용하여 알파-기능화에 의해 [[크로톤산]]으로부터 제조할 수 있다. threonine can be prepared from crotonic acid by alpha-functionalization using [[mercury(II) acetate]].<ref>{{OrgSynth|last1=Carter|first1=Herbert E.|authorlink1=|last2=West|first2=Harold D.|authorlink2=|title=dl-Threonine|prep=cv3p0813|volume=20|pages=101|year=1940|collvol=3|collvolpages=813}}.</ref> |
|||
== 같이 보기 == |
== 같이 보기 == |
||
* [[아스파라긴]] |
|||
{{위키공용분류}} |
|||
* [[ |
* [[글루타민]] |
||
* [[세린]] |
|||
* [[시스테인]] |
|||
== |
== 각주 == |
||
{{각주}} |
{{각주}} |
||
== 외부 링크 == |
|||
* [http://www.chem.qmul.ac.uk/iubmb/enzyme/reaction/AminoAcid/Thr.html Threonine biosynthesis] |
|||
* [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=205 CID 205] |
|||
* [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=6288 CID 6288] |
|||
{{아미노산}} |
{{아미노산}} |
||
{{아미노산 대사 중간생성물들}} |
|||
{{전거 통제}} |
|||
{{토막글|생화학}} |
|||
[[분류:아미노산]] |
|||
[[분류:필수 아미노산]] |
|||
[[분류:단백질성 아미노산]] |
[[분류:단백질성 아미노산]] |
||
[[분류:글루코스 생성성 아미노산]] |
[[분류:글루코스 생성성 아미노산]] |
||
[[분류:케톤체 생성성 아미노산]] |
[[분류:케톤체 생성성 아미노산]] |
||
[[분류:필수 아미노산]] |
|||
[[분류:글라이신 수용체 작용제]] |
[[분류:글라이신 수용체 작용제]] |
||
2023년 4월 5일 (수) 19:42 판
 L-트레오닌의 골격 구조식
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
threonine
| |||
| 별칭
2-amino-3-hydroxybutanoic acid
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider |
| ||
| DrugBank |
| ||
| ECHA InfoCard | 100.000.704 | ||
| EC 번호 |
| ||
| |||
| KEGG |
| ||
PubChem CID
|
| ||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C4H9NO3 | |||
| 몰 질량 | 119.120 g·mol−1 | ||
| (H2O, g/dl) 10.6(30°),14.1(52°),19.0(61°) | |||
| 산성도 (pKa) | 2.63 (카복실기), 10.43 (아미노기)[1] | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
트레오닌(영어: threonine) (기호: Thr 또는 T)[2]은 단백질의 생합성에 사용되는 α-아미노산이다. 트레오닌은 α-아미노기(생물학적 조건에서 양성자화된 −NH+
3 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 곁사슬인 하이드록실기를 포함하고 있다. 트레오닌은 극성 비전하 아미노산으로 분류된다. 트레오닌은 필수 아미노산으로 인체에서 합성되지 않으며 음식을 통해 섭취해야 한다. 트레오닌은 대장균과 같은 세균에서 아스파르트산으로부터 합성된다.[3] 트레오닌은 AC로 시작하는 모든 코돈(ACU, ACC, ACA, ACG)에 의해 암호화되어 있다.
트레오닌의 곁사슬은 보통 수소 결합되어 있다. 형성되는 가장 일반적인 작은 모티프는 ST 턴, ST 모티프(보통 α 나선의 시작 부분) 및 ST 스테이플(일반적으로 α 나선의 중간 부분)이며, 이들은 세린과의 상호작용을 기반으로 한다.
변형
트레오닌 잔기는 수 많은 번역 후 변형에 민감하다. 곁사슬의 하이드록실기는 O-결합 글리코실화를 겪을 수 있다. 또한 트레오닌 잔기는 트레오닌 키네이스에 의해 인산화된다. 트레오닌의 인산화된 형태는 포스포트레오닌이라고 할 수 있다. 포스포트레오닌은 3개의 잠재적인 배위 자리(카복실기, 아미노기, 인산기)를 가지고 있으며, 생물에서 생성되는 인산화된 리간드와 금속 이온 사이의 배위 방식을 결정하는 것은 생물학적 과정에서 포스포트레오닌의 기능을 설명하는 데 중요하다.[4]
역사
트레오닌은 20가지의 단백질생성성 아미노산들 중에서 가장 나중에 발견되었다. 트레오닌은 1936년에 커티스 마이어(Curtis Meyer)와 윌리엄 커밍 로즈[5]가 공동으로 발견했다. 4탄당인 트레오스의 유도체로 분자식이 C4H8O5인 트레온산과 구조가 유사하기 때문에 트레오닌이라고 명명되었다.[6]
입체 이성질체
트레오닌은 아이소류신과 함께 2개의 입체 중심이 있는 2가지 단백질생성성 아미노산 중 하나이다. 트레오닌은 (2S,3R), (2R,3S), (2S,3S), (2R,3R)의 입체배치를 갖는 4가지 가능한 입체 이성질체로 존재할 수 있다. 그러나 L-트레오닌이라는 이름은 하나의 단일 입체 이성질체인 (2S,3R)-2-아미노-3-하이드록시뷰탄산에 사용된다. 자연계에는 거의 존재하지 않는 두 번째 입체 이성질체 (2S,3S)를 L-알로트레오닌이라고 한다.[7] 2가지 다른 입체 이성질체인 (2R,3S)-2-아미노-3-하이드록시뷰탄산과 (2R,3R)-2-아미노-3-하이드록시뷰탄산은 그다지 중요하지 않다.
생합성
트레오닌은 필수 아미노산으로 인체에서 합성되지 않으며, 식사를 통해 섭취해야 한다. 성인의 경우 매일 체중 1 kg당 20 mg의 트레오닌이 필요하다.[8] 식물과 미생물에서 트레오닌은 α-아스파르틸-세미알데하이드 및 호모세린을 거쳐 아스파르트산으로부터 합성된다. 호모세린은 O-인산화를 겪는다. 이 인산 에스터는 하이드록실기의 재배치와 함께 가수분해를 겪는다.[9] 트레오닌의 일반적인 생합성에 관여하는 효소는 다음과 같다.
 |
물질대사
트레오닌은 적어도 세 가지 방식으로 대사된다.
- 많은 동물에서 트레오닌은 L-트레오닌 3-탈수소효소에 의해 피루브산으로 전환된다. 이 경로의 대사 중간생성물은 CoA와 싸이올분해를 거쳐 아세틸-CoA와 글리신을 생성할 수 있다.
- 사람에서 L-트레오닌 3-탈수소효소 유전자는 비활성 위유전자이므로[10] 트레오닌은 α-케토뷰티르산으로 전환된다. 첫 번째 단계의 메커니즘은 세린 탈수효소에 의해 촉매되는 것과 유사하며, 세린 탈수효소 및 트레오닌 탈수효소 반응은 아마도 동일한 효소에 의해 촉매된다.[11]
- 많은 생물에서 이는 추가적인 대사를 준비하는 키네이스에 의해 O-인산화된다. 이것은 세균에서 코발라민(비타민 B12) 생합성의 일부로 특히 중요하다. 그 이유는 대사산물이 비타민의 곁사슬에 결합되기 위해 1-아미노프로판-2-올로 전환되기 때문이다.[12]
- 트레오닌은 쥐의 뇌와 간에서 L-카르니틴의 내인성 생성 동안 글리신을 합성하는 데 사용된다.[13][14]
공급원
트레오닌이 많이 함유된 식품으로는 코티지 치즈, 가금류, 생선, 고기, 렌즈콩, 검정거북콩,[15] 및 참깨가 있다.[16]
라세미 트레오닌은 아세트산 수은(II)을 사용하여 알파-기능화에 의해 크로톤산으로부터 제조할 수 있다. threonine can be prepared from crotonic acid by alpha-functionalization using mercury(II) acetate.[17]
같이 보기
각주
- ↑ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ Raïs, Badr; Chassagnole, Christophe; Lettelier, Thierry; Fell, David; Mazat, Jean-Pierre (2001). “Threonine synthesis from aspartate in Escherichia coli cell-free extracts: pathway dynamics”. 《Biochem J》 356 (Pt 2): 425–32. doi:10.1042/bj3560425. PMC 1221853. PMID 11368769.
- ↑ Jastrzab, Renata (2013). "Studies of new phosphothreonine complexes formed in binary and ternary systems including biogenic amines and copper(II)". Journal of Coordination Chemistry. 66 (1): 98–113. doi 10.1080/00958972.2012.746678
- ↑ 《A Dictionary of scientists.》. Daintith, John., Gjertsen, Derek. Oxford: Oxford University Press. 1999. 459쪽. ISBN 9780192800862. OCLC 44963215.
- ↑ Meyer, Curtis (1936년 7월 20일). “The Spatial Configuation of Alpha-Amino-Beta-Hydroxy-n-Butyric Acid” (PDF). 《Journal of Biological Chemistry》 115 (3): 721–729. doi:10.1016/S0021-9258(18)74711-X.
- ↑ “Nomenclature and symbolism for amino acids and peptides (Recommendations 1983)”. 《Pure and Applied Chemistry》 56 (5): 601, 603, 608. 1984년 1월 1일. doi:10.1351/pac198456050595.
- ↑ Institute of Medicine (2002). 〈Protein and Amino Acids〉. 《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ↑ 틀:Lehninger3rd.
- ↑ Stipanuk, Martha H.; Caudill, Marie A. (2013). 《Biochemical, Physiological, and Molecular Aspects of Human Nutrition – E-Book》 (영어). Elsevier Health Sciences. ISBN 9780323266956.
- ↑ Bhardwaj, Uma; Bhardwaj, Ravindra. 《Biochemistry for Nurses》 (영어). Pearson Education India. ISBN 9788131795286.
- ↑ Fang, H; Kang, J; Zhang, D (2017년 1월 30일). “Microbial production of vitamin B12: a review and future perspectives.”. 《Microbial Cell Factories》 16 (1): 15. doi:10.1186/s12934-017-0631-y. PMC 5282855. PMID 28137297.
- ↑ Adeva-Andany, M; Souto-Adeva, G; Ameneiros-Rodríguez, E; Fernández-Fernández, C; Donapetry-García, C; Domínguez-Montero, A (January 2018). “Insulin resistance and glycine metabolism in humans.”. 《Amino Acids》 50 (1): 11–27. doi:10.1007/s00726-017-2508-0. PMID 29094215. S2CID 3708658.
- ↑ Dalangin, R; Kim, A; Campbell, RE (2020년 8월 27일). “The Role of Amino Acids in Neurotransmission and Fluorescent Tools for Their Detection.”. 《International Journal of Molecular Sciences》 21 (17): 6197. doi:10.3390/ijms21176197. PMC 7503967. PMID 32867295.
- ↑ “Error”. 《ndb.nal.usda.gov》. 2018년 11월 16일에 원본 문서에서 보존된 문서. 2013년 5월 29일에 확인함.
- ↑ “SELF Nutrition Data - Food Facts, Information & Calorie Calculator”. 《nutritiondata.self.com》. 2018년 3월 27일에 확인함.
- ↑ Carter, Herbert E.; West, Harold D. (1940). “dl-Threonine”. 《Organic Syntheses》 20: 101.; 《Collective Volume》 3, 813쪽.