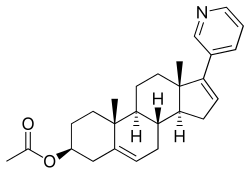
아비라테론 아세테이트
| |

| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
| [(3S,8R,9S,10R,13S,14S)-10,13-다이메틸-17-피리딘-3-일-2,3,4,7,8,9,11,12,14,15-데카하이드로-1H-사아클로펜타[a]페난트렌-3-일] 아세테이트 | |
| 식별 정보 | |
| CAS 등록번호 | 154229-18-2 154229-19-3 (아비라테론) |
| ATC 코드 | L02BX03 |
| PubChem | 9821849 |
| 드러그뱅크 | DBSALT001173 |
| ChemSpider | 7997598 |
| 화학적 성질 | |
| 화학식 | C26H33NO2 |
| 분자량 | ? |
| 유의어 | CB-7630; JNJ-212082; 17-(3-Pyridinyl)androsta-5,16-dien-3β-ol acetate |
| 물리적 성질 | |
| 녹는점 | 144–145 °C (291–293 °F) [1] |
| 약동학 정보 | |
| 생체적합성 | 알려지지 않음 (공복 시 최대 50%일 수 있음)[2] |
| 단백질 결합 | 아비라테론: ~99.8% (알부민과 α1-AGp)[2][3][4] |
| 동등생물의약품 | ? |
| 약물 대사 | 에스터레이스, CYP3A4, SULT2A1[4] |
| 생물학적 반감기 | 아비라테론: 12–24시간[3][2][5] |
| 배출 | 대변: 88%[3][4] 소변: 5%[3][4][5] |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | D(오스트레일리아)[6] |
| 법적 상태 | |
| 투여 방법 | 경구 투여[3][5] |
아비라테론 아세테이트(Abiraterone acetate)는 자이티가(Zytiga)라는 이름으로 판매되고 있는 약제로, 전립선암 치료제이다.[9] 특히 전이성 거세저항성 전립선암(mCRPC)과 전이성 거세민감성 전립선암(mCSPC)의 치료제인 코르티코스테로이드와 함께 쓰인다.[3][10] 고환절제술 이후 혹은 생식샘자극호르몬분비호르몬 유사체와 함께 사용된다.[11] 경구 투여한다.[12]
일반적인 부작용으로는 졸음, 구토, 두통, 관절 통증, 고혈압, 종창, 저칼륨혈증, 고혈당, 열감, 설사, 기침 등이 있다.[13][14] 다른 심각한 부작용으로는 간부전, 부신겉질부전 등이 있다.[15] 임신을 준비하는 남성은 피임을 권한다.[15] 아비라테론 아세테이트로 투여되어 체네에서 아비라테론으로 전환된다.[16] 남성 호르몬 안드로겐의 생성을 차단하며 작용하는데 특히 CYP17A1 효소를 차단한다. 그렇게 함으로써 테스토스테론의 생성이 감소한다. 결과적으로 전립선암의 호르몬 작용을 막는다.[17]
아비라테론 아세테이트는 1995년에 발명 되었고 2011년에 미국과 유럽 연합에서 의료용으로 승인되었다.[18][19] WHO 필수 의약품 목록에 있다.[20][21] 이 약은 일반 약품으로 구매 가능하다.[22]
의학적 용도
[편집]아비라테론 아세테이트는 프리드니손, 코르티코스테로이드와 함께 사용 되어 전이성 거세저항성 전립선암(mCRPC)을 치료한다. 과거에는 전이성 거세저항성 전립선암(mCRPC)을 호르몬 저항, 혹은 호르몬 불응성 전립선 암 이라고 불렀다.[23][24][8][7] 이는 가장 중요한 안드로겐 차단용법이나 안드로겐수용체 길항제를 통한 치료에 반응하지 않는 전립선암의 한 형태였다. 아비라테론 아세테이트는 이러한 기능으로 2011년 4월 28일에 미국 식품의약국(FDA)의 승인을 받았고, 그 뒤로도 2011년 9월 23일에 유럽 의약품 감독국(EMA), 2011년 9월 5일에 영국 의약품규제청(MHRA), 그리고 2012년 3월 1일에 호주식약처(TGA)의 승인을 받았다.[25][26][27] 호주에서는 거세저항성 전립선암을 프레드니손이나 프레드니솔론으로 치료할 때에는 호주의 의약품 관리 체계인 PBS(Pharmaceutical Benefits Scheme)의 지원을 받는다. 지원 조건은 환자가 최근에 항암 치료를 받고 있고 도시탁셀에 저항하거나 과민한 상태이며, WHO 기준 활동도가 2점 이하이며, 아비라테론 아세테이트에 대한 PBS의 보조금을 받아 치료를 받기 시작한 이후 질병의 진행이 없는 상태여야 한다.[28] Yonsa Mpred라는 제품명으로 판매되고 있는 아비라테론 아세테이트와 메틸프레드니솔론은 아비라테론 아세테이트(Yonsa)와 메틸프레드니솔론을 모두 포함하고 있는 합성물 패키지이다. 이 약품은 2022년 3월에 호주에서 의학 용도로 승인을 받았다.[29][30][31]
금기증
[편집]아비라테론 아세테이트에 과민증이 있는 사람이 복용해서는 안된다. 임산부 혹은 임신 가능성이 있는 여성은 복용할 수 없다고 설명되어 있으나,[32][33] 여성은 이 약을 복용할 의학적인 이유가 전혀 없다. 임산부는 장갑을 착용하지 않고 이 약을 만지는 것조차 금기 한다..[33] 기타 주의사항으로는 심각한 간장애 기저 질환, 알도스테론증, 심부전과 고혈압 등 심혈관계 질환, 저칼륨혈증, 부신 기능부전 등이 있다.[34]
부작용
[편집]빈도별 부작용
매우 흔함 (>10% 빈도):
흔함 (1-10% 빈도):
흔치 않음 (0.1-1% 빈도):
- 부신기능저하증
- 근질환
- 횡문근융해증
희귀 (<0.1빈도):
- 알레르기성 폐포염
과다 복용
[편집]아비라테론 아세테이트 과다 복용의 경험은 제한적이다.[35] 아비라테론 아세테이트 과다복용에는 특별한 해독제가 없다. 과다 복용 치료는 심장과 간의 기능을 관찰하는 일반적인 보조 치료를 포함해야 한다. .[35]
상호작용
[편집]아비라테론 아세테이트는 CYP3A4 기질이므로 CYP3A4를 강하게 억제하는 약물이나 유도물질과 동시에 투여 하면 안된다. CYP3A4 억제제로는 케토코나졸, 이트라코나졸, 클래리스로마이신, 아타자나비르, 니프리핀, 사퀴나비르, 테리스로마이신, 리토나비르, 인디나비르, 넬피나비어, 보리코나졸 등이 있고, 유도물질로는 페니토인, 카르바마제핀, 리팜피신, 리파부틴, 리파펜틴, 페노바르비탈 등이 있다.[36][37] 이것들은 또한 CYP1A2, CYP2C9, CYP3A4를 억제하므로 마찬가지로 치료 범위가 작은 어떤 효소 물질과도 함께 투여 하면 안된다.[38][39] 스피로놀락톤은 본래 항안드로겐 작용을 가지고 있으나, 안드로겐이 감소된 상황에서는 전립선암의 활성을 유도하며 안드로겐 수용체 작용제의 역할을 한다는 실험 결과도 있다..[40] 이러한 주장은 몇 가지 사례에 대한 연구 결과에 서술 되어 있다.[41]
약리학
[편집]약리학
[편집]항안드로겐 작용
[편집]- ↑ Potter GA, Barrie SE, Jarman M, Rowlands MG (June 1995). “Novel steroidal inhibitors of human cytochrome P45017 alpha (17 alpha-hydroxylase-C17,20-lyase): potential agents for the treatment of prostatic cancer”. 《Journal of Medicinal Chemistry》 38 (13): 2463–2471. doi:10.1021/jm00013a022. PMID 7608911.
- ↑ 가 나 다 Benoist GE, Hendriks RJ, Mulders PF, Gerritsen WR, Somford DM, Schalken JA, van Oort IM, Burger DM, van Erp NP (November 2016). “Pharmacokinetic Aspects of the Two Novel Oral Drugs Used for Metastatic Castration-Resistant Prostate Cancer: Abiraterone Acetate and Enzalutamide”. 《Clin Pharmacokinet》 55 (11): 1369–1380. doi:10.1007/s40262-016-0403-6. PMC 5069300. PMID 27106175.
- ↑ 가 나 다 라 마 바 사 아 “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ 가 나 다 라 “Meeting Library - Meeting Library”. 《meetinglibrary.asco.org》. 2016년 9월 20일에 원본 문서에서 보존된 문서. 2016년 9월 9일에 확인함.
- ↑ 가 나 다 라 “Yonsa- abiraterone acetate tablet”. 《DailyMed》. 2018년 6월 5일. 2020년 8월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Abiraterone Use During Pregnancy”. 《Drugs.com》. 2020년 3월 13일. 2020년 11월 25일에 원본 문서에서 보존된 문서. 2020년 6월 8일에 확인함.
- ↑ 가 나 “Zytiga abiraterone acetate product information”. 《TGA eBusiness Services》. Janssen-Cilag Pty Ltd. 2012년 3월 1일. 2020년 11월 24일에 원본 문서 (PDF)에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ 가 나 “Zytiga 500 mg film-coated tablets - Summary of Product Characteristics (SmPC)”. 《electronic medicines compendium (emc)》. Datapharm. 2019년 3월 4일. 2019년 11월 15일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Abiraterone Acetate Monograph for Professionals”. 《Drugs.com》 (영어). 2012년 5월 6일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Abiraterone Acetate Monograph for Professionals”. 《Drugs.com》 (영어). 2012년 5월 6일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Abiraterone Acetate Monograph for Professionals”. 《Drugs.com》 (영어). 2012년 5월 6일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ 가 나 “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Abiraterone Acetate Monograph for Professionals”. 《Drugs.com》 (영어). 2012년 5월 6일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ Scowcroft H (2011년 9월 21일). “Where did abiraterone come from?”. 《Journal of Medicinal Chemistry》 (Cancer Research UK) 38 (13): 2463–2471. 2011년 9월 25일에 원본 문서에서 보존된 문서. 2011년 9월 28일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ World Health Organization (2019). 《World Health Organization model list of essential medicines: 21st list 2019》. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ World Health Organization (2021). 《World Health Organization model list of essential medicines: 22nd list (2021)》. Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ↑ “First Generic Drug Approvals”. 《U.S. Food and Drug Administration》. 2022년 10월 17일. 2022년 11월 28일에 확인함.
- ↑ “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga EPAR”. 《European Medicines Agency (EMA)》. 2019년 3월 13일. 2020년 12월 27일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga EPAR”. 《European Medicines Agency (EMA)》. 2019년 3월 13일. 2020년 12월 27일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga 500 mg film-coated tablets - Summary of Product Characteristics (SmPC)”. 《electronic medicines compendium (emc)》. Datapharm. 2019년 3월 4일. 2019년 11월 15일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga abiraterone acetate product information”. 《TGA eBusiness Services》. Janssen-Cilag Pty Ltd. 2012년 3월 1일. 2020년 11월 24일에 원본 문서 (PDF)에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ “Pharmaceutical Benefits Scheme - Abiraterone”. 《Pharmaceutical Benefits Scheme》. 2020년 12월 2일에 원본 문서에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ “TGA eBS - Product and Consumer Medicine Information Licence”.
- ↑ YONSA MPRED abiraterone acetate 125 mg tablet bottle and methylprednisolone 4 mg tablet bottle composite pack
- ↑ YONSA MPRED (Sun Pharma ANZ Pty Ltd)
- ↑ “Zytiga EPAR”. 《European Medicines Agency (EMA)》. 2019년 3월 13일. 2020년 12월 27일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ 가 나 “Zytiga prescribing information” (PDF). Janssen Biotech. May 2012. 2014년 11월 13일에 원본 문서 (PDF)에서 보존된 문서. 2016년 3월 4일에 확인함.
- ↑ “Zytiga (abiraterone) dosing, indications, interactions, adverse effects, and more”. 《Medscape Reference》. WebMD. 2014년 2월 2일에 원본 문서에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ 가 나 “Zytiga- abiraterone acetate tablet, film coated”. 《DailyMed》. 2019년 6월 13일. 2014년 11월 13일에 원본 문서에서 보존된 문서. 2019년 11월 15일에 확인함.
- ↑ “Zytiga (abiraterone) dosing, indications, interactions, adverse effects, and more”. 《Medscape Reference》. WebMD. 2014년 2월 2일에 원본 문서에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ “Zytiga prescribing information” (PDF). Janssen Biotech. May 2012. 2014년 11월 13일에 원본 문서 (PDF)에서 보존된 문서. 2016년 3월 4일에 확인함.
- ↑ “Zytiga (abiraterone) dosing, indications, interactions, adverse effects, and more”. 《Medscape Reference》. WebMD. 2014년 2월 2일에 원본 문서에서 보존된 문서. 2014년 1월 24일에 확인함.
- ↑ “Zytiga prescribing information” (PDF). Janssen Biotech. May 2012. 2014년 11월 13일에 원본 문서 (PDF)에서 보존된 문서. 2016년 3월 4일에 확인함.
- ↑ Luthy IA, Begin DJ, Labrie F (November 1988). “Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma (Shionogi) cells in culture”. 《Journal of Steroid Biochemistry》 31 (5): 845–52. doi:10.1016/0022-4731(88)90295-6. PMID 2462135.
- ↑ Dhondt B, Buelens S, Van Besien J, Beysens M, De Bleser E, Ost P, Lumen N (2019). “Abiraterone and spironolactone in prostate cancer: a combination to avoid”. 《Acta Clinica Belgica》 74 (6): 439–444. doi:10.1080/17843286.2018.1543827. PMID 30477405. S2CID 53738534.
