수소-칼륨 ATP가수분해효소
| ATP가수분해효소, H+/K+ 교환, 알파 폴리펩타이드 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 상징 | ATP4A | ||||||
| NCBI 유전자 | 495 | ||||||
| HGNC | 819 | ||||||
| OMIM | 137216 | ||||||
| RefSeq | NM_000704 | ||||||
| UniProt | P20648 | ||||||
| 다른 정보 | |||||||
| EC 번호 | 7.2.2.19 | ||||||
| 유전자 자리 | Chr. 19 q13.1 | ||||||
| |||||||
수소-칼륨 ATP가수분해효소(영어: hydrogen potassium ATPase)는 위를 산성화시키는 역할을 담당하는 효소이다.[1] H+/K+-ATP가수분해효소(영어: H+/K+-ATPase)라고도 한다. 수소-칼륨 ATP가수분해효소는 E1-E2 ATP가수분해효소라고도 하는 P형 ATP가수분해효소의 구성원이다.[2]
생물학적 기능
[편집]수소-칼륨 ATP가수분해효소는 위에서 양성자 펌프의 역할을 하는데, 위 내강의 칼륨 이온을 세포질의 하이드로늄 이온과 교환한다.[2] 또한 위 내용물을 산성으로 만들어 소화효소인 펩신을 활성화시키는 데에 주된 역할을 맡는다.[3]
H+/K+ ATP가수분해효소는 주로 벽세포에서 발견된다. 벽세포는 위의 점막에 위치한 고도로 특수화된 상피세포이다. 벽세포는 광범위한 분비 막 시스템을 가지고 있으며 H+/K+ ATP가수분해효소는 벽세포 막을 구성하는 주된 분비 단백질이다. 콩팥속질에서도 약간의 H+/K+ ATP가수분해효소가 발현된다.[2]
유전자와 단백질 구조
[편집]H+/K+ ATP가수분해효소는 두 개의 유전자로부터 생산되는 이종이량체 단백질이다. 유전자 ATP4A[4]는 α 소단위체를 암호화한다. α 소단위체는 대략 1000개의 아미노산으로 구성되어 있으며 효소의 활성 부위를 포함하고 있다. 또한 세포막에 구멍을 형성하여 이온이 수송될 수 있도록 한다. 하이드로늄 이온은 α 소단위체에 존재하는 두 개의 활성 부위에 결합한다.[5] 또한 α 소단위체는 인산화 부위 Asp385를 가지고 있다.[6] 유전자 ATP4B[7]는 H+/K+ ATP가수분해효소의 β 소단위체를 암호화한다. β 소단위체는 대략 300개의 아미노산으로 이루어져 있는데, 36개 아미노산으로 구성된 N말단 세포질 도메인, 하나의 막관통 도메인, 고도로 글리코실화되어 있는 세포외 도메인이 들어가 있다.
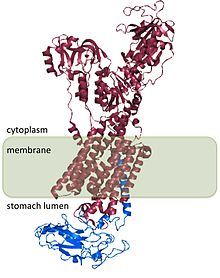
H+/K+ ATP가수분해효소의 β 소단위체는 α 소단위체를 안정하게 만들며 효소 기능에 필수적이다. β 소단위체는 수소-칼륨 펌프가 거꾸로 작용하는 것을 막으며[8] 이종이량체 단백질이 세포 안에서 세포막으로 이동하도록 하는 신호를 포함하고 있다. 이러한 신호 중 일부는 α 소단위체에서 발견되는 신호에 종속적이다.
H+/K+ ATP가수분해효소의 구조는 사람, 개, 돼지, 쥐, 토끼에서 완전히 밝혀져 있으며 모든 종에서 98%의 상동성을 보인다.[2]
효소 기전과 활성
[편집]H+/K+ ATP가수분해효소는 P형 ATP가수분해효소 중에서도 진핵생물 클래스인 P2형 ATP가수분해효소의 일종이다.[9] Ca2+이나 Na+/K+ ATP가수분해효소처럼 H+/K+ ATP가수분해효소도 α, β 기본단위체로 기능한다[10] 다른 진핵생물 ATP가수분해효소와 달리 H+/K+ ATP가수분해효소는 하나의 양성자를 위 내강으로 이동시키고 하나의 칼륨 이온을 위 내강으로부터 내보내므로 전기중립(electroneutral)이다.[9] 이온 펌프로서 H+/K+ ATP가수분해효소는 ATP를 가수분해시킨 에너지를 사용하여 이온을 농도 차이에 역행하여 운반할 수 있다. 다른 P형 ATP가수분해효소와 마찬가지로 수송 사이클 도중 인산기가 ATP에서 H+/K+ ATP가수분해효소로 전달된다. 이 인산기가 효소의 형태 변화를 일으켜 이온의 수송을 돕는다.
H+/K+ ATP가수분해효소는 장크롬친화성유사세포(ECL 세포)가 히스타민을 방출하게 만드는 가스트린에 의해 간접적으로 활성화된다.[11] 히스타민은 벽세포의 H2 수용체에 결합하여 cAMP 의존성 경로를 활성화시킨다. cAMP 의존성 경로는 효소가 세포질에서 자극된 벽세포 막의 소관(canaliculi)으로 이동하도록 한다.[2] 한번 위치를 이동한 후에 H+/K+ ATP가수분해효소는 E1과 E2 형태를 오가면서 이온을 막 너머로 수송한다.

임상적 관련성
[편집]위 식도 역류병(GERD)이나 소화성 궤양을 치료하는 가장 흔한 방법이 H+/K+ ATP가수분해효소를 억제하여 위의 산도를 떨어뜨리는 것이다.[12] 산도를 떨어뜨려 질환의 증상을 완화시킬 수는 있으나 GERD나 소화성 궤양의 근본적인 원인을 해결하지는 못한다. GERD의 근본적인 원인은 아래식도조임근이 비정상적으로 이완되는 것이고, 소화성 궤양의 흔한 원인은 위나선균(H. pylori) 감염이나 비스테로이드 항염증제(NSAIDs) 사용이다.[13]
같이 보기
[편집]- ATP가수분해효소 (ATPase)
- 양성자 ATP가수분해효소 (양성자 ATPase)
- P형 ATP가수분해효소 (P형 ATPase)
- Na+/K+-ATP가수분해효소 (Na+/K+-ATPase)
각주
[편집]- ↑ Sakai, Hideki; Fujii, Takuto; Takeguchi, Noriaki (2016). 〈Chapter 13. Proton-Potassium (H+/K+) ATPases: Properties and Roles in Health and Diseases〉. Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel. 《The Alkali Metal Ions: Their Role in Life》. Metal Ions in Life Sciences 16. Springer. 459–483쪽. doi:10.1007/978-3-319-21756-7_13. PMID 26860309.
- ↑ 가 나 다 라 마 바 Shin, J. M.; Munson, K.; Vagin, O.; Sachs, G. (2009). “The gastric HK-ATPase: structure, function and inhibition.”. 《Pflügers Archiv: European Journal of Physiology》 457 (3): 609–622. doi:10.1007/s00424-008-0495-4. PMC 3079481. PMID 18536934.
- ↑ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2012). 《Biochemistry》 7판. New York: W.H. Freeman and Company.
- ↑ ATP4A ATPase H+/K+ transporting alpha subunit
- ↑ Chourasia, M.; Sastry, G. M.; Sastry. G. N. (2005). “Proton binding sites and conformational analysis of H+K+-ATPase”. 《Biochemical and Biophysical Research Communications》 336 (3): 961–966. doi:10.1016/j.bbrc.2005.08.205. PMID 16157306.
- ↑ Scheirlinckx, F.; Raussens, V.; Ruysschaert, J.-M.; Goormaghtigh, E. (2004). “Conformational changes in gastric H+/K+-ATPase monitored by difference Fourier-transform infrared spectroscopy and hydrogen/deuterium exchange”. 《Biochemical Journal》 Pt 1판 382 (Pt 1): 121–129. doi:10.1042/BJ20040277. PMC 1133922. PMID 15096097.
- ↑ ATP4B ATPase H+/K+ transporting beta subunit
- ↑ Abe, K.; Tani, K.; Nishizawa, T.; Fujiyoshi, Y. (2009). “Inter-subunit interaction of gastric H+,K+-ATPase prevents reverse reaction of the transport cycle”. 《The EMBO Journal》 28 (11): 1637–1643. doi:10.1038/emboj.2009.102. PMC 2693145. PMID 19387495.
- ↑ 가 나 Shin, J. M.; Sachs, G. (2009). “Ion Motive ATPases: P-type ATPases”. 《eLS》. doi:10.1002/9780470015902.a0001379.pub2. ISBN 978-0470016176.
- ↑ Dach, I.; Olesen, C.; Signor, L.; Nissen, P.; le Maire, M.; Møller, J. V.; Ebel, C. (2012). “Active Detergent-solubilized H+,K+-ATPase Is a Monomer”. 《The Journal of Biological Chemistry》 287 (50): 41963–41978. doi:10.1074/jbc.M112.398768. PMC 3516743. PMID 23055529.
- ↑ Prinz, C.; Kajimura, M.; Scott, D.; Helander, H.; Shin, J.; Besancon, M.; Bamberg, K.; Hersey, S.; Sachs, G. (1992). “Acid secretion and the H,K ATPase of stomach”. 《The Yale Journal of Biology and Medicine》 65 (6): 577–596. PMC 2589780. PMID 1341065.
- ↑ Shin, J. M.; Vagin, O.; Munson, K.; Kidd, M.; Modlin, I. M.; Sachs, G. (2008). “Molecular mechanisms in therapy of acid-related diseases”. 《Cellular and Molecular Life Sciences》 65 (2): 264–281. doi:10.1007/s00018-007-7249-x. PMC 3081136. PMID 17928953.
- ↑ Yeomans, N. D. (2011). “The ulcer sleuths: The search for the cause of peptic ulcers”. 《Journal of Gastroenterology and Hepatology》 26: 35–41. doi:10.1111/j.1440-1746.2010.06537.x. PMID 21199512. S2CID 42592868.
