중추관용
인간 면역계에서 중추관용(또는 음성 선택)은 자가 반응성을 가지는 발달 중인 T세포나 B세포를 제거하는 과정이다.[1] 자가 반응성 림프구의 제거를 통해 내성은 면역계가 자가 펩타이드를 공격하지 않도록 한다.[2] 림프구 성숙과 중추관용은 골수나 가슴샘과 같은 일차 림프 기관에서 발생한다. 포유류에서 B세포는 골수에서 성숙하고 T세포는 가슴샘에서 성숙한다.[1]
중추관용은 완벽하지 않으므로 말초관용이 T세포와 B세포가 일단 일차 림프 기관을 떠나고 말초에서 숙주의 자가 조직과 반응하지 않도록 하는 이차 기전으로 존재한다.[3] 중추관용은 발달 중인 면역 세포가 말초로 빠져나오기 전에 일차 림프 기관에서 발생하고, 말초관용은 일차 림프 기관을 빠져나가면 발생한다는 점에서 구별된다.[1]
중추관용의 기능
[편집]중추관용은 성숙한 B세포와 T세포가 자가 항원을 외래 미생물로 인식하지 못하도록 하기 때문에 적절한 면역 세포 기능에 필수적이다.[2] 보다 구체적으로 T세포 수용체(TCR)와 B세포 수용체(BCR)는 무작위 체세포 재배열을 통해 세포에 의해 만들어지기 때문에 중추 관용이 필요하다.[1] V(D)J 재조합으로 알려진 이 재배열 과정은 림프구 수용체 다양성을 증가시켜 B세포와 T세포가 새로운 항원에 대한 수용체를 가질 가능성을 증가시키기 때문에 중요하다.[1] 접합 다양성은 재조합 중에 발생하며 BCR 및 TCR의 다양성을 더욱 증가시키는 역할을 한다.[1] 무작위 TCR, BCR의 생성은 높은 돌연변이율로 인해 미생물에 대한 중요한 방어 방법이다. 또한 무작위 재배열 과정은 종의 생존에 중요한 역할을 한다. 왜냐하면 종 내의 많은 개체가 각자 다양한 수용체 배열을 가지고, 종의 적어도 한 구성원이 새로운 항원에 대한 수용체를 가질 가능성이 매우 높기 때문이다.[1]
체세포 재조합 과정은 성공적인 면역 방어에 필수적이지만 자가 반응으로 이어질 수 있다. 예를 들어 체세포 재조합에 필요한 효소인 기능적 RAG1/2의 결핍은 환자의 혈액 세포에 대해 항체가 생성되는 면역 혈구감소증의 발병과 관련이 있다.[4] 무작위 수용체 재조합의 특성으로 인해 자기 항원을 외부 항원으로 인식하는 BCR과 TCR이 일부 생성된다.[2] 이 B세포와 T세포가 활성화되면 중추관용 기전에 의해 죽거나 비활성화되지 않으면 자기에 대한 면역 반응을 일으키기 때문에 문제가 된다.[2] 따라서 중추관용이 없으면 면역계가 자신을 공격하여 자가 면역 장애를 유발할 수 있다.[2][3]
중추관용의 기전
[편집]관용의 최종 결과는 자가 항원에 반응하지 않지만 무작위로 배열된 수용체에 따라 외래의 비자기 항원을 인식할 수 있는 림프구 집단이다.[2] 림프구는 골수(B세포의 경우)와 가슴샘(T세포의 경우)에 존재하는 항원에 대해서만 관용을 발달시킬 수 있다.
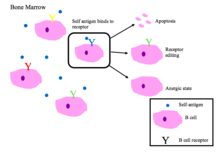
B세포 관용
[편집]골수의 미성숙 B세포는 자가 펩타이드에 결합할 때 음성 선택을 겪는다.[2]
제대로 기능하는 B세포 수용체는 비자기 항원이나 PAMP를 인식한다.[1]
- 세포자멸사(클론 결실)
- 수용체 편집: 자가 반응성 B세포는 유전자를 재배열하여 특이성을 변화시키고 자가 반응하지 않는 새로운 BCR을 발달시킨다. 이 과정은 B 세포가 세포사멸 신호를 받거나 무반응 상태가 되기 전에 BCR을 다시 편집할 기회를 준다.
- 무반응 유도(항원에 대한 반응이 일어나지 않는 상태)

T세포 관용
[편집]T세포 중추관용은 가슴샘에서 발생한다.[1] T세포는 양성 선택과 음성 선택을 겪는다.[2]
T세포 수용체는 결합된 비자기 펩타이드와 함께 자기 주조직 적합성 복합체(MHC) 분자를 인식하는 능력이 있어야 한다.[1]
T세포 관용 단계[2]
- 양성 선택에서는 펩타이드-MHC 복합체에 결합하는 T세포의 친화력이 확인된다. T 세포가 MHC 클래스 I 또는 MHC 클래스 II 복합체에 결합할 수 없으면 생존 신호를 받지 못하므로 세포 사멸을 통해 T세포가 죽게 된다. 펩타이드-MHC 복합체에 대해 충분한 친화성을 갖는 T세포 수용체가 생존을 위해 선택된다.
- 음성 선택 동안에는 T세포의 자가 반응성(자기 조직에 대한 친화성)이 테스트된다. T세포가 펩타이드에 결합하면 세포자멸사(클론 결실 과정) 신호를 받는다.
- 가슴샘 상피 세포는 T세포에 대한 자가 항원을 발현하여 자가 친화도를 테스트한다.
- 전사 조절자 AIRE는 가슴샘 상피 세포에서 자가 조직 항원의 발현에 중요한 역할을 한다.
- 음성 선택은 겉질-속질 접합부와 가슴샘 속질에서 발생한다.
- 자가 결합하지 않지만 항원/MHC 복합체를 인식하고 CD4+ 또는 CD8+인 T세포는 성숙한 미접촉 T세포로서 이차 림프 기관으로 이동한다.
조절 T세포는 가슴샘에서 성숙하는 또 다른 유형의 T세포이다. 조절 T세포의 선택은 가슴샘 속질에서 발생하며 FOXP3의 전사를 동반한다. 조절 T세포는 활성화되지 않아야 할 때 면역계를 억제하여 자가 면역을 조절하는 데 중요하다.[5]

중추관용의 결함으로 인한 유전 질환
[편집]중추관용의 유전적 결함은 자가 면역으로 이어질 수 있다.
- 자가면역 다발성 내분비병증 증후군 제1형은 인간 유전자 AIRE의 돌연변이로 인해 발생한다. 이로 인해 가슴샘에서 말초 항원의 발현이 부족해져 인슐린과 같은 주요 말초 단백질에 대한 음성 선택이 결핍된다.[6][7] 따라서 여러 자가 면역 증상이 나타난다.
중추관용의 역사
[편집]중추관용의 첫 번째 발견은 1945년 레이 오웬(Ray Owen)이 쌍둥이 중 한 마리가 다른 쪽의 혈액을 주입받았을 때 이란성 쌍둥이 소가 항체를 생산하지 않는다는 것을 발견했을 때였다.[8] 오웬의 발견은 하세크(Hasek)와 빌링햄(Billingham)의 이후 실험에 의해 확인되었다.[8] 실험의 결과는 버넷(Burnet)의 클론 선택 가설에 의해 설명되었다.[9] 버넷과 메더워(Medawar)는 면역관용이 어떻게 작용하는지 설명한 공로로 1960년 노벨 생리학·의학상을 수상했다.[9][10]
각주
[편집]- ↑ 가 나 다 라 마 바 사 아 자 차 카 Owen, Judith A; Punt, Jenni; Stranford, Sharon A; Jones, Patricia P; Kuby, Janis (2013). 《Kuby immunology》 7판. New York: W.H. Freeman. ISBN 978-1-4292-1919-8. OCLC 820117219.
- ↑ 가 나 다 라 마 바 사 아 자 차 “Immunological tolerance and autoimmunity”. 《Internal and Emergency Medicine》 1 (3): 187–96. 2006. doi:10.1007/bf02934736. PMID 17120464.
- ↑ 가 나 Janeway, Charles (2011). 《Immunobiology 5: The Immune System in Health and Disease》 5판. New York: Garland. ISBN 978-0-8153-3642-6. OCLC 45708106.
- ↑ “Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations”. 《The Journal of Allergy and Clinical Immunology》 133 (3): 880–2.e10. March 2014. doi:10.1016/j.jaci.2013.11.038. PMC 4107635. PMID 24472623.
- ↑ “Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells”. 《Nature》 441 (7090): 235–8. May 2006. doi:10.1038/nature04753. PMID 16648838.
- ↑ “Projection of an immunological self shadow within the thymus by the aire protein”. 《Science》 298 (5597): 1395–401. November 2002. doi:10.1126/science.1075958. PMID 12376594.
- ↑ “Aire regulates negative selection of organ-specific T cells”. 《Nature Immunology》 4 (4): 350–4. April 2003. doi:10.1038/ni906. PMID 12612579.
- ↑ 가 나 “Historical overview of immunological tolerance”. 《Cold Spring Harbor Perspectives in Biology》 4 (4): a006908. April 2012. doi:10.1101/cshperspect.a006908. PMC 3312674. PMID 22395097.
- ↑ 가 나 “Immunological tolerance 50 years after the Burnet Nobel Prize”. 《Immunology and Cell Biology》 89 (1): 14–5. January 2011. doi:10.1038/icb.2010.138. PMID 21209621.
- ↑ “The curious case of the 1960 Nobel Prize to Burnet and Medawar”. 《Immunology》 147 (3): 269–74. March 2016. doi:10.1111/imm.12558. PMC 4754613. PMID 26790994.

