당펩타이드
당펩타이드(영어: glycopeptide)는 펩타이드를 구성하는 아미노산 잔기의 곁사슬에 공유 결합되어 있는 탄수화물 부분(글리칸)을 포함하고 있는 펩타이드이다.
지난 수십 년 동안 세포 표면의 글리칸(막단백질 또는 지질에 부착됨)과 단백질에 결합된 글리칸(당단백질)이 생물학에서 중요한 역할을 한다는 사실이 밝혀졌다. 예를 들어 이러한 구조는 수정,[1] 면역계,[2] 뇌 발달,[3] 내분비계[3] 및 염증[3]에서 중요한 역할을 하는 것으로 나타났다.[4][5]
당펩타이드의 합성은 연구자들이 자연에서 글리칸이 어떤 기능을 하는지 밝히고, 유용한 치료 및 생명공학적으로 응용할 수 있는 생물학적 탐침을 제공한다.
글리코펩타이드 결합의 다양성[편집]
N-결합 글리칸[편집]
N-결합 글리칸은 글리칸이 아스파라긴(Asn) 잔기에 부착되어 있으며, 자연에서 발견되는 가장 일반적인 결합에 속한다는 사실에서 그 이름이 유래되었다. 대부분의 N-결합 글리칸은 GlcNAc-β-Asn[6]의 형태를 취하지만 GlcNAc-α-Asn[7] 및 Glc-Asn[8]과 같은 보다 일반적이지 않은 구조적 결합도 관찰되었다. 단백질 접힘 및 세포부착 기능 외에도 단백질의 N-결합 글리칸은 단백질의 기능을 조절할 수 있으며 경우에 따라서는 온-오프 스위치 역할을 할 수 있다.[5]
 |
O-결합 글리칸[편집]
O-결합 글리칸은 글리칸과 아미노산 곁사슬의 하이드록실기(보통 세린 또는 트레오닌에서 유래) 사이의 결합에 의해 형성된다. 대부분의 O-연결 글리칸은 GlcNAc-β-Ser/Thr 또는 GalNAc-α-Ser/Thr의 형태를 취한다.[6]
 |
C-결합 글리칸[편집]
세 가지 결합 중 가장 흔하고 가장 이해하기 어려운 것은 C-결합 글리칸이다. C-결합은 트립토판 잔기에 만노스가 공유 결합된 것을 지칭한다. C-결합 글리칸의 예는 α-만노실 트립토판이다.[9][10]
당펩타이드의 합성[편집]
당펩타이드를 합성하기 위한 몇 가지 방법들이 문헌으로 보고되어 있다. 이러한 방법들 중 가장 일반적인 방법은 다음과 같다.
고체상 펩타이드 합성[편집]
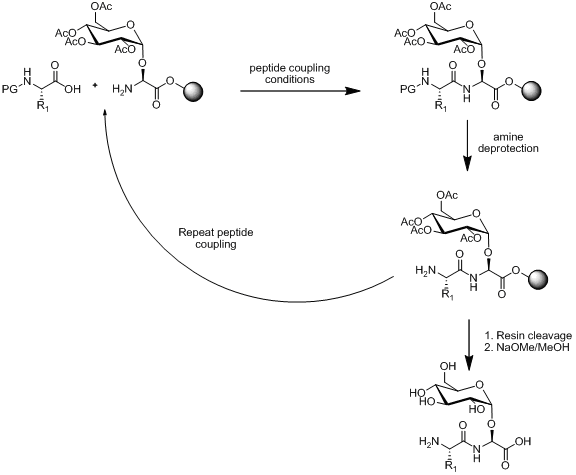
고체상 펩타이드 합성(SPPS)에서 당펩타이드 합성을 위한 두 가지 방식으로 선형 어셈블리 및 수렴 어셈블리가 있다. 선형 어셈블리는 빌딩 블록을 합성한 다음 고체상 펩타이드 합성을 이용하여 빌딩 블록을 함께 부착시킨다. 고체상 펩타이드 합성의 개요가 아래에 그림으로 설명되어 있다.
 |
아래의 그림과 같이 단당류 아미노산 빌딩 블록의 합성을 위한 몇 가지 방법이 있다.
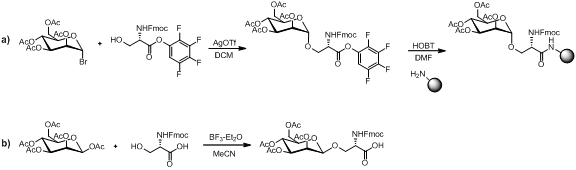 |
단당류 아미노산 빌딩 블록이 펩타이드 결합 조건, 아민 탈보호 조건 및 수지 절단에 대해 안정적이다. 선형 어셈블리는 문헌에 많은 예시들이 있으며 당펩타이드 합성을 위한 대중적인 방식이다.[13][14][15]
수렴 어셈블리 방식에서 펩타이드 사슬과 글리칸 잔기는 먼저 별도로 합성된다. 그런 다음 글리칸은 펩타이드 사슬의 특정 잔기로 글리코실화된다. 이 방식은 글리코실화 단계에서의 낮은 반응 수율로 인해 선형 어셈블리에 비해 대중적이지 않다.[16]
당펩타이드 라이브러리를 생성하는 또 다른 방식은 Glyco-SPOT 합성 기술을 사용하는 것이다.[17] 이 기술은 기존의 SPOT 합성 방법을 확장한 것이다.[18] 이 방법에서 당펩타이드 라이브러리는 고체상 역할을 하는 셀룰로스 표면(예: 여과지)에서 생성된다. 당펩타이드는 FMOC 보호 아미노산을 발견하여 생성되어 매우 적은 양의 아미노산을 사용하여 마이크로그램(나노몰) 스케일로 합성을 수행할 수 있다. 이 기술의 스케일은 펩타이드 당 더 적은 양의 아미노산을 사용하여 스크리닝을 위한 라이브러리를 만드는 데 유리할 수 있다. 그러나 더 많은 양의 당펩타이드를 생산하려면 전통적인 수지 기반의 고체상 기술이 더 나을 수 있다.
천연 화학적 라이게이션[편집]
천연 화학적 라이게이션(NCL)은 당펩타이드 절편의 선형 커플링을 기반으로 하는 수렴 합성 방법이다. 이 기술은 아래의 그림과 같이 한 펩타이드 절편의 N-말단 시스테인 잔기와 다른 펩타이드 절편의 C-말단 싸이오에스터 사이의 화학선택성 반응을 사용한다.[19]
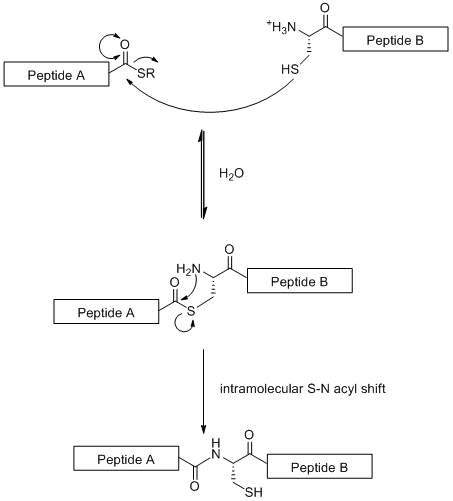 |
표준적인 고체상 펩타이드 합성(아미노산 잔기가 50개로 제한됨)과는 달리 천연 화학적 라이게이션은 큰 당펩타이드를 합성할 수 있다. 그러나 이러한 방법은 자연에서 드문 아미노산 잔기인 N-말단에 시스테인 잔기가 필요하다는 사실에 의해 제한된다.[19] 그러나 이 문제는 부분적으로 시스테인 잔기를 선택적 탈황에 의해 알라닌으로 전환시키는 것으로 해결되었다.[20]
같이 보기[편집]
각주[편집]
- ↑ Talbot P.; Shur B. D.; Myles D. G. (2003). “Cell adhesion and fertilization: Steps in oocyte transport, sperm-zona pellucida interactions, and sperm-egg fusion”. 《Biology of Reproduction》 68 (1): 1–9. doi:10.1095/biolreprod.102.007856. PMID 12493688. S2CID 10166894.
- ↑ Rudd P. M.; Elliott T.; Cresswell P.; Wilson I. A.; Dwek R. A. (2001). “Glycosylation and the immune system”. 《Science》 291 (5512): 2370–2376. Bibcode:2001Sci...291.2370R. doi:10.1126/science.291.5512.2370. PMID 11269318.
- ↑ 가 나 다 Varki A (1993). “Biological Roles of Oligosaccharides - All of the Theories Are Correct”. 《Glycobiology》 3 (2): 97–130. doi:10.1093/glycob/3.2.97. PMC 7108619. PMID 8490246.
- ↑ Bertozzi C. R.; Kiessling L. L. (2001). “Chemical glycobiology”. 《Science》 291 (5512): 2357–2364. Bibcode:2001Sci...291.2357B. doi:10.1126/science.1059820. PMID 11269316. S2CID 9585674.
- ↑ 가 나 Maverakis E, Kim K, Shimoda M, Gershwin M, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (2015). “Glycans in the immune system and The Altered Glycan Theory of Autoimmunity”. 《J Autoimmun》 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
- ↑ 가 나 Vliegenthart J. F. G.; Casset F. (1998). “Novel forms of protein glycosylation”. 《Current Opinion in Structural Biology》 8 (5): 565–571. doi:10.1016/s0959-440x(98)80145-0. hdl:1874/5477. PMID 9818259.
- ↑ Shibata S.; Takeda T.; Natori Y. (1988). “The Structure of Nephritogenoside - a Nephritogenic Glycopeptide with Alpha-N-Glycosidic Linkage”. 《Journal of Biological Chemistry》 263 (25): 12483–12485. PMID 3410849.
- ↑ Wieland F.; Heitzer R.; Schaefer W. (1983). “Asparaginylglucose - Novel Type of Carbohydrate Linkage”. 《Proceedings of the National Academy of Sciences of the United States of America》 80 (18): 5470–5474. Bibcode:1983PNAS...80.5470W. doi:10.1073/pnas.80.18.5470. PMC 384279. PMID 16593364.
- ↑ Debeer T.; Vliegenthart J. F. G.; Loffler A.; Hofsteenge J. (1995). “The Hexopyranosyl Residue That Is C-Glycosidically Linked to the Side-Chain of Tryptophan-7 in Human Rnase U-S Is Alpha-Marmopyranose”. 《Biochemistry》 34 (37): 11785–11789. doi:10.1021/bi00037a016. PMID 7547911.
- ↑ Ihara, Yoshito; Inai, Yoko; Ikezaki, Midori; Matsui, In-Sook L.; Manabe, Shino; Ito, Yukishige (2014). “C-Mannosylation: A Modification on Tryptophan in Cellular Proteins”. 《Glycoscience: Biology and Medicine》: 1–8. doi:10.1007/978-4-431-54836-2_67-1. ISBN 978-4-431-54836-2.
- ↑ Jansson A. M.; Meldal M.; Bock K. (1990). “The Active Ester N-Fmoc-3-O-[Ac4-Alpha-D-Manp-(1-]2)-Ac3-Alpha-D-Manp-1-]-Threonine-O-Pfp as a Building Block in Solid-Phase Synthesis of an O-Linked Dimannosyl Glycopeptide”. 《Tetrahedron Letters》 31 (48): 6991–6994. doi:10.1016/s0040-4039(00)97224-1.
- ↑ Elofsson M.; Walse B.; Kihlberg J. (1991). “Building-Blocks for Glycopeptide Synthesis – Glycosylation of 3-Mercaptopropionic Acid and Fmoc Amino-Acids with Unprotected Carboxyl Groups”. 《Tetrahedron Letters》 32 (51): 7613–7616. doi:10.1016/0040-4039(91)80548-k.
- ↑ Li H. G.; Li B.; Song H. J.; Breydo L.; Baskakov I. V.; Wang L. X. (2005). “Chemoenzymatic synthesis of HIV-1V3 glycopeptides carrying two N-glycans and effects of glycosylation on the peptide domain”. 《Journal of Organic Chemistry》 70 (24): 9990–9996. doi:10.1021/jo051729z. PMID 16292832.
- ↑ Yamamoto N.; Takayanagi Y.; Yoshino A.; Sakakibara T.; Kajihara Y. (2007). “An approach for a synthesis of asparagine-linked sialylglycopeptides having intact and homogeneous complex-type undecadisialyloligosaccharides”. 《Chemistry: A European Journal》 13 (2): 613–625. doi:10.1002/chem.200600179. PMID 16977655.
- ↑ Shao N.; Xue J.; Guo Z. W. (2003). “Chemical synthesis of CD52 glycopeptides containing the acid-labile fucosyl linkage”. 《Journal of Organic Chemistry》 68 (23): 9003–9011. doi:10.1021/jo034773s. PMID 14604374.
- ↑ Gamblin D. P.; Scanlan E. M.; Davis B. G. (2009). “Glycoprotein Synthesis: An Update”. 《Chemical Reviews》 109 (1): 131–163. doi:10.1021/cr078291i. PMID 19093879.
- ↑ Mehta, AY; Veeraiah, RKH; Dutta, S; Goth, CK; Hanes, MS; Gao, C; Stavenhagen, K; Kardish, R; Matsumoto, Y; Heimburg-Molinaro, J; Boyce, M; Pohl, NLB; Cummings, RD (2020년 6월 29일). “Parallel Glyco-SPOT Synthesis of Glycopeptide Libraries.”. 《Cell Chemical Biology》 27 (9): 1207–1219.e9. doi:10.1016/j.chembiol.2020.06.007. PMID 32610041.
- ↑ Hilpert, K; Winkler, DF; Hancock, RE (2007). “Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion.”. 《Nature Protocols》 2 (6): 1333–49. doi:10.1038/nprot.2007.160. PMID 17545971. S2CID 32143600.
- ↑ 가 나 Nilsson B. L.; Soellner M. B.; Raines R. T. (2005). “Chemical synthesis of proteins”. 《Annual Review of Biophysics and Biomolecular Structure》 34: 91–118. doi:10.1146/annurev.biophys.34.040204.144700. PMC 2845543. PMID 15869385.
- ↑ Wan Q.; Danishefsky S. J. (2007). “Free Radical Based, Specific Desulfurization of Cysteine: A Powerful Advance in the Synthesis of Polypeptides and Glycopolypeptides”. 《Angew. Chem.》 119 (48): 9408–9412. doi:10.1002/ange.200704195. PMID 18046687.
더 읽을거리[편집]
- Emanual Maverakis; 외. “Glycans in the immune system and The Altered Glycan Theory of Autoimmunity” (PDF).
외부 링크[편집]
 위키미디어 공용에 당펩타이드 관련 미디어 분류가 있습니다.
위키미디어 공용에 당펩타이드 관련 미디어 분류가 있습니다.
