기체 반응의 법칙
기체 반응의 법칙(Law of Gaseous Reaction) 또는 게이뤼삭의 법칙(Gay-Lussac's law)은 기체 사이의 화학 반응에서, 같은 온도와 같은 압력에서 그 부피를 측정했을 때 반응하는 기체와 생성되는 기체 사이에는 간단한 정수비가 성립한다는 법칙이다. 1805년 조제프 루이 게이뤼삭이 발견하였으며, 게이뤼삭의 법칙이라고도 한다.
원자론의 모순[편집]
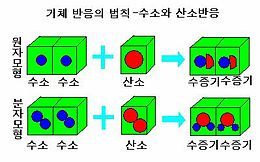
19세기 때에는 분자의 존재가 아직 알려지지 않았기 때문에 기체 반응의 법칙을 원자 모형으로 설명할 수가 없었다. 예를 들어, 수소와 산소가 반응하면 수증기가 만들어지는데, 이때의 정수비는 2 : 1 : 2이다. 이것을 만족시키기 위해 원자 모형으로 설명하면 반응식이 2H + O → 2HO½가 되어서 산소 원자가 쪼개지기 때문에 돌턴의 원자설에 위배되어 설명을 할 수가 없다.
분자의 존재[편집]
1811년 아보가드로가 분자설을 주장함으로써 기체 반응의 법칙이 성립하게 되는데, 분자 모형으로 설명하면 수소와 산소가 반응하여 수증기가 되는 반응은 다음과 같이 된다. 이때도 역시 정수비는 2 : 1 : 2가 된다. 그러면 반응식은 2H2 + O2 → 2(H2O)로 되어서 원자 모형으로 설명을 할 수 없었던 기체 반응의 법칙이 분자 모형으로 성립하게 된다.
여러 가지 기체 반응[편집]
분자로 설명할 때
원자로 설명할 때(1/2는 쪼갰다는 뜻)
- 염화수소의 반응 : Cl + H → 2H1/2Cl1/2
- 수증기의 반응 : 2H + O → 2H2/2O1/2
- 암모니아의 반응 : 3H + N → 2N1/2H3/2
