효소
효소(酵素, 영어: enzyme)는 생명체 내부의 화학 반응을 매개하는 단백질 촉매이다. 효소는 기질과 결합하여 효소-기질 복합체를 형성함으로써 반응의 활성화 에너지를 낮추는 촉매 역할을 한다. 각 종류의 효소의 이름은 대개 '-ㅏ제(-ase)'로 끝난다.
효소는 기질에 대한 특이성을 가지고 있으며, 일반적으로 상온에서 체온 정도의 온도와 중성 pH에서 잘 작동한다. 하지만 특이한 생명체의 효소들은 극한 조건(예: 섭씨 72도, pH 2의 강한 산성 상태 등)에서도 작동할 수 있다.
효소는 촉매하는 반응의 종류와 반응하는 기질의 종류에 따라 효소 번호(EC number)로 분류된다.
용어의 유래

1700년대 후기와 1800년대 초기에, 위에서 이루어지는 고기의 소화[1]와 식물의 추출물과 침이 녹말을 당으로 바꾸는 현상이 알려졌다. 그러나 이 작용의 기작은 밝혀지지 않았었다.[2]
19세기에 당이 효모에 의해 알코올로 바뀌는 발효에 대해 연구하던 중, 루이스 파스터는 효모에 의해 당이 발효되어 알코올을 만드는 반응이 “발효소”에 의하여 촉매된다고 결론을 내렸다.[3]
최초로 이 용어를 사용한 사람은 독일 생리학자인 빌헬름 퀴네이다. "enzyme"은 그리스어: ενζυμον 즉 "in leaven"이라는 뜻이며, leaven은 효모(yeast)를 의미한다. 한자어 번역인 효소(酵素)는 효모(酵母, yeast)에 있는 요소(要素)라는 뜻이다.
1897년에 에드워드 채너는 효모의 추출물이 당을 알코올로 발효하는 능력을 가지고 있다는 것을 발견함으로써 발효는 세포로부터 분리되어도 여전히 촉매작용을 할 수 있는 분자에 의하여 촉진된다는 것을 제시하였다.[4]
1926년에 제임스 섬너가 유레에이스(urease)를 결정형으로 순수하게 분리하는 데 성공하였다. 1930년대에 들어 존 놀쓰롭과 웬델 스탠리가 소화 효소인 펩신과 트립신, 키모트립신을 연구하던 중 순수한 단백질이 효소가 될 수 있음을 증명하였다. 이 세 학자는 1946년에 화학분야에서 노벨상을 수상하였다.[5]
효소의 성질
일반적으로 화학반응이 일어나는 조건과 생명체의 조건은 많이 다르다. 따라서 생명체 내부에서는 생명현상에 필요한 많은 화학반응들을 적절하게 진행시킬 수 있는 방법이 필요하다. 효소는 다음과 같은 성질을 가짐으로써 이러한 반응들을 조절하게 된다.
3차원 구조

- 효소는 일반적으로 62개에서 2500개가 넘는 아미노산 잔기로 이루어진 글로블린 단백질이다.[6][7] 효소는 이러한 아미노산 잔기들을 정확한 공간적 위치에 가지고 있다.
- 효소는 그들이 작용할 기질보다 크며, 효소의 작은 부분(대략 3~4 아미노산)만이 촉매작용에 관여한다.[8] 이렇게 기질이 와서 붙는 자리를 활성 자리라고 한다. 또한 효소는 조효소가 붙는 자리를 포함하고 있다. 어떤 효소들은 반응물이나 생성물에 직접적, 간접적으로 붙는 작은 분자들을 위한 결합 자리 역시 가지고 있다. 이러한 결합은 효소의 활성을 촉진하거나 저해할 수 있다. 즉, 구조적인 변형이 효소의 반응능력을 조절할 수 있다.
- 다른 단백질들과 마찬가지로 효소는 긴 선형의 아미노산 사슬들이 접혀서 3차원 구조를 형성하는 형태이다. 각 특정한 아미노산 서열은 특별한 구조를 만들고 특정한 성질을 갖게 된다. 각각의 단백질 사슬들은 집단을 이루어 단백질 복합체를 형성할 수 있다. 효소의 활성은 이러한 3차원 구조에 의해서 결정된다.
- 대부분의 효소들은 온도와 화학적 요인에 의해서 3차원 구조가 변형되는 변성을 일으킬 수 있다. 이러한 변성은 때때로 가역적으로, 효소는 제 기능을 찾을 수 도 있다.
조효소
- 효소에 따라서는 반응에 필요한 보조 분자들이 있어야만 하는 경우가 있다.[9] 이러한 보조 분자에는 금속이온과 같은 무기화합물과 유기화합물이 포함된다. 이러한 분자들의 양을 조절함으로써, 화학 반응을 조절할 수 있다.[10]
- (일반적으로 비타민들이 사람의 물질대사 과정에서 조효소로 작동한다.)
- 조효소들은 연속적으로 일어나야 하는 반응을 중간에서 연결시켜줌으로써, 복잡한 반응을 순서대로 일으킬 수 있다.
효소 연속 반응
- 연속적인 효소 반응을 통해 반응의 크기를 차차 증폭시켜서, 작은 신호가 최종적으로는 큰 반응을 일으킬 수 있도록 한다.
- 연속적인 반응 중간중간에 조절인자를 둠으로써 반응의 크기 및 반응여부를 조절 가능하다.
효소의 기질 특이성
효소가 특정한 기질하고만 결합하여 반응을 촉매하는 성질을 말한다. 효소들은 각기 다른 형태의 활성 자리(active site)를 가지고 있다. 그러므로 효소는 자신의 활성 자리에 알맞게 결합하는 특정한 기질하고만 상호 작용할 수 있다. 따라서 효소의 활성 자리의 입체 구조가 기질의 입체 구조와 맞물릴 수 있는 형태일 때에만 결합이 이루어지는 것이다.
보통 이러한 현상을 설명하기 위하여 열쇠-자물쇠 모형을 예로 드는데, 이것은 에밀 피셔에 의해 1894년에 제안된 것이다.[11] 이런 모형을 예로 드는 이유는 효소의 기질 특이성은 자물쇠의 구멍에 맞는 모양을 가진 열쇠만 자물쇠를 열 수 있는 원리와 유사하기 때문이다. 이 예에서 자물쇠는 기질에 해당하며 열쇠는 효소에 해당한다.
효소의 활성화 에너지
엔트로피와 깁스자유에너지
엔트로피란 화학 반응계에서 구성 성분들의 무작위성 또는 무질서도를 나타내는 것이다. 화학 반응계에서는 이런 엔트로피의 변화를 ΔS로 표시한다. 무작위성이 증가될 때는 ΔS가 양의 값이 되고 무작위성이 감소할 때는 ΔS가 음의 값이 된다.[12]
일에 실제로 이용할 수 있는 에너지를 자유에너지 변화라고 한다. 깁스는 화학 반응에서 이러한 에너지 변화와 관련된 이론을 제시했다. 닫힌 반응계에서 화학 반응은 평형이 될 때까지 자발적으로 진행한다. 이런 상황에서 일정한 온도, 압력에서 반응계가 초기상태에서 평형상태로 변화됨에 따른 에너지 변화가 자유에너지 변화가 된다.[12]
그것을 식으로 나타낸 것이 G=H-TS이다. G는 자유에너지를 나타내는 것이며, 이 자유에너지의 양은 엔탈피(H), 엔트로피(S), 절대온도(T)를 통해 결정된다. 즉, 어떤 화학 반응이 일정한 온도에서 일어날 때, 자유에너지의 변화는 ΔH(붕괴되거나 형성되는 화학결합과 비공유결합성 상호작용의 종류와 수에 의해 결정됨)와 무작위성의 변화인 ΔS에 의하여 결정되는 것이다. : ΔG = ΔH - TΔS[12]
ΔG의 크기는 특별한 화학반응이나 반응계가 초기의 평형으로부터 얼마나 멀어져 있는가에 의존한다. 화학반응에 관계되는 각각의 화합물은 결합의 종류와 수에 관계되는 일정량의 위치 에너지를 가지고 있다. 자유에너지 감소반응은 자발적으로 일어나는 반응으로, 생성물은 기질보다 더 적은 자유에너지를 가지므로 반응이 일어남에 따라 자유에너지를 방출하고 일을 할 수 있다. 이 때 방출된 에너지의 일부만이 일을 수행하는데 사용된다. 이와 다르게 자유에너지증가 반응은 에너지를 흡수하는 반응이다.[12]
생물학적으로 보았을 때 세포의 중요기능을 수행하는 단백질과 같은 거대분자들의 형성에 필요한 자유에너지는양(+)의 값이다. 열역학적으로 불리한 반응, 바꾸어 말하면 에너지 요구반응(자유에너지 증가반응)을 수행하기 위하여 세포는 이 반응을 자유에너지를 방출하는 다른 반응(자유에너지 감소반응)과 짝지어 일어나게 함으로써, 전체 과정이 자유에너지 감소반응으로 되고 그 결과 자유에너지 변화의 총합은 음(-)이 된다. 이렇게 자유에너지감소 반응과 자유에너지증가 반응이 짝지어지는 것이 살아 있는 반응계에서 에너지 교환에 절대적으로 중요하다.[12]
반응속도
반응속도에 대한 정확한 열역학적 정의
특정한 화학 반응의 속도는 기질의 농도와 속도상수(일반적으로 k로 표시함)에 의하여 결정된다. 기질(S)로부터 생성물(P)로의 단일분자의 반응에서, 반응속도(V)는 단위 시간 당 반응하는 기질의 양을 의미하고 다음의 식으로 표시된다. : V=k[S] [13]
이 반응에서 속도는 단지 기질의 농도에 의해서만 변하는 것을 알 수 있다. 이와 같은 반응을 1차 반응이라 한다. 속도상수 k는 주어진 조건(PH, 온도 등)에서 반응의 확률을 나타내는 비례 상수이다. 여기에서 k는 1차 속도 상수가 되고 그 단위는 시간의 역수(s_{-1})가 된다.[13]
2차 반응이란 반응 속도가 서로 다른 2가지의 화합물의 농도에 의해 결정되거나, 같은 화합물이라도 2개의 분자가 반응에 참여할 때를 의미한다. 이 때 k는 2차 속도 상수가 된다. 이 반응 속도식은 다음과 같이 나타낼 수 있다. : V=k[S1][S2][13]
여기에 전이상태이론을 적용하면 속도상수와 활성화 에너지를 관련시키는 식이 유도된다.
k = kT/h (k는 볼츠만 상수, h는 플랑크 상수)[13]
이 식에서 중요한 것은 속도상수 k와 활성화 에너지 ΔG는 지수 함수적인 반비례의 관계에 있다는 것이다. 식에 따라 활성화 에너지가 낮으면 반응속도는 커지고, 활성화 에너지가 높으면 반응 속도는 작아지는 것을 알 수 있다.[13]
효소의 활성화 에너지의 변화와 반응 속도의 관계
화학 반응에서 반응의 시작점을 바닥상태라고 부르는데, 이것은 주어진 조건에서 계에 의하여 주어지는 자유에너지이다. 기질의 바닥상태에서 자유에너지와 생성물의 바닥상태에서 자유에너지의 차이가 둘 사이의 평형을 결정한다.
기질과 생성물의 사이에는 에너지 장벽이 존재한다. 반응이 진행되기 위해서는 분자를 이 에너지 장벽보다 높은 에너지 상태까지 높여주어야 한다. 그림에서 제일 높은 지점에 분자가 위치한 것을 전이상태라고 한다. 전이상태는 결합의 파괴와 형성 그리고 전하의 변화라고 하는 것이, 기질에도 생성물에도 균등하게 진행될 수 있는 어떤 시점에 도달한 순간을 가리킨다.
바닥상태와 전이 상태의 에너지의 차를 활성화 에너지(ΔG)라고 부른다. 반응 속도는 이 활성화 에너지에 의하여 좌우된다.
온도를 높여 주게 되면 반응속도는 증가하는데, 이러한 상태는 에너지의 장벽을 넘어가는데 충분한 에너지를 가지고 있는 분자의 수가 많아지기 때문이다. 또한 활성화 에너지는 촉매를 가해 줌으로써 낮출 수 있다. 촉매는 반응의 활성화 에너지를 낮추어 줌으로써 반응 속도를 증가시킨다. 효소는 촉매의 일종인 생체촉매로서 반응속도를 증가시킨다.[14]
활성화 에너지는 세포가 계속해서 살아가는데 있어서 대단히 중요하다. 분자는 활성화 에너지가 높을수록 안정하며, 만일 이러한 에너지의 장벽이 없으면 복잡한 구조를 가지고 있는 생체의 거대분자는 좀 더 단순한 분자의 형태로 자발적으로 변화되어 버릴 것이다. 또한 세포가 가지고 있는 복잡하면서도 고도의 질서를 유지하고 있는 구조나 대사 경로는 존재 할 수 없게 된다. 효소는 세포가 살아가는데 필요한 반응에 대하여 선택적으로 활성화 에너지를 저하시키도록 진화되어 온 것이다.
결합에너지
결합에너지와 그 작용기작
효소가 특이적 반응에서 오는 활성화 에너지를 극도로 낮출 수 있는 이유는 결합에너지에 있다. 활성화 에너지를 낮추는데 필요한 대부분의 에너지는 일반적으로 기질과 효소 사이의 약한 결합인 비공유결합으로부터 얻어진다.
효소는 특이적인 ES복합체를 형성한다는 점에서 많은 다른 촉매들과 구별된다. 이 ES복합체에서 기질과 효소의 결합 양식은 단백질 분자의 구조를 안정화시키는 요인인 수소결합, 소수성 결합, 이온 결합 등에 의존한다. 이들 결합들은 ES복합체 내부에 약한 결합을 형성함으로써 이 상호작용을 안정화시킬 정도의 적은 자유에너지가 방출된다. 이와 같은 효소-기질 상호작용에 의하여 얻어진 에너지를 결합에너지라고 부른다. 이 결합 에너지의 의미는 단지 효소-기질간의 상호작용의 안정화에만 국한되지 않는다. 결합에너지는 효소가 반응의 활성화 에너지를 저하시키는 데 사용되는 자유에너지의 중요한 공급원이 되고 있다.[15]

효소가 반응을 촉매하기 위해서는 반응 전이 상태에서 기질과 상보적이 되어야만 한다. 다시 말하면 기질과 효소 간의 최적의 관계(약한 상호작용)는 전이 상태에서만 생길 수 있다는 것이다. 일부의 약한 상호작용이 ES복합체에서 형성되며 기질과 효소간의 약한 상호작용에 의한 완전히 상보적인 결합은 반응이 전이 상태가 되어서야 비로소 형성되는 것이다.
이 결합을 형성할 때에 방출되는 결합에너지의 일부가 에너지 장벽을 뛰어넘는 데에 필요한 에너지의 일부로서 사용된다. 반응이 일어나기 어려운 활성화 에너지와 반응이 일어나기 쉬운 결합에너지의 차이가 더 낮은 알짜 활성화 에너지가 된다. 전이상태는 기질이 에너지 언덕의 꼭대기에 있는 대단히 짧은 시간인데, 효소가 촉매하는 반응의 경우에 에너지 장벽의 높이가 아주 낮기 때문에 효소 반응은 비효소 반응보다 훨씬 빠른 것이다.[15]
여기서 가장 중요한 효소 반응의 원리는 효소와 기질 간의 약한 결합이 효소 촉매 반응의 주요한 에너지원이 된다는 것이다. 이와 같은 반응에서 효소와 약한 상호작용에 관여하고 있는 기질의 부분은 절단 부위나 변화를 받는 부위로부터 다른 곳에 있다. 따라서 전이상태에서 처음으로 형성되는 약한 상호작용이 촉매 반응의 진행에 가장 중요한 역할을 하게 된다.[15]
결합에너지의 효소 반응 기전에 대한 역할 정리
- 결합에너지는 촉매 반응에 필요한 에너지를 공급할 뿐 아니라 반응의 특이성을 확보하는 데에도 관계한다. 반응 특이성이란 효소와 반응하고자 경쟁하는 2가지의 유사한 기질을 식별할 수 있는 효소의 능력을 말한다. 즉, 이러한 특이성은 효소와 그 기질 분자 간에 많은 부분 혹은 기질이 되는 거의 모든 부분의 구조적인 면에서 다수의 약한 결합이 형성되어 만들어지는 것이다.
- 기질이 효소에 결합함으로써 엔트로피가 감소한다. 결합에너지는 기질이 반응하는데 필요한 적절한 배치를 유지해준다.
- 기질-효소 사이에 약한 결합이 형성됨으로써 기질은 탈용매화를 가져온다.
- 전이상태에서 형성되는 약한 상호작용에 의한 결합에너지는 전자의 재배치에 의한 뒤틀림을 사용하여 기질이 반응하는 것을 열역학적으로 보상한다.
- 기질과의 효소 사이에 부분적으로 여러 개의 약한 상호작용이 새로이 형성되면서 효소의 입체형태의 변화가 유도된다.[16]
효소 반응 속도론
반응 속도에 영향을 주는 요소
효소의 촉매 반응 속도에 가장 큰 영향을 미치는 것은 기질의 농도이다. 기질의 농도가 효소 농도보다 클 때 초기속도를 측정하여 기질 농도가 반응속도에 미치는 영향을 살펴볼 수 있다.[17] 기질의 농도가 비교적 낮을 때에는 초기속도가 기질 농도가 증가됨에 따라 비례하는 형태를 보인다. 기질 농도를 높여 나갈수록, 초기속도 그래프의 기울기가 점차 감소한다. 결국 기질을 무한히 넣어주어도 그 속도가 증가하지 않는 지점이 나오는데 이를 최대 속도라 한다.
미하엘리스 - 멘텐 식
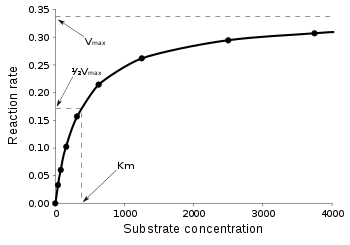
미하엘리스-멘텐 식은 정류 상태 근사법을 이용하여 효소 반응의 속도를 구하는 방법이다.
효소의 분류
수많은 효소를 명명하고 분류하기 위하여, 국제적인 합의를 통해 효소의 분류 기준을 책정했다. 먼저 모든 효소를 촉매 하는 반응의 형태에 따라 주로 6가지 범위로 나누고, 각각을 다시 여러 개의 하위범위로 나누도록 한다.
- EC 1 : 산화 환원 효소류: 산화 환원 반응을 촉매한다.
- EC 2 : 전달 효소류: 작용기를 옮긴다. (예: 메틸기, 인산기)
- EC 3 : 가수 분해 효소류: 가수 분해를 촉매한다.
- EC 4 : 분해 효소류: 가수 분해와 산화 이외의 다양한 자름을 촉매한다.
- EC 5 : 이성질화 효소류: 이성질화를 촉매한다.
- EC 6 : 연결 효소류: 공유 결합으로 두 분자를 묶는다.
각각의 효소에는 6개의 숫자로 된 분류번호와 그것이 촉매하는 반응을 나타내는 계통명이 부여된다.[18]
효소 저해제
효소반응률은 다양한 효소 저해제에 의해 조절 될 수 있다. 저해제의 종류로는 경쟁적 저해제, 비경쟁적 저해제, 불경쟁적 저해제(무경쟁적 저해제), 혼합 저해제가 있다.
주석
- ↑ de Réaumur, RAF (1752). “Observations sur la digestion des oiseaux”. 《Histoire de l'academie royale des sciences》 1752: 266, 461.
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Accessed 4 April 2007
- ↑ Dubos J. (1951). “Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind”. 《Trends Biotechnol》 13 (12): 511–5. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ↑ Nobel Laureate Biography of Eduard Buchner at http://nobelprize.org. Retrieved 4 April 2007.
- ↑ 1946 Nobel prize for Chemistry laureates at http://nobelprize.org. Retrieved 4 April 2007.
- ↑ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP (1992). “4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer”. 《J. Biol. Chem.》 267 (25): 17716–21. PMID 1339435.
- ↑ Smith S (1994년 12월 1일). “The animal fatty acid synthase: one gene, one polypeptide, seven enzymes”. 《FASEB J.》 8 (15): 1248–59. PMID 8001737.
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute. Retrieved 4 April 2007.
- ↑ de Bolster, M.W.G. (1997). “Glossary of Terms Used in Bioinorganic Chemistry: Cofactor”. International Union of Pure and Applied Chemistry. 2007년 10월 30일에 확인함.
- ↑ de Bolster, M.W.G. (1997). “Glossary of Terms Used in Bioinorganic Chemistry: Coenzyme”. International Union of Pure and Applied Chemistry. 2007년 10월 30일에 확인함.
- ↑ Fischer E. (1894). “Einfluss der Configuration auf die Wirkung der Enzyme”. 《Ber. Dt. Chem. Ges.》 27: 2985–93. doi:10.1002/cber.18940270364.
|journal=에 라인 피드 문자가 있음(위치 9) (도움말) - ↑ 가 나 다 라 마 David L. Nelson, Michael M. Cox. , 《Lehninger principles of biochemistry 4th》, New York : W. H. Freeman, 2005, 23~24
- ↑ 가 나 다 라 마 David L. Nelson, Michael M. Cox. , 《Lehninger principles of biochemistry 4th》, New York : W. H. Freeman, 2005, 195~196
- ↑ 상게서, 194~195
- ↑ 가 나 다 David L. Nelson, Michael M. Cox. , 《Lehninger principles of biochemistry 4th》, New York : W. H. Freeman, 2005, 196~199
- ↑ 상게서, 199
- ↑ Ellis RJ, "Macromolecular crowding: obvious but underappreciated", Trends Biochem, 2001, Sci. 26 (10): 597–604.
- ↑ David L. Nelson, Michael M. Cox. , 전게서, 192
틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link FA 틀:Link GA 틀:Link GA 틀:Link FA 틀:Link GA

