철 결합 단백질

철 결합 단백질(鐵結合蛋白質, 영어: iron-binding protein)은 철 대사[1]와 면역 반응에 중요한 운반체 단백질 및 금속단백질이다.[2][3] 철은 생명에 필요하다.
철 의존성 효소는 다양한 생화학적 반응을 촉매하며 활성 부위의 구조에 따라 비헴 일철, 비헴 이철, 헴 중심의 3가지 광범위한 부류로 나눌 수 있다.[4] 철 의존성 효소의 잘 알려진 패밀리에는 산소(O2)로부터 하나 또는 두 원자에 하이드록실기의 첨가를 촉진하는 산소화효소가 포함된다. 주목할만한 효소에는 트립토판 이산소화효소, 페레독신, 2-옥소글루타르산 이산소화효소가 포함된다.[5]
헴단백질[편집]

헴단백질은 보결분자단으로 헴을 가지고 있는 단백질이다. 헴기는 철 이온과 배위 결합된 포르피린 고리로 구성된다. 포르피린 고리에 있는 4개의 질소 원자는 중앙에 있는 철의 리간드 역할을 한다. 많은 경우에 적도 포르피린은 1개 또는 2개의 축 리간드에 의해 보완된다. 이에 대한 예는 헤모글로빈에 있는데 여기서 포르피린은 히스티딘 곁사슬 및 결합된 산소 분자(O2)와 함께 작용하여 팔면체 복합체를 형성한다.
헤모글로빈[편집]
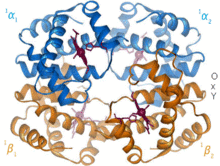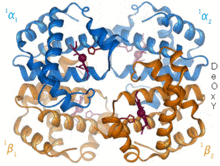
헤모글로빈은 거의 모든 척추동물에서 발견되는 산소 운반 단백질이다. 헤모글로빈 A는 성인에게서 발견되는 주요 유형이다. 헤모글로빈은 2개의 α 소단위체와 2개의 β 소단위체로 구성된 사량체이다. 4개의 단량체 단위 각각은 포르피린 고리의 4개의 질소 원자 사이에 철 양이온이 결합된 헴 보결분자단을 가지고 있다. 히스티딘과 함께 아포 형태에는 철 원자를 둘러싸는 5개의 리간드가 있다. 산소는 빈 여섯 번째 위치에 결합하여 홀로 형태의 팔면체 복합체를 형성한다.[6] 산소 결합은 각 소단위체에 대해 완전히 협력적이다. 이는 첫 번째 산소가 4개의 헴기 중 하나에 결합하면 단백질은 다른 3개의 소단위체의 산소 친화력을 급격히 증가시키는 극적인 입체구조적 변화를 겪기 때문이다.[7]
헤모글로빈은 pH, 구조, CO2 분압에 따라 다양한 친화력을 갖는다. 태아 헤모글로빈은 2개의 β 소단위체 대신 2개의 γ 소단위체를 가지는 변종이다. 태아 헤모글로빈은 아기가 몇 달이 될 때까지 지배적인 형태이며, 임신 중에 공급되는 산모 혈액의 낮은 산소압을 보상하기 위해 더 큰 산소 친화력을 가지고 있다.[8] 헤모글로빈은 낮은 pH에서 산소 친화력이 더 낮다. 이는 산소와 결합한 헤모글로빈이 몸 전체의 세포로 운반됨에 따라 신속한 해리를 가능하게 한다. 호흡 세포에서 CO2 생성과 탄산의 물에 녹은 형태로 인해 산소화 헤모글로빈은 세포에 필요한 산소를 전달하기 위해 해리된다.[9] 헤모글로빈에 대한 결합 친화력은 산소보다 일산화 탄소가 250배 더 크다. 이로 인해 일산화 탄소 중독시 헤모글로빈은 더 이상 조직 세포에 산소를 운반할 수 없게 된다.
사이토크롬[편집]
사이토크롬은 단일 전자 수송체, 특히 산화적 인산화 및 광합성에서 전자 셔틀 역할을 하는 헴 함유 효소이다. 잘 연구된 사이토크롬의 유형으로는 사이토크롬 a~c, 사이토크롬 산화효소, 사이토크롬 P450이 있다.[10] 이들 단백질은 제일철(Fe2+)과 제이철(Fe3+) 사이에서 헴 철 원자의 산화 상태를 전환함으로써 전자 셔틀 역할을 한다. 다양한 사이토크롬은 다른 산화환원 활성 분자와 결합하여 전자 전달 과정에서 에너지 결합 효율을 높이는 표준 환원 전위의 기울기를 형성한다.
철-황 단백질[편집]
철-황 단백질은 황을 포함하는 철 구조를 가지고 있는 단백질이다. 철과 황이 단백질을 취할 수 있는 형태는 다양하지만 가장 일반적인 형태는 [2Fe-2S]와 [4Fe-4S]이다. 클러스터는 종종 단백질 사슬의 시스테인 잔기와 연관된다.[11]
비헴 철 단백질[편집]
트랜스페린[편집]
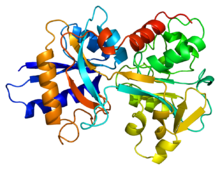
트랜스페린은 사람의 혈장에서 발견되며 비헴 철을 운반하고 유입하는 데 사용된다.[12] 트랜스페린은 세포 외 공간에서 자유롭게 이동한다.[13] 세포가 철분을 필요로 할 때 트랜스페린 수용체에 의해 세포질로 운반된다. 트랜스페린은 음이온(보통 탄산염)과 함께 두 개의 Fe(III)과 결합할 수 있다. 철을 방출하기 위해 탄산염 음이온이 양성자화된다. 이는 탄산염과 단백질의 상호작용을 변화시켜 입체구조를 변화시키고 Fe(III)가 전달되도록 한다.
트랜스페린의 분자량은 약 80 kDa이다. 트랜스페린은 당단백질이며, 이는 아미노산 사슬에 당이 부착되어 있음을 의미한다.
락토페린[편집]
락토페린은 트랜스페린 패밀리의 구성원이며, 눈물, 젖, 침과 같은 포유류의 외분비물에서 발견되는 주요 단백질이다. 이는 약 700개의 잔기로 구성되며 주로 사량체로 존재하며, 단량체:사량체 비율은 10 μM 단백질 농도에서 1:4이다.[14] 3차 구조는 N 로브 및 C 로브라고 불리는 두 개의 로브로 구성되며, 각 로브에는 철 결합 포켓이 하나씩 있다. 각 포켓에는 4개의 아미노산(2개의 티로신, 1개의 히스티딘, 1개의 아스파르트산)이 포함되어 있으며, 2개의 탄산염 또는 중탄산염 음이온과 함께 철 양이온 주위에 6개의 배위를 형성한다. 락토페린의 철에 대한 친화력을 트랜스페린보다 300배 더 크게 만드는 것은 바로 이 특별한 조합이다.[15]

락토페린은 상당한 항균 특성을 가지고 있다. 사람의 초유(임신 말기에 생성되는 젖의 종류)에서 150 ng/mL의 최고 농도로 발견되며 새로 태어나는 아기에게 필요한 면역 지원을 제공한다.[16] 락토페린은 높은 철 친화력과 병원성 미생물로부터 유리 철 원자를 격리하는 능력 때문에 단지 정균제일 뿐이라고 널리 알려져 있다. 그러나 현재 중 주요 항균 추진력은 철 결합 주머니와 N 로브에 위치한 특정 펩타이드인 락토페리신의 살균 특성에 있다는 것이 알려져 있다. 락토페린은 세균의 지질다당류(LPS) 층에 결합할 수 있으며 홀로 형태의 철 원자는 지질다당류를 산화시켜 외막을 용해시키는 동시에 독성을 지닌 과산화 수소를 생성한다.[17] 또한 트립신에 의해 락토페린이 절단되면 H+-ATPase에 결합하는 펩타이드인 락토페리신이 생성되어 양성자의 자리옮김을 방해하고 궁극적으로 세포를 죽인다.[18]
페리틴[편집]

페리틴은 개별 세포의 철 저장소이다. 이는 모든 세포 유형에서 발견되며 세포질에 국한된다. 페리틴은 철 원자로 가득 찬 코어를 둘러싸고 있는 24개의 소단위체로 구성된 거대 단백질이다. 페리틴은 0~4500개의 철 원자를 담을 수 있으며,[19] 이는 세포의 요구에 대한 철의 저장소로 사용될 수 있다. 철분은 과잉 상태가 되면 저장되었다가 다시 필요할 때 회수된다.[12] 소단위체는 H(무거운(heavy) 또는 심장(heart))과 L(가벼운(light) 또는 간(liver))의 혼합물이다. 소단위체는 70~80 Å 너비의 클러스터를 형성하며 철 페리하이드라이트로 채워져 있다.[20]
페리틴은 생물의 모든 역에서 고도로 보존된 단백질이다. 말과 사람의 소단위체가 함께 모여 기능성 단백질을 만들 수 있을 정도로 보존되어 있다.[12] 각 소단위체는 5개의 α 나선으로 구성된다.
페리틴은 사람의 낮은 철분 수치를 진단하는 데 사용된다.[19] 이는 빈혈 진단에 도움이 되는 생체 이용 가능한 철분의 수준을 나타내는 데 사용될 수 있다. 남성의 경우 일반적인 범위는 18~270 ng/mL이고 여성의 경우 18~160 ng/mL이다.[21]
같이 보기[편집]
각주[편집]
- ↑ Brock JH (1989). “Iron-binding proteins”. 《Acta Paediatrica Scandinavica. Supplement》 361: 31–43. doi:10.1111/apa.1989.78.s361.31. PMID 2485582. S2CID 44752615.
- ↑ De Sousa M, Breedvelt F, Dynesius-Trentham R, Trentham D, Lum J (1988). “Iron, iron-binding proteins and immune system cells”. 《Annals of the New York Academy of Sciences》 526 (1): 310–22. Bibcode:1988NYASA.526..310S. doi:10.1111/j.1749-6632.1988.tb55515.x. PMID 3291685. S2CID 12756539.
- ↑ Kaplan J, Ward DM (August 2013). “The essential nature of iron usage and regulation”. 《Current Biology》 23 (15): R642–6. doi:10.1016/j.cub.2013.05.033. PMC 3928970. PMID 23928078.
- ↑ Solomon EI, Brunold TC, Davis MI, Kemsley JN, Lee SK, Lehnert N, Neese F, Skulan AJ, Yang YS, Zhou J (January 2000). “Geometric and electronic structure/function correlations in non-heme iron enzymes”. 《Chemical Reviews》 100 (1): 235–350. doi:10.1021/cr9900275. PMID 11749238.
- ↑ Cheng AX, Han XJ, Wu YF, Lou HX (January 2014). “The function and catalysis of 2-oxoglutarate-dependent oxygenases involved in plant flavonoid biosynthesis”. 《International Journal of Molecular Sciences》 15 (1): 1080–95. doi:10.3390/ijms15011080. PMC 3907857. PMID 24434621.
- ↑ Menis, Oscar (1968). “Technical Note 454”. 《Analytical Coordination Chemistry Section: Summary of Activities July 1967 to June 1968》 (Gaithersburg, MD: Analytical Coordination Chemistry Section Analytical Chemistry Division Institute for Materials Research). doi:10.6028/nbs.tn.454.
- ↑ Mihailescu MR, Russu IM (March 2001). “A signature of the T ---> R transition in human hemoglobin”. 《Proceedings of the National Academy of Sciences of the United States of America》 98 (7): 3773–7. Bibcode:2001PNAS...98.3773M. doi:10.1073/pnas.071493598. PMC 31128. PMID 11259676.
- ↑ Berg, Jeremy M; Tymoczko, John L; Stryer, Lubert (2002). 《Biochemistry》 5판. New York: W.H. Freeman. ISBN 0716730510. OCLC 48055706.
- ↑ Hasselbalch KA (December 1964). “Calculation Of The Hydrogen Ion Concentration Of Blood From Free And Bound Carbon Dioxide Oxygen Binding As A Function Of Ph.”. 《Survey of Anesthesiology》 8 (6): 607–32. doi:10.1097/00132586-196412000-00059.
- ↑ L., Lehninger, Albert (2000). 《Lehninger principles of biochemistry.》. Nelson, David L. (David Lee), 1942-, Cox, Michael M. 3.판. New York: Worth Publishers. ISBN 1572591536. OCLC 42619569.
- ↑ Johnson, Deborah C.; Dean, Dennis R.; Smith, Archer D.; Johnson, Michael K. (2005년 2월 18일). “Structure, Function, and Formation of Biological Iron-Sulfur Clusters”. 《Annual Review of Biochemistry》 (영어) 74 (1): 247–281. doi:10.1146/annurev.biochem.74.082803.133518. ISSN 0066-4154. PMID 15952888.
- ↑ 가 나 다 Aisen P, Enns C, Wessling-Resnick M (October 2001). “Chemistry and biology of eukaryotic iron metabolism”. 《The International Journal of Biochemistry & Cell Biology》 33 (10): 940–59. doi:10.1016/s1357-2725(01)00063-2. PMID 11470229.
- ↑ “TF - Serotransferrin precursor - Homo sapiens (Human) - TF gene & protein”. 《www.uniprot.org》 (영어). 2018년 11월 11일에 확인함.
- ↑ Baker EN, Baker HM (November 2005). “Molecular structure, binding properties and dynamics of lactoferrin”. 《Cellular and Molecular Life Sciences》 62 (22): 2531–9. doi:10.1007/s00018-005-5368-9. PMID 16261257. S2CID 218464085.
- ↑ Mazurier J, Spik G (May 1980). “Comparative study of the iron-binding properties of human transferrins. I. Complete and sequential iron saturation and desaturation of the lactotransferrin”. 《Biochimica et Biophysica Acta》 629 (2): 399–408. doi:10.1016/0304-4165(80)90112-9. PMID 6770907.
- ↑ Sánchez L, Calvo M, Brock JH (May 1992). “Biological role of lactoferrin”. 《Archives of Disease in Childhood》 67 (5): 657–61. doi:10.1136/adc.67.5.657. PMC 1793702. PMID 1599309.
- ↑ Farnaud S, Evans RW (November 2003). “Lactoferrin--a multifunctional protein with antimicrobial properties”. 《Molecular Immunology》 40 (7): 395–405. doi:10.1016/S0161-5890(03)00152-4. PMID 14568385.
- ↑ Kuwata H, Yip TT, Yip CL, Tomita M, Hutchens TW (April 1998). “Bactericidal domain of lactoferrin: detection, quantitation, and characterization of lactoferricin in serum by SELDI affinity mass spectrometry”. 《Biochemical and Biophysical Research Communications》 245 (3): 764–73. doi:10.1006/bbrc.1998.8466. PMID 9588189.
- ↑ 가 나 Andrews NC (July 2008). “Forging a field: the golden age of iron biology”. 《Blood》 112 (2): 219–30. doi:10.1182/blood-2007-12-077388. PMC 2442739. PMID 18606887.
- ↑ Crichton RR, Charloteaux-Wauters M (May 1987). “Iron transport and storage”. 《European Journal of Biochemistry》 164 (3): 485–506. doi:10.1111/j.1432-1033.1987.tb11155.x. PMID 3032619.
- ↑ “What Is a Ferritin Blood Test? What Do the Results Mean?”. 《WebMD》. 2018년 11월 11일에 확인함.
외부 링크[편집]
- 의학주제표목 (MeSH)의 Iron-binding+proteins
