네비라핀
| |
| |
| 체계적 명칭 (IUPAC 명명법) | |
|---|---|
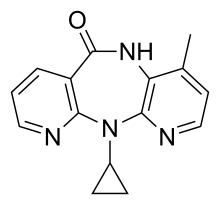
| 11-cyclopropyl-4-methyl-5,11-dihydro-6H- dipyrido[3,2-b:2′,3′-e][1,4]diazepin-6-one | |
| 식별 정보 | |
| CAS 등록번호 | ? |
| ATC 코드 | J05AG01 |
| PubChem | ? |
| 화학적 성질 | |
| 화학식 | C15H14N4O |
| 분자량 | ? |
| 약동학 정보 | |
| 생체적합성 | 93% ± 9% |
| 동등생물의약품 | ? |
| 약물 대사 | 간 |
| 생물학적 반감기 | 45시간 |
| 배출 | 신장: <6% (Parent drug) 담관 <5% (Parent drug) |
| 처방 주의사항 | |
| 허가 정보 | |
| 임부투여안전성 | B3(오스트레일리아) ?(미국) |
| 법적 상태 | |
| 투여 방법 | 경구 |
네비라핀(Nevirapine, NVP)은 상품명 비라뮨(Viramune)으로 HIV/AIDS를 치료하고 예방하기 위해 사용되는 약물이며 특히 HIV-1에 대해 작용한다.[3] 보통 항레트로바이러스 약제(antiretroviral therapy, ART)와 함께 사용이 추천된다.[3] 산모가 태아에게 출산 동안 HIV를 전달하는 것을 예방하기 위한 목적으로도 사용될 수 있지만 다른 노출로 인한 위험으로 인해 추천되지는 않는다.[3] 경구 복용한다.[3]
흔한 부작용으로 발진, 두통, 오심, 피로, 간기능 이상을 포함한다.[3] 간기능 이상과 피부 발진은 심각할 수 있고 치료 시작 후 처음 몇 달간 확인이 필요하다.[3][4] 임신 기간 동안 안전하며 역전사 효소의 기능을 막는 기전으로 작용하는 non-nucleoside reverse transcriptase inhibitor(NNRTI)로 분류된다.[3]
네비라핀은 1996년 미국에서 의학적 사용으로 승인되었다.[3] 네비라핀은 WHO 필수 의약품 목록에 등록되었다.[5] 현재 제네릭 의약품으로 허가되었다.[3]
효능[편집]
네비라핀은 6살 이상의 HIV-1에 감염된 환자들에게 항레트로바이러스 약제와 함께 사용된다. 단독요법은 내성이 생기기 쉬워 권고하지 않는다.[6][7]
네비라핀을 포함한 3중 요법이 항레트로바이러스 약제를 사용한 적이 없는 환자에게서 바이러스 억제에 효과적이라는 사실이 밝혀졌다.[8] 일부 임상시험에서는 네비라핀을 사용한 치료법이 단백질분해효소 억제제(protease inhibitor, PI)[9][10]나 에파비렌즈[11]를 사용한 것에 비해 HIV를 억제하는 능력이 뛰어나다는 결과가 도출되었다.
보통 CD4 세포의 수가 매우 낮을 때에만 사용이 고려된다.[6]
비록 낮은 CD4 세포를 가졌거나 바이러스 수가 높은 환자에게서 네비라핀을 사용한 치료법에 대한 우려가 제기되고는 있지만 하지만 몇몇 분석들은 니베라핀이 위의 집단 환자들에게 충분히 효과적이라고 주장한다.[11]
아이들에게서의 용량은 신체 표면적(BSA)에 따라 결정되지만[6] 최근 체중 기반의 알고리즘이 제시되었다. 이러한 체중 기반 가이드라인은 아주 어린 신생아에게서도 적용할 수 있다.[12]
HIV 수직 감염 예방[편집]
우간다에서 실시한 임상시험 결과에 따르면 산모와 아이가 네비라핀을 복용하면 HIV 수직 감염률을 지도부딘에 비해 약 50%까지 낮출 수 있다.[13] 태국에서 이루어진 연구에 따르면 네비라핀과 지도부딘을 함께 예방용으로 복용하는 것은 지도부딘만 사용하는 것에 비해 훨씬 효과적이었다.[14] 하지만 미국에서 위 논문들에 대한 결점이 발견되었고,[15] 이로 인해 2006년 FDA는 네비라딘을 예방용으로 복용하는 것을 허가하지 않게 되었다.[16]
하지만 HIVNET 012 실험에 대한 지지자들은 위 실험의 결점들이 관료주의적인 시각에 의한 것이라고 주장하며, 예방용으로서의 네비라핀 복용의 효과와 안전성은 과학적으로 확실하기 때문에 이를 무시할 수 없다고 단언한다.[17] 또한 이들은 자원이 부족해 힘겹게 연구를 진행하는 아프리카의 연구자들을 서양 연구자들과 동일하게 생각하는 것은 현실적이지 못하며, 아프리카 연구자들의 업적을 하찮게 대하는 방식은 아프리카 과학 발전을 지연시키는 결과를 낳을 것이라 주장한다.[18] 2013년 9월, 네비라핀이 수유 기간 동안 HIV 수직 감염 예방에 사용될 수 있는가에 대한 임상시험이 이루어졌다.[19]
이러한 논란이 발생하는 이유는 네비라핀을 복용하면 산모와 태아에서 모두 NNRTI(non-nucleoside reverse transcriptase inhibitor) 약물에 대한 내성이 발견되기 때문이며[20] 앞으로 NNRTI를 포함하는 치료법을 수행하는 것에 대해 부정적인 영향을 끼치게 되기 때문이다.[21] 이러한 위험을 줄이기 위해 U.S. Public Health Service Task는 라미부딘/지도부딘을 사용하는 것을 권장하고 있다.[22]
부작용[편집]
가장 흔한 네비라핀의 부작용은 미약하거나 중등도의 발진(13%)이 나타난다는 것이다.[23][24] 심각하거나 생명을 위협할만한 스티븐스-존슨 증후군, 독성 표피 괴사, 과민반응을 포함한 피부반응이 1.5%의 환자들에서 관찰되었다.[23]
네비라핀은 특히 치료 시작 후 6주 후에 심각하거나 생명을 위협할만한 간독성을 보일 수 있다.[23][25] 2000년, 미국의 FDA는 네비라핀에 블랙박스 경고(black box warning)를 표기하고 이 약이 간독성과 피부반응에 생명을 위협할 정도의 독성을 나타낼 수 있다는 사실을 경고했다.[2] 특정 집단의(여성의 CD4수>250, 남성의 CD4수>400인 집단) 환자들에게서 나타나는 심각한 수준의 간질환으로 인해 미국 보건복지부(Department of Health and Human Services, DHHS)에서 네비라핀을 아무리 환자들이 네비라핀을 복용함으로서 얻는 이익이 크더라도, 위험요인이 낮은 환자들에게만 사용하도록 제한했다.[25] 미국 질병예방 특별위원회(U.S. Public Health Service Task Force)는 네비라핀을 임신 중 사용하는 것은 네비라핀의 독성을 더욱 악화시키기 때문에 주의해야 한다고 주장한다.[26]
면역재건후 증후군(Immune reconstitution syndrome, IRS)과 지방 재분포(fat redistribution) 역시 네비라핀과 함께 사용하는 경우 관찰된 부작용이다.[2]
미국 FDA는 다음과 같은 증상이 나타날 때 네비라핀을 중단하라고 권고한다[2] :
- 간염과 같은 간질환 관련 증상이나 신호
- 발진이나 전신적 증상 및 전이효소(transaminases)의 증가
- 발진과 전신적 증상
- 심각한 피부반응 및 과민반응
추가적으로 미국 FDA는 초기 6주 동안은 이 시기에 부작용이 발생할 확률이 높으므로 환자가 위의 증상들이 발생하지 않는지 면밀히 모니터링 할 것을 권고한다.[2] 지속적인 모니터링은 초기 18주까지 지속되어야 하며 만약 환자가 간염이나 발진, 과민반응 또는 다른 전신적 증상을 호소하면 네비라핀을 바로 종료하고 다시 사용해서는 안된다.[2]
약물 상호작용[편집]
네비라핀은 CYP3A와 CYP2B6이라는 간효소의 기질이라서 위의 효소들을 억제하는 리토나비르, 포삼프레나비르, 플루코나졸과 같은 약물들과 함께 사용하면 네비라핀의 혈중 농도가 급격히 증가할 수 있다.[27] 반대로 위의 효소들을 유도하는 리팜피신과 같은 약물들은 네비라핀의 혈중 농도를 감소시킬 수 있다.[28]
또한 세인트존스워트(St. John's wort)로 알려진 서양고추나물(Hypericum perforatum)은 CYP3A4와 CYP1A2를 유도하기 때문에 세인트존스워트와 네비라핀을 같이 사용하는 경우 현저하게 네피라핀의 혈중 농도를 낮출 수 있다.[27]
네비라핀은 시토크롬 P450(cytochrome P450), CYP3A4, CYP2B6을 유도하기 때문에 위의 효소에 의해 대사되는 여러 약물들(에파비렌즈, 인디나비르, 로피나비르, 넬피나비르, 사퀴나비르, 클래리트로마이신, 케토코나졸, 호르몬 피임약, 메타돈)의 혈중 농도를 감소시킬 수 있다.[29]
작용기전[편집]
네비라핀은 NNRTI(non-nucleoside reverse transcriptase inhibitor)에 속하는 항레트로바이러스 약물이다.[30] NRTI(nucleoside reverse transcriptase inhibitor)와 NNRTI 모두 바이러스 RNA를 DNA로 번역하는 바이러스의 효소인 역전사 효소(reverse transcriptase)를 억제한다.[31] 다만 중합효소(polymerase)의 활성자리에 결합하는 NRTI와 다르게 NNRTI는 활성자리에서 10 angstrom 떨어져 있는 p66의 서브도메인의 소수성 주머니(NNRTI 주머니로 알려져 있다)에 결합하여 역전사를 NRTI와는 다른 방법으로 억제한다.[32]
네비라핀은 HIV-2의 역전사 효소의 주머니가 HIV-1과는 다른 구조를 가졌기 때문에 HIV-2에 효과적이지 않으며 이는 HIV-2가 NNRTI 약물들에 내성을 가진다는 사실을 의미한다.[33]
네비라핀의 내성은 바이러스의 복제가 완전히 억제되지 않았을 때 빠르게 발전한다.[34] 네비라핀 치료 후 가장 흔하게 관찰되는 바이러스 돌연변이는 Y181C와 K103N이며 이들은 네비라핀 외의 다른 NNRTI 약물들에서도 발견된다.[35][36] 모든 NNRTI 약물들이 같은 주머니에 결합하기 때문에 네비라핀에 내성을 가지는 바이러스 종들은 보통 다른 NNRTI 약물들(에파비렌즈, 델라비르딘)에서도 내성을 나타낸다.[37] 그러나 2세대 NNRTI 약물들(릴피비린, 에트라비린)의 경우 네비라핀과 같은 1세대 NNRTI 약물들에 비해 HIV 종들의 내성 치료에 효과적이다.[38]
역사[편집]
네비라핀은 Karl D. Hargrave과 Boehringer Ingelheim Pharmaceuticals, Inc.의 동료가 함께 발견했다.[39] 네비라핀은 지금까지 미국의 환자 5,366,972명을 치료하는데 사용되었다.[40] 네비라핀은 1996년 6월 21일에 FDA에서 허가된 최초의 NNRTI이다.[41] 네비라핀은 이후 유럽에서도 1997년 허가되었다.[42]
사회와 문화[편집]
이전 미국 대통령 조지 워싱턴의 PEPFAR funding이 5억달러가 모여 네비라핀을 포함한 여러 의학적 프로그램들이 아프리카 에이즈 환자들을 치료하는데 사용되었다.[43]
각주[편집]
- ↑ “Viramune- nevirapine suspension Viramune- nevirapine tablet”. 《DailyMed》. 2019년 10월 28일. 2020년 11월 19일에 확인함.
- ↑ 가 나 다 라 마 바 “Viramune- nevirapine tablet, extended release”. 《DailyMed》. 2019년 10월 25일. 2020년 11월 19일에 확인함.
- ↑ 가 나 다 라 마 바 사 아 자 “Nevirapine”. 《https://web.archive.org/web/20161220121202/https://www.drugs.com/monograph/nevirapine.html》. The American Society of Health-System Pharmacists. 2016년 12월 20일. 2016년 12월 3일에 확인함.
|웹사이트=에 외부 링크가 있음 (도움말) - ↑ Hamilton, Richart (2015). 《Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition》. Jones & Bartlett Learning. 63쪽.
- ↑ WHO (2019). 《World Health Organization model list of essential medicines: 21st list 2019》. WHO.
- ↑ 가 나 다 “Viramune- nevirapine suspension Viramune- nevirapine tablet”. 《DailyMed》. 2019년 10월 28일. 2020년 11월 19일에 확인함.
- ↑ “Viramune- nevirapine tablet, extended release”. 《DailyMed》. 2019년 10월 25일. 2020년 11월 19일에 확인함.
- ↑ Montaner JS, Reiss P, Cooper D (Mar 1998). “A randomized, double-blind trial comparing combinations of nevirapine, didanosine, and zidovudine for HIV-infected patients: the INCAS Trial. Italy, The Netherlands, Canada and Australia Study”. 《JAMA》.
- ↑ van Leeuwen R, Katlama C, Murphy RL (May 2003). “A randomized trial to study first-line combination therapy with or without a protease inhibitor in HIV-1-infected patients”. 《AIDS》.
- ↑ Podzamczer D, Ferrer E, Consiglio E (2002). “A randomized clinical trial comparing nelfinavir or nevirapine associated to zidovudine/lamivudine in HIV-infected naive patients (the Combine Study)”. 《Antiviral Therapy》.
- ↑ 가 나 van Leth F, Andrews S, Grinsztejn B (March 2005). “The effect of baseline CD4 cell count and HIV-1 viral load on the efficacy and safety of nevirapine or efavirenz-based first-line HAART”. 《AIDS》.
- ↑ “Panel on Antiretroviral Therapy and Medical Management of HIV-Infected Children: Guidelines for the use of antiretroviral agents in pediatric HIV infection.”. AIDSinfo, U.S. Department of Health and Human Services (HHS). March 2016. 2016년 11월 7일에 원본 문서에서 보존된 문서. 2016년 11월 5일에 확인함.
- ↑ Guay LA, Musoke P, Fleming T (Sep 1999). “Intrapartum and neonatal single-dose nevirapine compared with zidovudine for prevention of mother-to-child transmission of HIV-1 in Kampala, Uganda: HIVNET 012 randomised trial”. 《Lancet》.
- ↑ Lallemant M, Gonzague Jourdain G, Sophie Le Coeur S, et al. (2004) Single-Dose Perinatal Nevirapine plus Standard Zidovudine to Prevent Mother-to-Child Transmission of HIV-1 in Thailand. N Engl J Med 351: 217-28, 보관됨 2006-06-18 - 웨이백 머신
- ↑ The HIVNET 012 Study and the Safety and Effectiveness of Nevirapine in Preventing Mother-to-Infant Transmission of HIV, “Archived copy”. 2009년 2월 1일에 원본 문서에서 보존된 문서. 2009년 1월 23일에 확인함.
- ↑ Celia Farber, "Out of Control: AIDS and the Corruption of Science" “Archived copy”. 2009년 5월 4일에 원본 문서에서 보존된 문서. 2009년 6월 11일에 확인함.
- ↑ Johanna Crane (2010년 8월 17일). “Adverse events and placebo effects: African scientists, HIV, and ethics in the ‘global health sciences’”. SAGE Journals. 2021년 5월 5일에 확인함.
- ↑ Lock, M. & Nguyen, V 2010, an Anthropology of Biomedicine, Malden, Wiley-Blackwell.
- ↑ “Archived copy”. 2008년 12월 5일에 원본 문서에서 보존된 문서. 2009년 1월 23일에 확인함.
- ↑ Johnson JA, Li JF, Morris L (Jul 2005). “Emergence of drug-resistant HIV-1 after intrapartum administration of single-dose nevirapine is substantially underestimated”. 《J Infect Dis》 192 (1): 16–23. doi:10.1086/430741. PMID 15942889.
- ↑ Jourdain G, Ngo-Giang-Huong N, Le Coeur S (Jul 2004). “Intrapartum exposure to nevirapine and subsequent maternal responses to nevirapine-based antiretroviral therapy”. 《N Engl J Med》 351 (3): 229–40. doi:10.1056/NEJMoa041305. PMID 15247339.
- ↑ Panel on Treatment of HIV-Infected Pregnant Women and Prevention of Perinatal Transmission. Recommendations for use of antiretroviral drugs in pregnant HIV-1-infected women for maternal health and interventions to reduce perinatal HIV transmission in the United States. “Archived copy” (PDF). 2014년 4월 12일에 원본 문서에서 보존된 문서. 2014년 4월 11일에 확인함.. Accessed 16 November 2016.
- ↑ 가 나 다 Viramune (nevirapine) tablets; Viramune (nevirapine) oral suspension prescribing information 보관됨 2006-11-12 - 웨이백 머신
- ↑ “Facts sheet from the AIDS Treatment Data Network”. 2006년 1월 13일에 원본 문서에서 보존된 문서. 2006년 1월 16일에 확인함.
- ↑ 가 나 DHHS panel. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents (May 4, 2006). (Available for download from AIDSInfo 보관됨 2006-05-06 - 웨이백 머신)
- ↑ Panel on Treatment of HIV-Infected Pregnant Women and Prevention of Perinatal Transmission. Recommendations for use of antiretroviral drugs in pregnant HIV-1-infected women for maternal health and interventions to reduce perinatal HIV transmission in the United States. “Archived copy” (PDF). 2014년 4월 12일에 원본 문서에서 보존된 문서. 2014년 4월 11일에 확인함.. Accessed 16 November 2016.
- ↑ 가 나 “VIRAMUNE® (nevirapine) Prescribing Information” (PDF). 2016년 11월 8일에 원본 문서 (PDF)에서 보존된 문서.
- ↑ Keith Alcorn (2010년 11월 16일). “Nevirapine / rifampicin interaction linked to higher recurrence of TB in people on ART”. 《Aidsmap》.
- ↑ Viramune (nevirapine) tablets; Viramune (nevirapine) oral suspension prescribing information 보관됨 2006-11-12 - 웨이백 머신
- ↑ Patel SS, Benfield P (Oct 1996). “New drug profile: nevirapine”. 《Clinical Immunotherapeutics》 6 (4): 307–317. doi:10.1007/BF03259093.
- ↑ John Brunstein, PhD (John Brunstein, PhD). “Reverse transcriptase inhibitors: NRTIs vs NNRTIs”. 《MLO》.
- ↑ Schauer, Grant D.; Huber, Kelly D.; Leuba, Sanford H.; Sluis-Cremer, Nicolas (2014년 10월 13일). “Mechanism of allosteric inhibition of HIV-1 reverse transcriptase revealed by single-molecule and ensemble fluorescence”. 《Nucleic Acids Research》 (영어) 42 (18): 11687–11696. doi:10.1093/nar/gku819. ISSN 0305-1048. PMC 4191400. PMID 25232099.
- ↑ Ren J, Bird LE, Chamberlain PP, Stewart-Jones GB, Stuart DI, Stammers DK (Oct 2002). “Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors”. 《Proc Natl Acad Sci USA》 99 (22): 14410–5. doi:10.1073/pnas.222366699. PMC 137897. PMID 12386343.
- ↑ Montaner JS, Reiss P, Cooper D (Mar 1998). “A randomized, double-blind trial comparing combinations of nevirapine, didanosine, and zidovudine for HIV-infected patients: the INCAS Trial. Italy, The Netherlands, Canada and Australia Study”. 《JAMA》 279 (12): 930–7. doi:10.1001/jama.279.12.930. PMID 9544767.
- ↑ Viramune (nevirapine) tablets; Viramune (nevirapine) oral suspension prescribing information 보관됨 2006-11-12 - 웨이백 머신
- ↑ Conway B, Wainberg MA, Hall D (Jul 2001). “Development of drug resistance in patients receiving combinations of zidovudine, didanosine and nevirapine”. 《AIDS》 15 (10): 1269–74. doi:10.1097/00002030-200107060-00008. PMID 11426071. S2CID 24944611.
- ↑ Sonya J Snedecor 외 6인 (2013 Aug). “The prevalence of transmitted resistance to first-generation non-nucleoside reverse transcriptase inhibitors and its potential economic impact in HIV-infected patients”. 《PLoS One》.
- ↑ Joshua J Minuto, Richard Haubrich (2008 Nov 1). “Etravirine: a second-generation NNRTI for treatment-experienced adults with resistant HIV-1 infection”. 《Futur HIV Ther.》.
- ↑ Karl Grozinger, John Proudfoot, Karl Hargrave (June 2006). “Discovery and Development of Nevirapine”. 《Current Opinion in Drug Discovery & Development》.
- ↑ “Uspto patient full-text and image database - Nevirapin”. 《Uspto patient full-text and image database》. 2018년 9월 20일에 원본 문서에서 보존된 문서. 2021년 5월 24일에 확인함.
- ↑ “FDA approves first new class of HIV drugs. Food and Drug Administration”. 《AIDS Alert》. 1996 Aug.
- ↑ “Once-daily nevirapine approved in Europe”. 《Once-daily nevirapine approved in Europe》. 2011년 10월 1일.
- ↑ 2021 Annual Report to Congress (2021). “The United States President’s Emergency Plan for AIDS Relief”.
