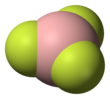삼플루오르화 붕소
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
Boron trifluoride
| |||
| 체계명
Trifluoroborane | |||
| 별칭
Boron fluoride, Trifluoroborane
| |||
| 식별자 | |||
| |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.699 | ||
| EC 번호 |
| ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | compressed: 1008. boron trifluoride dihydrate: 2851. | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| BF 3 | |||
| 몰 질량 | 67.82 g/mol (anhydrous) 103.837 g/mol (dihydrate) | ||
| 겉보기 | colorless gas (anhydrous) colorless liquid (dihydrate) | ||
| 냄새 | Pungent | ||
| 밀도 | 0.00276 g/cm3 (anhydrous gas) 1.64 g/cm3 (dihydrate) | ||
| 녹는점 | −126.8 °C (−196.2 °F; 146.3 K) | ||
| 끓는점 | −100.3 °C (−148.5 °F; 172.8 K) | ||
| exothermic decomposition[1] (anhydrous) very soluble (dihydrate) | |||
| 용해도 | soluble in benzene, toluene, hexane, chloroform and methylene chloride | ||
| 증기 압력 | >50 atm (20 °C)[2] | ||
| 0 D | |||
| 열화학 | |||
열용량 (C)
|
50.46 J/(mol·K) | ||
표준 몰 엔트로피 (S
|
254.3 J/(mol·K) | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−1137 kJ/mol | ||
기브스 자유 에너지 (ΔfG˚)
|
−1120 kJ/mol | ||
| 위험[4][5] | |||
| 물질 안전 보건 자료 | ICSC | ||
| GHS 그림문자 |    
| ||
| 신호어 | 위험 | ||
| H280, H330, H314, H335, H373 | |||
| P260, P280, P303+361+353, P304+340, P310, P305+351+338, P403+233 | |||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | Nonflammable | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LC50 (median concentration)
|
1227 ppm (mouse, 2 hr) 39 ppm (guinea pig, 4 hr) 418 ppm (rat, 4 hr)[3] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
C 1 ppm (3 mg/m3)[2] | ||
REL (권장)
|
C 1 ppm (3 mg/m3)[2] | ||
IDLH (직접적 위험)
|
25 ppm[2] | ||
| 관련 화합물 | |||
다른 음이온
|
|||
다른 양이온
|
|||
관련 화합물
|
일플루오르화 붕소 | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
삼플루오르화 붕소(Boron trifluoride)는 화학식 BF
3를 갖는 무기 화합물이다. 이 자극성, 무색 및 독성 가스는 습한 공기 중에서 흰색 연기를 형성한다. 이는 유용한 루이스산이며 다른 붕소 화합물의 다용도 빌딩 블록이다.
구조와 결합[편집]
BF3 분자의 기하학적 구조는 삼각형 평면이다. D3h 대칭은 VSEPR 이론의 예측과 일치한다. 분자는 대칭성이 높기 때문에 쌍극자 모멘트가 없다. 분자는 탄산염 음이온인 CO2−
3와 등전자이다.
BF3는 일반적으로 루이스 염기에 대한 발열 반응에 의해 강화되는 설명인 "전자 결핍"이라고 한다.
삼할로겐화붕소인 BX3에서 B-X 결합의 길이(1.30Å)는 단일 결합에서 예상되는 것보다 짧으며, 이러한 짧은 것은 불소에서 B-X 파이 결합이 더 강하다는 것을 나타낼 수 있다. 손쉬운 설명은 불소 원자에 있는 3개의 유사한 방향의 p 오비탈의 동위상 조합과 붕소 원자의 p 오비탈의 대칭 허용 중첩을 불러온다. 다른 사람들은 BF3 결합의 이온 특성을 지적한다.
각주[편집]
- ↑ 《Prudent Practices in the Laboratory》. 《nap.edu》. 1995년 8월 16일. doi:10.17226/4911. ISBN 978-0-309-05229-0. 2014년 12월 14일에 원본 문서에서 보존된 문서. 2018년 5월 7일에 확인함.
- ↑ 가 나 다 라 NIOSH Pocket Guide to Chemical Hazards. “#0062”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ “Boron trifluoride”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Index no. 005-001-00-X of Annex VI, Part 3, to Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OJEU L353, 31.12.2008, pp 1–1355 at p 341.
- ↑ 〈Boron trifluoride〉, 《Pocket Guide to Chemical Hazards》, U.S. Department of Health and Human Services (NIOSH) Publication No. 2005-149, Washington, DC: Government Printing Office, 2005, ISBN 9780160727511.
- ↑ Inc, New Environment. “New Environment Inc. - NFPA Chemicals”. 《www.newenv.com》. 2016년 8월 27일에 원본 문서에서 보존된 문서. 2018년 5월 7일에 확인함.
외부 링크[편집]
- “Safety and Health Topics: Boron Trifluoride”. OSHA.
- “BORON TRIFLUORIDE ICSC: 0231”. 《International Chemical Safety Cards》. CDC. 2017년 11월 23일에 원본 문서에서 보존된 문서. 2017년 9월 8일에 확인함.
- “Boron & Compounds: Overview”. 《National Pollutant Inventory》. Australian Government.
- “Fluoride Compounds: Overview”. 《National Pollutant Inventory》. Australian Government.
- “Boron trifluoride”. 《WebBook》. NIST.
- “Boron Trifluoride (BF3) Applications”. Honeywell. 2012년 1월 29일에 원본 문서에서 보존된 문서. 2012년 2월 14일에 확인함.