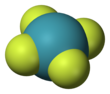
사플루오린화 제논

| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름
Xenon tetrafluoride
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.033.858 | ||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| XeF 4 | |||
| 몰 질량 | 207.2836 g mol−1 | ||
| 겉보기 | White solid | ||
| 밀도 | 4.040 g cm−3, solid | ||
| 녹는점 | 117 °C (243 °F; 390 K) sublimes[1] | ||
| Reacts | |||
| 구조 | |||
| D4h | |||
| square planar | |||
| 0 D | |||
| 열화학 | |||
표준 몰 엔트로피 (S
|
146 J·mol−1·K−1[2] | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−251 kJ·mol−1[2] | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
사플루오린화 제논(Xenon tetrafluoride, 화학식 XeF
4)은 제논 원자와 플루오린 원자가 결합한 화합물이다. 최초로 발견된 비활성 기체의 이진상 화합물이다.[3] 제논과 플루오린 F
2의 화학 반응을 통해 합성시킨다. 화학반응식은 다음과 같다.[4][5]
- Xe + 2 F
2 → XeF
4
이 과정은 발열 과정이며 제논 원자가 251 kJ/mol의 에너지를 방출한다.[3]
사플루오린화 제논은 상온에서 무색의 결정체 고체 형태이다. 결정 구조는 1963년 핵자기 공명 분광법(NMR 분광법)과 X선 결정학 연구를 통해 밝혀졌다.[6][7] 원자가껍질 전자쌍 반발 이론에 따라 화합물의 분자 구조는 평면 사각형을 이룬다.[8]
합성[편집]
사플루오린화 제논은 니켈 용기 안에 제논과 플루오린을 1:5의 비율로 혼합한 기체를 400 °C까지 가열하여 합성한다. 합성 과정에서 육플루오린화 제논 XeF
6도 같이 생성되며 혼합 기체에서 플루오린의 농도가 높아질수록 육플로오린화 제논 화합물의 생성 비율도 같이 높아진다.[9] 합성 반응에서 니켈은 촉매 역할을 하지 않는다. 대신 니켈 용기가 플루오린과 반응하며 표면에 보호막인 플루오린화 니켈(II) NiF
2을 만들기 때문에 주로 니켈로 만든 용기를 사용한다.
화학 반응[편집]
사플루오린화 제논은 저온에서 물과 반응에 가수분해되어 원소 제논, 산소, 플루오린화 수소산, 삼산화 제논 등의 화합물을 만든다.[10]
또한 사차암모늄 양이온 플루오린화물과 반응하여 오각형의 음이온기 XeF−
5가 있는 오플루오르제논화 사메틸암모늄을 생성한다. XeF−
5 음이온은 플루오린화 세슘과의 다음 반응에서도 생성된다.[11]
- CsF + XeF
4 → CsXeF
5
오플루오린화 비스무트 (BiF
5)와의 반응에서는 XeF+
3 양이온을 만든다.[12]
- BiF
5 + XeF
4 → XeF3BiF6
XeF+
3 양이온은 XeF3Sb2F11염에서 NMR 분광법을 통해 특정하였다.[13]
400 °C에서 XeF
4는 제논 기체와 반응하여 이플루오린화 제논 XeF
2을 만들어낸다.[9]
- XeF4 + Xe → 2 XeF2
또한 백금과도 반응하여 사플루오린화 백금 PtF
4을 만들고 제논 기체를 방출한다.[9]
- XeF4 + Pt → PtF4 + Xe
각주[편집]
- ↑ 가 나 Arnold F. Holleman; Egon Wiberg (2001). Nils Wiberg, 편집. 《Inorganic chemistry》. 번역 Mary Eagleson; William Brewer. Academic Press. 394쪽. ISBN 0-12-352651-5.
- ↑ 가 나 Zumdahl, Steven S. (2009). 《Chemical Principles》 6판. Houghton Mifflin Company. A23쪽. ISBN 0-618-94690-X.
- ↑ 가 나 Zumdahl (2007). 《Chemistry》. Boston: Houghton Mifflin. 243쪽. ISBN 0-618-52844-X.
- ↑ Claassen, H. H.; Selig, H.; Malm, J. G. (1962). “Xenon Tetrafluoride”. 《J. Am. Chem. Soc.》 84 (18): 3593. doi:10.1021/ja00877a042.
- ↑ C. L. Chernick; H. H. Claassen; P. R. Fields; H. H. Hyman; J. G. Malm; W. M. Manning; M. S. Matheson; L. A. Quarterman; F. Schreiner; H. H. Selig; I. Sheft; S. Siegel; E. N. Sloth; L. Stein; M. H. Studier; J. L. Weeks & M. H. Zirin (1962). “Fluorine Compounds of Xenon and Radon”. 《Science》 138 (3537): 136–138. Bibcode:1962Sci...138..136C. doi:10.1126/science.138.3537.136. PMID 17818399.
- ↑ Thomas H. Brown; E. B. Whipple & Peter H. Verdier (1963). “Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum”. 《Science》 140 (3563): 178. Bibcode:1963Sci...140..178B. doi:10.1126/science.140.3563.178. PMID 17819836.
- ↑ James A. Ibers & Walter C. Hamilton (1963). “Xenon Tetrafluoride: Crystal Structure”. 《Science》 139 (3550): 106–107. Bibcode:1963Sci...139..106I. doi:10.1126/science.139.3550.106. PMID 17798707.
- ↑ Burns, John H.; Agron, P. A.; Levy, Henri A (1963). “Xenon Tetrafluoride Molecule and Its Thermal Motion: A Neutron Diffraction Study”. 《Science》 139 (3560): 1208–1209. Bibcode:1963Sci...139.1208B. doi:10.1126/science.139.3560.1208. PMID 17757912.
- ↑ 가 나 다 Allen J. Bard; Roger Parsons; Joseph Jordan; International Union of Pure and Applied Chemistry (1985). 《Standard Potentials in Aqueous Solution》. CRC Press. 767–768쪽. ISBN 0-8247-7291-1.
- ↑ Williamson; Koch, C. W. (Mar 1963). “Xenon Tetrafluoride: Reaction with Aqueous Solutions”. 《Science》 139 (3559): 1046–1047. Bibcode:1963Sci...139.1046W. doi:10.1126/science.139.3559.1046. ISSN 0036-8075. PMID 17812981.
- ↑ Charlie Harding; David Arthur Johnson; Rob Janes (2002). 《Elements of the p block (Volume 9 of Molecular world)》. Royal Society of Chemistry. 93쪽. ISBN 0-85404-690-9.
- ↑ Hitomi Suzuki; Yoshihiro Matano (2001). 《Organobismuth chemistry》. Elsevier. 8쪽. ISBN 0-444-20528-4.
- ↑ Gillespie, R. J.; B. Landa; G. J. Schrobilgen (1971). “Trifluoroxenon(IV)µ-fluoro-bispentafluoroantimonate(V): the XeF+
3 cation”. 《Journal of the Chemical Society D: Chemical Communications》 (23): 1543–1544. doi:10.1039/C29710001543.
외부 링크[편집]
- xenon tetrafluoride NIST 정보 Archived 2020년 10월 24일 - 웨이백 머신